
利用酶联免疫吸附试验(ELISA)和商品化磁微粒化学发光法(CLIA)检测新型冠状病毒(SARS-CoV-2)疫苗(简称新冠疫苗)免疫后IgG抗体,并与中和试验(NT)结果进行比较,探讨两种酶免方法与中和试验结果的一致性。
分别用ELISA、CLIA和NT检测143个健康人接种2剂新冠疫苗免疫前和免疫后28 d的新冠抗体,计算3种方法获得的抗体阳转率、定量结果,分析定量结果之间的关系。
ELISA、CLIA及NT检测新冠疫苗抗体阳转率分别为97.9%、98.6%和85.3%。ELISA定量检测免疫后血浆最高稀释度的几何均数为586.6;CLIA S/CO值的均值为11.26;NT的抗体几何平均滴度为7.6; ELISA、CLIA与NT定量结果的相关系数分别为0.69(P<0.01)和0.65(P<0.01),ELISA与CLIA定量检测的相关系数为0.79(P<0.01)。
3种方法均检测到新冠疫苗免疫后抗体达到较高水平,ELISA、CLIA用于检测新冠疫苗免疫后的IgG抗体结果比较一致,同时与NT定量检测结果相关性较好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
截至2021年5月29日,中国新型冠状病毒(SARS-CoV-2)疫苗(简称新冠疫苗)接种已超过6亿剂次(中华人民共和国国家卫生健康委员会,http://www.nhc.gov.cn/)。随着新冠疫苗的应用,疫苗接种后抗体的产生已成为人们关心的问题。SARS-CoV-2 RNA编码4个结构蛋白,分别为刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N)。其中S蛋白中的受体结合域(RBD)被认为会引发高度有效的中和抗体[1]。为评价疫苗接种后抗体的产生情况,需要建立高敏感度和特异度的实验室检测方法。目前,中和试验(NT)方法仍然是评价疫苗免疫效果和免疫原性的金标准,但NT对实验条件和人员的要求较高,因此我们比较了两种方法:酶联免疫吸附试验(ELISA,本实验室自建)和商品化磁微粒化学发光法(CLIA),检测新冠疫苗接种前和接种后机体针对RBD抗原产生的IgG抗体的情况,并将这两种方法的检测结果同中和试验进行比较,探讨这两种酶免方法与中和试验结果的相关性及评价这两种酶免方法是否适合用于疫苗免疫原性评价。
采集完成新冠病毒灭活疫苗2剂免疫接种的143个健康人的免疫前和免疫后双份血,共286份血浆标本。采血时间为第1剂疫苗接种前及第2剂疫苗接种后28 d。受种者均为18~59岁成人,2剂疫苗接种间隔为14 d。
使用0.2 μg/ml的SARS-CoV-2 RBD抗原(lot:40592-V08B, Sino Biological),包被酶标板;选择HRP标记的羊抗人IgG(SAB3701283,Sigma)作为二抗,进行酶联免疫反应,读取450 nm和620 nm处的吸光度(A)值。定性检测结果以将血浆进行1∶200稀释后的A值与cutoff值比值判定。待测样本的A值与cutoff比值≥1,判定为阳性,反之判定为阴性。定量检测结果是将待测血浆从1∶100开始进行2倍梯度稀释,最终稀释度为1∶12 800。以待测样本A值大于cutoff值的最高稀释度作为ELISA相对定量值。经过验证,本实验室建立的ELISA检测方法的敏感度为98.25%,特异度99.33%。
用SARS-CoV-2 IgG抗体检测试剂盒[CLIA,博奥赛斯(天津)生物科技有限公司]进行化学发光法的检测。检测的抗体为针对RBD的特异性IgG抗体。结果以待检样本发光值(S)与cutoff(CO)的比值(S/CO值)表示。S/CO值≥1判定为阳性,反之判定为阴性。
采用微量细胞中和试验的方法,在生物安全三级(BSL3)实验室进行实验。选择的毒株为SARS-CoV-2/human/CHN/CN1/2020,GenBank编号为:MT407649。由于血浆样品会影响细胞的附着,因此在进行中和试验前对血浆样本进行了处理:使用0.125 mol/L氯化钙和33.33 IU/ml凝血酶(T7009-100UN, Sigma)混合溶液,按照血浆和混合溶液9∶1的比例进行血浆处理,4℃过夜后,3 000 r/min,离心15 min。无菌吸取上清液,备用[2]。待测处理血浆预先经1∶4倍稀释后,置56℃水浴灭活30 min。从1∶4开始进行2倍梯度稀释。最终稀释度为1∶512。在稀释好待检样本的96孔培养板各孔中均加入含100CCID50的病毒液,血清对照孔补加等量的稀释液。将所有培养板放入37℃细胞培养箱中和2 h。中和后每孔加Vero细胞悬液,放置37℃培养箱培养5 d。同时设正常细胞对照。用Karber法计算中和终点,即能够保护50%细胞不受100CCID50病毒感染的血清最高稀释度为该血清的抗体滴度[2]。待检样本中和抗体结果≥1∶4判定为阳性,<1∶4判定为阴性。
用Excel和SPSS17.0软件分别对ELISA、CLIA与NT检测结果的相关性等进行分析。
对286份免疫前后血浆用ELISA、CLIA及NT进行检测。143份免前血浆3种方法的检测结果均为阴性。143份免后血浆,ELISA方检测结果有3份为阴性,阳转率为97.9%(140/143);CLIA检测结果有2份为阴性,阳转率为98.6%(141/143) ; NT检测结果有21份为阴性,阳转率为85.3%(122/143)。免疫后标本使用3种方法检测新冠抗体定性结果见表1。

免疫后SARS-CoV-2抗体ELISA、CLIA及NT定性结果比较
Comparison of SARS-CoV-2 antibody qualitative results of ELISA, CLIA and NT after immunity
免疫后SARS-CoV-2抗体ELISA、CLIA及NT定性结果比较
Comparison of SARS-CoV-2 antibody qualitative results of ELISA, CLIA and NT after immunity
| 酶免方法 | 检测结果 | NT结果(份) | |
|---|---|---|---|
| + | - | ||
| ELISA | + | 121 | 19 |
| - | 1 | 2 | |
| CLIA | + | 121 | 20 |
| - | 1 | 1 | |
分别用ELISA方法检测的最高血浆稀释度、CLIA方法的S/CO值及NT的抗体滴度对免疫后血浆检测结果进行定量分析。ELISA方法几何平均血浆稀释度为586.6;CLIA的S/CO值的均值为11.26;NT的平均抗体滴度为7.6。将免疫后143份血浆按中和抗体滴度分为4组,分别为<1∶4、1∶4~1∶8、1∶12~1∶32、1∶48~1∶96,计算每组标本相应ELISA方法几何平均稀释度均值以及最大和最小的稀释区间,CLIA方法S/CO均值以及最大和最小值的区间。表2显示随着中和抗体滴度的升高,ELISA试剂的最高血清稀释度和CLIA方法的S/CO值检测结果的均值也随之增加。
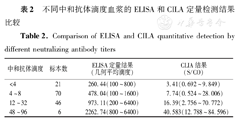
不同中和抗体滴度血浆的ELISA和CILA定量检测结果比较
Comparison of ELISA and CILA quantitative detection by different neutralizing antibody titers
不同中和抗体滴度血浆的ELISA和CILA定量检测结果比较
Comparison of ELISA and CILA quantitative detection by different neutralizing antibody titers
| 中和抗体滴度 | 标本数 | ELISA定量结果(几何平均滴度) | CLIA结果(S/CO) |
|---|---|---|---|
| <4 | 21 | 260.44(100~800) | 3.41(0.692~9.849) |
| 4~8 | 70 | 478.04(100~1600) | 7.74(0.524~28.006) |
| 12~32 | 46 | 973.11(200~6400) | 16.39(2.756~70.772) |
| 48~96 | 6 | 2262.74(800~6400) | 40.583(12.788~84.596) |
将ELISA方法和NT方法测得的SARS-CoV-2抗体定量结果进行对数(Log)转换,然后对ELISA、CLIA和NT这3种方法的定量检测结果两两比较进行相关性分析。结果显示,ELISA方法与NT结果的相关系数为0.69(P<0.01),而CLIA方法与NT结果的相关性为0.65(P<0.01,图1)。ELISA方法与CLIA方法的相关性为0.79(P<0.01)。
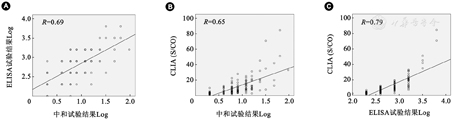

注:A:ELISA与NT的相关性分析;B:CLIA与NT的相关性分析;C:ELISA与CLIA的相关性分析
新冠疫苗已经开始在全国大规模接种。评价疫苗免疫效果很重要的方法是检测免疫接种后抗体产生情况。因此我们希望通过比较,找到简便易行,可以检测大量标本,同时要与中和试验有较好一致性的试验方法,才能正确反映疫苗的保护效果。用于新冠疫苗大规模接种后的抗体检测。
目前常用的抗体检测方法有ELISA、CLIA、NT和胶体金检测法(colloid gold test)等。胶体金检测法虽然简单快速,但准确性不高,无法定量,只用于快速初步筛检。ELISA是最常用的抗体检测方法,不仅具有较好的敏感性和特异性,同时还具有易标准化、操作方便、能快速获得结果等优点。CLIA法是近几年发展起来的酶联免疫方法,其优点是操作方便,结果稳定,人为因素少,但需要专门的仪器和配套的试剂进行操作。
当前用于检测和定量血液样本中功能性抗体的金标准是病毒NT[3]。NT有3种方法,分别为蚀斑减少中和试验(PRNT)、微量中和试验(MRNT)和假病毒中和测定法(PBNA)。PRNT对病毒蚀斑进行计数,在每个选定的病毒活性降低百分比(通常为50%或90%)下,计算PRNT终点滴度。PRNT的缺点是劳动强度大,不易适应高通量,因此难以用于大规模的监测和疫苗试验[4]。MRNT通过在微孔板中观察细胞病变,获得能保护50%细胞不被感染抗体滴度。此方法更适合处理大量样品。但是,所有病毒中和试验均涉及到活病毒的操作,对于新冠病毒来说,只能在BSL3实验室环境中进行,这极大地限制了可以操作这些实验的实验室的数量[5,6]。PBNA通过用不同的外膜蛋白或包膜蛋白模拟活病毒的感染过程,提供包膜前蛋白。假病毒无活性病毒成分,只需要进行一轮复制。相对于PRNT和MRNT方法,PBNA是一种灵敏、准确、重复性好的方法。与活病毒法相比,PBNA法更客观、操作更简单[7]。但现在仍未有公认的可作为金标准的方法。
因我国对SARS-CoV-2流行的成功控制,免疫前人群SARS-CoV-2抗体均为阴性,本研究利用免疫前血标本可以验证3种实验方法的特异性,排除血标本本底阳性等干扰因素,使免疫后的检测结果更加可靠。
本实验室分别使用SARS-CoV-2 RBD蛋白、S蛋白全长、S1蛋白、S2蛋白以及N蛋白进行了ELISA检测。选择149份疫苗免前标本作为阴性组,57例确诊病例血清作为阳性组,进行相应抗体检测的敏感性和特异性分析。分析发现,使用RBD蛋白进行ELISA检测方法的ROC曲线下面积为0.999,敏感度为98.25%,特异度为99.33%,均高于使用其他蛋白质的检测,因此最终选择RBD蛋白作为包被抗原进行检测。
我们采用ELISA方法血清稀释度、CLIA方法采用S/CO值进行相对定量。经过与NT的对比发现,血清稀释度和S/CO比值能在一定程度上反映抗体水平的高低。3种方法检测定量结果显示,ELISA方法、CLIA法与中和试验结果的相关系数分别为0.69和0.65。Weidner等[8]评估了3种商品化的ELISA试剂和2种CLIA试剂,相关系数与本次研究相似。这些结果表明,酶免方法检测新冠IgG抗体与NT检测结果有一定的相关性。
本研究采用经处理的血浆进行中和抗体的检测,受试者完成2剂接种后28 d中和抗体的阳转率为85.3%(122/143);在本实验室的另一项研究中,采用相同厂家疫苗,相同接种程序,相同时间间隔的18~59岁健康人的血清进行中和试验,中和抗体的阳转率为87.9%(328/373)。对两种类型标本的中和抗体阳转率进行卡方检验(χ2=0.637,P=0.425),证明血清和处理过的血浆检测中和抗体差异无统计学意义,因此将血浆按照本文的处理方法进行实验,不会影响NT的结果。
科兴中维疫苗对于18~59岁年龄组疫苗Ⅱ期临床试验数据显示,0/14 d接种程序后28 d,抗体阳转率为94.1%[9],高于本研究结果的原因可能为参加疫苗临床试验人群的入组条件相对比较苛刻,而我们的人群仅是按照免疫程序接种过疫苗的人群,这应该是造成抗体阳转率差异的主要原因。我们的数据可能更能反映真实的抗体水平。
间接ELISA方法仅能检测针对包被抗原的特异性IgG抗体,如何用ELISA方法检测中和抗体成为人们研究的热点趋势。通过ELISA竞争法检测新冠中和抗体的试剂应运而生。Müller等[10]评估了2种新冠中和抗体ELISA检测试剂与微量中和试验结果,未发现ELISA方法与微量中和试验结果存在明显的相关性。因此还需要更多的研究加以验证。
本研究使用的3种方法均检测到疫苗免疫后抗体达到较高水平,ELISA、CLIA方法用于检测新冠疫苗免疫后的IgG抗体结果比较一致,同时与中和试验定量检测结果相关性较好。但如何建立酶联免疫方法与中和试验之间的关系仍然需要进一步的探索。
所有作者均声明不存在利益冲突



























