
观察超大剂量环磷酰胺为主的联合化疗方案治疗小儿高危神经母细胞瘤(NB)产生的毒副作用的种类、发生率,并总结其临床防治措施。
选取首都医科大学附属北京儿童医院血液肿瘤病房确诊的高危NB患儿,均予BCH-NB-HR(北京儿童医院神经母细胞瘤高危组)化疗方案,接受超大剂量环磷酰胺为主的CAV方案(环磷酰胺、阿霉素、长春新碱)2个疗程以上者为研究对象。对于患儿在第1-2疗程的CAV方案化疗期间的临床症状、体征及血常规、血生化等实验室检查指标进行回顾性总结分析。根据《WHO抗癌药物急性及亚急性毒性反应分级标准》观察毒副反应。
本研究共有33例NB患儿符合研究标准,累计给予超大剂量环磷酰胺为主的化疗方案共66例次。患儿均出现骨髓抑制,粒细胞发生Ⅳ度毒性共56例次(84.8%),WBC(<1.0×109/L)Ⅳ度毒性共56例次(84.8%),血小板(<25×109/L)Ⅳ度毒性共19例次(28.8%),Hb(<65 g/L)Ⅳ度毒性共4例次(6.06%);消化系统毒性:恶心、呕吐发生率为100.0%,继发感染共40例次(60.6%);泌尿系统毒性:出血性膀胱炎仅1例次(1.52%);心脏毒性Ⅰ度、Ⅱ度、Ⅲ度共3例次(4.55%);皮肤及神经系统毒性均尚未观察到。无化疗相关死亡病例。
超大剂量环磷酰胺为主的CAV方案的毒副作用发生率较高,以骨髓抑制、消化道反应、继发感染为主,出血性膀胱炎及肝、肾、心脏毒性却并不明显,即超大剂量环磷酰胺在完善的支持治疗及严密的监测条件下是可以安全使用的。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经母细胞瘤(NB)是婴幼儿最常见的颅外实体瘤,早期可发生转移,恶性度高。Kaneko等[1]报道高强度化疗可改善MYCN基因扩增的NB高危患者的预后。北京儿童医院以香港高危组NB化疗方案为基础,包括联合化疗、手术切除瘤灶、自体干细胞移植以及维A酸的维持化疗,总疗程1.5~2.0年。化疗方案包括超大剂量环磷酰胺(CTX)为主的CAV方案(CTX、阿霉素和长春新碱)及顺铂和依托泊苷的CVP方案交替应用。基本治疗方针是应用强烈联合化疗尽快缩小瘤灶。在CAV方案中CTX剂量为70 mg/(kg·d),应用2 d,即2.1 g/(m2·次),属于超大剂量CTX(即CTX单次剂量>2 g/m2)。CTX广泛应用于儿童恶性肿瘤的化疗[2],但其毒副作用却不容忽视。本研究对接受治疗的高危NB患儿进行回顾性分析,研究超大剂量CTX为主的化疗方案的毒副反应的发生种类、发生例数、发生率,并总结毒副作用的临床防治措施。
选取2007年3月至2009年2月于首都医科大学附属北京儿童医院经组织病理学和(或)骨髓细胞学诊断并按WHO临床危险度分组标准[3]确诊为高危组的NB患儿35例。排除标准:明确诊断的NB患儿接受超大剂量CTX为主的CAV方案少于2个疗程者或因患儿病情危重及其他原因未行化疗而自动出院者。符合研究标准的病例共33例。男22例,女11例,男女比例为2︰1;初诊时年龄为1~11岁,中位年龄为49.8个月。初诊时病程为2周~1.5年。33例高危NB患者行66次CAV方案化疗。
化疗前患儿查血常规,中性粒细胞绝对值(ANC)>1.0×109/L,血小板>100×1012/L,查肝功能、肾功能、ECG等均大致正常,方给予化疗。化疗期间及化疗后的实验室检查:每2 d查1次血常规,每周查2次血生化(包括肝功能、肾功能、心肌酶等指标),根据患儿临床表现随时查ECG、心脏彩超、胸片、腹部B超、血电解质、血培养、便培养、痰培养、咽拭子培养等。回顾性分析化疗期间患儿症状和体征。根据《WHO抗癌药物毒性反应分级标准》规定WBC<1.0×109/L属于Ⅳ度毒性。
应用SPSS 13.0统计软件,单组数据分析应用Descriptives分析,组间均数比较用t检验,P<0.05为差异有统计学意义。
超大剂量CTX为主的化疗方案发生的毒副作用首位为骨髓抑制(100.0%),以中性粒细胞缺乏(56例次,84.8%)为主要表现,Hb水平也有不同程度的降低(<65 g/L,4例次,6.06%),但不是十分显著;继发于粒细胞缺乏的并发症:发热(63.6%)、感染(40例次,60.6%)等的发生率也较高,如上呼吸道感染(22.7%)、肺炎(12.1%)、肠道感染(12.1%)、脓毒症(27.2%)、口腔炎(13.6%)等,或未发现明确感染灶的发热,如粒细胞缺乏性发热或存在隐匿感染灶者;第3位的毒副作用是消化道反应:恶心、呕吐(100.0%),纳差以及腹部不适等。观察到的肝脏毒性(4.55%)、泌尿系统毒性[包括出血性膀胱炎(1例次,1.52%)]、肾损害(7例次,10.6%)以及心脏毒性的发生率并不高(3例次,4.55%),即使发生,其毒性反应也较轻,经对症治疗后均可在短期内恢复正常。皮肤毒性及神经系统毒性尚未观察到。
本组患儿化疗前WBC及化疗后WBC的最低值比较差异有统计学意义(P=0.000),即化疗后WBC明显低于化疗前。66例次CAV方案化疗时,有56例次化疗的WBC发生Ⅳ度毒性(WBC<1.0×109/L),其发生率约为84.8%,WBC的Ⅰ度毒性有2例次(3.03%),Ⅱ度毒性1例次(1.52%),Ⅲ度毒性6例次(9.09%)。CAV1和CAV2 2个疗程的超大剂量CTX为主的方案化疗时,WBC化疗前及化疗后最低值的数值分布曲线图见图1、图2。


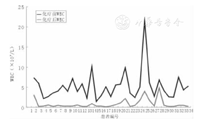

本组患儿化疗前血小板与化疗后血小板的最低值比较差异有统计学意义(t=8.602,P=0.000),即化疗后血小板明显低于化疗前。化疗后血小板发生Ⅰ度毒性10例次(15.2%),Ⅱ度毒性15例次(22.7%),Ⅲ度毒性9例次(13.6%),Ⅳ度毒性者(血小板<25×109/L)共有19例次(28.8%),但无一例患儿发生出血事件。CAV1和CAV2 2个疗程的超大剂量CTX为主的方案化疗时,血小板在化疗前及化疗后的数值分布曲线图见图3、图4。


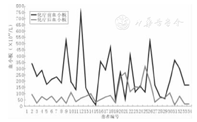

超大剂量的CTX为主的CAV方案化疗期间66例次均出现了消化道不适症状,发生率为100.0%,临床主要表现为不同程度恶心、呕吐、纳差等症状。根据《WHO抗癌药物毒性反应分级标准》恶心、呕吐Ⅰ度毒性29例次(43.9%),Ⅱ度毒性26例次(39.4%),Ⅲ度毒性10例次(15.2%),Ⅳ度毒性1例次(1.52%)。可见,消化道反应的发生率也较高,但大多数为轻-中毒,且经对症止吐治疗后均好转。
化疗前、后AST比较差异无统计学意义(P>0.05);化疗前、后ALT比较差异有统计学意义(P<0.05),即化疗后患儿的ALT较化疗前增高。化疗前、后血清TBil水平比较差异无统计学意义(P>0.05)。在CAV方案化疗后ALT异常者共3例,分别为90 IU/L、45 IU/L及43 IU/L(正常值为5~40 IU/L),比率为4.55%,本组患儿经超大剂量CTX为主的CAV方案化疗后并未出现严重的肝功能损害或肝衰竭。
CAV方案化疗后共3例次(4.55%)发生口腔黏膜白色念珠菌的感染。本组患儿化疗过程中出现口腔黏膜炎者共9例次,发生率为13.6%,为Ⅱ度毒性。这些患儿饮食上注意禁食坚硬及辛辣食物;治疗上予氯化钠漱口水漱口,3次/d;表皮生长因子喷口腔促进黏膜修复;在继发白色念珠菌感染时予氟康唑胶囊口服,制霉菌素溶解后涂口腔治疗。予上述治疗后患儿口腔黏膜5~7 d恢复正常。见表1。
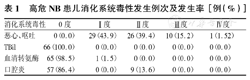
高危NB患儿消化系统毒性发生例次及发生率[例(%)]
高危NB患儿消化系统毒性发生例次及发生率[例(%)]
| 消化系统毒性 | 0度 | Ⅰ度 | Ⅱ度 | Ⅲ度 | Ⅳ度 |
|---|---|---|---|---|---|
| 恶心、呕吐 | 0(0.0) | 29(43.9) | 26(39.4) | 10(15.2) | 1(1.52) |
| TBil | 66(100.0) | 0(0.0) | 0(0.0) | 0(0.0) | 0(0.0) |
| 血清转氨酶 | 65(98.5) | 1(1.5) | 0(0.0) | 0(0.0) | 0(0.0) |
| 口腔炎 | 57(86.4) | 0(0.0) | 9(13.6) | 0(0.0) | 0(0.0) |
见表2。
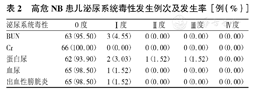
高危NB患儿泌尿系统毒性发生例次及发生率[例(%)]
高危NB患儿泌尿系统毒性发生例次及发生率[例(%)]
| 泌尿系统毒性 | 0度 | Ⅰ度 | Ⅱ度 | Ⅲ度 | Ⅳ度 |
|---|---|---|---|---|---|
| BUN | 63(95.50) | 3(4.55) | 0(0.00) | 0(0.00) | 0(0.00) |
| Cr | 66(100.00) | 0(0.00) | 0(0.00) | 0(0.00) | 0(0.00) |
| 蛋白尿 | 62(93.90) | 2(3.03) | 1(1.52) | 1(1.52) | 0(0.00) |
| 血尿 | 65(98.50) | 1(1.52) | 0(0.00) | 0(0.00) | 0(0.00) |
| 出血性膀胱炎 | 65(98.50) | 1(1.52) | 0(0.00) | 0(0.00) | 0(0.00) |
本组患儿肾功能指标BUN及Cr化疗前后比较差异无统计学意义(PBUN=0.188,PCr=0.888)。提示本组患儿应用超大剂量CTX为主的CAV方案化疗对于肾功能无显著影响,但有3例次BUN发生Ⅰ度毒性,2例次发生Ⅰ度蛋白尿,Ⅱ度、Ⅲ度蛋白尿各1例次。这些患儿在加强水化碱化、利尿及抗感染治疗后尿常规及尿素氮均较快恢复正常。
本组患儿仅1例次发生出血性膀胱炎,发生在第2疗程的CAV方案化疗的第8天。主要表现为尿痛、尿少及肉眼血尿。查体:下腹部膀胱区有轻压痛,肋脊点及肋腰点均无压痛,肾区无叩击痛。尿常规:黄色,云雾状,蛋白++,潜血+++,酮体微量,镜检红细胞6~8个/Hp。泌尿系统B超显示双肾、输尿管未见异常,膀胱壁厚0.4 cm。治疗上给予水化碱化尿液,巯乙磺酸钠解救,静脉滴注止血药,如酚磺乙胺,注射用白眉蛇毒血凝,治疗7 d后症状好转,复查尿常规大致正常。
超大剂量CTX为主的CAV方案化疗后,共9例次(13.6%)血培养为阳性,且临床合并发热、寒战症状,临床上诊断为脓毒症。同期对应的中性粒细胞绝对值均<0.5×109/L,存在粒细胞缺乏,其中6例次中性粒细胞绝对值为0。血培养结果分别为人葡萄球菌、溶血葡萄球菌、白色念珠菌、铜绿假单胞菌、大肠埃希菌、缓征链球菌、大肠埃希菌、沃氏葡萄球菌、球形芽孢杆菌。CAV方案化疗后共8例次(12.1%)化疗后大便常规阳性,提示肠道内感染,均有不同程度的腹痛、腹泻。但大便培养阳性者仅1例,结果为鼠伤寒沙门菌,药敏结果显示对环丙沙星及氯霉素敏感,对氨苄西林、复方磺胺及头孢曲松耐药。本例鼠伤寒沙门菌感染患儿主要表现为腹泻、黏液便,给予万古霉素、夫西地酸联合氟康唑抗感染治疗后好转。
CAV方案化疗后,发生上呼吸道感染共15例次(22.7%),主要表现为咳嗽、咽痛、声嘶、流涕等,查体主要表现为咽充血、双肺呼吸音粗等。本组患儿中共8例次(12.1%)合并肺部感染。其中1例肺炎合并胸腔积液(少量),因胸腔积液量少,故未行穿刺检验积液的性质及细菌培养等,经抗感染治疗后好转,炎症及胸腔积液均吸收。以上并发呼吸系统感染的患儿中,痰培养阳性者仅1例次,比率为1.52%,培养结果为不动杆菌占20%。脓毒症9例次,发生率为27.2%。
CTX是细胞周期非特异性氮芥类细胞毒性药物,CTX在氧化过程中可产生一系列有毒的亲电子物质,如丙烯醛等,导致重要功能酶活性改变,即造成氧化应激性肝损伤[4];CTX的氧化过程不仅使过氧化物和自由基生成增多,而且还可导致还原性物质的下降。研究显示大剂量CTX治疗可引起严重低钠血症,伴呕吐或尿量减少患儿更应注意[5]。
消化道反应也是CTX较常见的毒副反应之一。本组患儿化疗期间均发生程度不等的消化道反应。大多数表现为恶心、呕吐,少数患儿表现为纳差、腹部不适等,此组患儿消化道毒性多为Ⅰ~Ⅱ度。可见,超大剂量CTX为主的CAV方案对于消化道的刺激较强烈,对症止吐显得尤为重要。超大剂量CTX为主的化疗产生的肝脏毒性并不明显,本组仅1例次患儿的肝功能发生Ⅰ度毒性,经保护肝脏治疗后很快好转。无严重肝损害致肝功能衰竭的病例发生。
本组病例中共42例次出现了发热,这42例次在发热同时查CRP均>8 mg/L,提示机体处于感染应激状态。其中有的患儿临床可找到明确的感染灶,但有的却无明确感染灶,仅表现为一过性的发热,共有16例次发热患儿在临床上无明确感染灶,他们均给予第二代头孢类抗生素治疗后体温降至正常。考虑这16例次患儿中可能有隐匿性感染灶未被发现,或单纯的粒细胞减少性发热,或是原发疾病NB产生的儿茶酚胺类代谢产物导致机体代谢增强,亦或是存在某种因CTX本身产生的药物性发热机制,此问题仍待进一步研究明确。本组患儿化疗后继发感染者共40例次(60.6%),上呼吸道感染15例次,脓毒症9例次,肺炎8例次,肠炎8例次。脓毒症中3例为G+球菌,5例为G-杆菌,1例为白色念珠菌;肠炎患儿仅1例便培养为阳性——鼠伤寒沙门菌;肺炎患儿进行痰培养仅1例为阳性,为不动杆菌;上呼吸道感染患儿予对症治疗后均很快好转,未行病原学检查。
国内有报道称恶性血液病和实体瘤患者化疗期间较常见的感染的细菌种类为大肠埃希菌、葡萄球菌、肺炎克雷伯菌、铜绿假单胞菌[6]。陈力等[7]对104例儿童肿瘤强烈化疗并发脓毒症的病原菌及其对药物敏感性进行分析后发现,化疗后脓毒症病原菌以G-杆菌为主,最常见为肺炎克雷伯菌、大肠埃希菌及铜绿假单胞菌,前二者易引致感染性休克。G+球菌对万古霉素、替考拉宁敏感;G-杆菌以亚胺培南、美罗培南敏感率最高。本组中脓毒症患儿无一例发生感染性休克、DIC等危及生命的情况,这与及时升级抗生素,有效地支持抗感染治疗密不可分。
除上述毒副作用外,发生肾损害6例次,心脏损害3例次,出血性膀胱炎1例次。其中肾损害仅3例次表现为BUN轻度升高,其他为尿常规显示蛋白尿或血尿,而且为一过性,再次复查尿常规基本正常。心脏损害主要表现心动过速,左心室内径轻度增大,左心室射血分数轻度减低。心脏毒性主要是蒽环类化疗药物阿霉素导致的。可见本组使用超大剂量CTX致肝脏、肾脏及心脏等脏器损害并不严重[8,9]。本组超大剂量CTX化疗的患儿中发生出血性膀胱炎仅1例次。本例患儿虽给予充分的水化碱化、巯乙基磺酸钠解救,且患儿的肝肾功能均正常,但仍发生轻度出血性膀胱炎。考虑与患儿机体本身对CTX的毒性代谢产物的耐受程度不同,自身膀胱黏膜防御性较低,抑或是编码患儿肝脏代谢酶的基因突变导致毒性代谢产物增加等个体差异有关。
巯乙基磺酸钠联合水化、强迫利尿、碱化预防出血性膀胱炎是安全、有效的。巯乙基磺酸钠与水化、碱化、利尿联合预防后,出血性膀胱炎发生率下降到12.5%。巯乙基磺酸钠不良反应文献中报告均很低,国内及国外均有研究显示巯乙基磺酸钠有可能在很轻的程度上加重异环磷酰胺的消化道反应和神经毒性[10]。
充分的水化可以促进尿液最快排出丙烯醛,特别是超大剂量的CTX,在单位尿液中所含的毒性代谢产物必然较常规剂量时明显增加,且在酸性条件下CTX的代谢产物易于沉积于肾小管内[11],而产生肾毒性。而且在产生肾毒性的同时又会影响CTX的排泄,形成恶性循环。
Kragg等[12]对354例骨髓移植患者预防出血性膀胱炎的研究表明,给予巯乙基磺酸钠和利尿剂组发生肉眼血尿的比例是膀胱冲洗组的50%,而镜下血尿的发生率仅为膀胱冲洗组的1/3。在本组66例次超大剂量CTX为主的化疗中应用上述预防措施后,仅有1例次发生了出血性膀胱炎,临床防治效果显著。
骨髓抑制是观察到超大剂量CTX化疗的主要毒副作用,发生率高,持续时间长,并且易继发严重的感染。NCCN指南建议G-CSF的预防性使用应基于患者的危险评估,在权衡化疗相关的潜在的利弊后再决定治疗[13]。有高度危险(>20%)发展成发热性中性粒细胞减少(FN)或相关并发症时考虑接受治疗。G-CSF的预防性使用可减少或弥补因FN住院的费用。临床上应用G-CSF指征是在中性粒细胞绝对值<0.5×109/L时应用,考虑在高危组NB患儿的高强度化疗下可放宽指征,即预防性应用G-CSF。小剂量短疗程国产重组人粒细胞集落刺激因子(rhG-CSF)的早期应用可以缩短WBC、ANC下降的持续时间及减轻其下降程度,缩短化疗间歇,提高化疗效果[14]。
恩丹西酮是具有高选择性的5-羟色胺3(5-HT3)受体拮抗剂,此药可选择性地阻滞5-HT3与中枢神经系统的化学感受区和上消化道传入神经上的5-HT3受体结合,对化疗药物所引起的呕吐有突出疗效[15]。特别是对于强化疗药物引起的顽固性剧烈的消化道反应相比于甲氧氯普胺疗效更明显。
目前认为加大恩丹西酮的单次用量或多次用药并不能提高止吐效果[16]。本研究显示超大剂量CTX为主的CAV方案化疗引起的消化道反应较常见。在给予CTX之前预防性的应用恩丹思酮可防治严重的呕吐。单一应用恩丹西酮不能阻滞多种或全部神经受体,故近些年提出联合用药多种止吐药物,观察到效果较好,且无明显毒副作用。冯青和蔡正凤[17]研究显示昂丹司琼与地塞米松可显著提高对化疗患者的止吐作用,且不良反应轻微,可作为联合化疗,尤其是含铂类大剂量化疗对预防和控制恶心、呕吐的首选治疗。超大剂量CTX造成的黏膜损害也较显著,口腔及肛周的黏膜容易受累,发生红肿、溃疡甚至感染,此会严重影响患儿对化疗的耐受性,且影响患儿的营养状况。临床在CAV方案化疗期间给予氯化钠漱口及硼酸水坐浴,3次/d预防性的保持口腔及肛周黏膜的清洁,可有效减少黏膜炎的发生。
本组超大剂量CTX化疗中发生的肝脏损害及心脏损害并不明显,少数患儿发生的损害仅为轻度的,短期内可恢复正常,对患儿远期的脏器功能并无影响。考虑与本组患儿化疗前及化疗时给予保护心肌及肝脏的药物,如磷酸肌酸钠、VitC、还原型谷胱甘肽等有关。
继发感染是超大剂量CTX化疗的又一主要不良反应,所以在应用超大剂量CTX化疗时应定期检测血常规、CRP及体温。尽量在感染早期控制,若感染进一步进展,应尽可能早给予抗生素。并根据病情及时升级抗生素,必要时联合多种抗生素,如万古霉素、亚胺培南等。特别是在发生肺炎、肠炎、脓毒症时,更应尽早完善病原学检查,根据药敏结果调整抗生素。提倡短疗程应用抗生素,但若病情需要,对于长期应用广谱抗生素的患儿须预防性地给予抗真菌药物,如氟康唑、伏立康唑等。当患儿出现高热持续3 d好转时,在一般抗感染无效的情况下,需适当加用抗真菌药物防治真菌感染。化疗后粒细胞少,IgG下降是继发感染的重要原因,给予丙种球蛋白可以使其抗感染总有效率显著提高,控制感染所需时间缩短[18]。
综上,临床上应用超大剂量CTX为主的CAV方案化疗治疗儿童高危组NB虽有一定毒副反应,但是在完善的支持治疗及严密的监测条件下是可以安全使用的。






























