
探讨与研究抗胸腺细胞球蛋白(ATG)在儿童再生障碍性贫血(再障)治疗中的药代动力学。
6例获得性再障患儿采用简单随机法选择应用R-ATG(美国Genzyme公司)和R-ATG(德国Fresenius公司)各3例,疗程均5 d。在R-ATG治疗第1天:0 h、4 h、8 h;第2-5天于ATG输注结束时,以及治疗后d7,d21,d35,d60,d90各采静脉血标本1次(共12个时间节点)。采用ELISA法检测ATG血药浓度,绘制血药质量浓度变化曲线;采用药代动力学计算程序(3P97)计算ATG各项药代动力学参数。
于ATG治疗第3-4天,血药质量浓度达到峰值(30~32 mg/L),此后逐渐缓慢下降,第21天降至1/2峰值水平(16~18 mg/L),至第90天时血中仍可检测到微量ATG。R-ATG(Genzyme)和R-ATG(Fresenius)2种剂型在各时间点血药质量浓度、峰质量浓度、分布与清除半衰期、血药质量浓度-时间曲线下面积等主要药代动力学参数均未见统计学差异。6例患儿平均随访时间12个月,总有效率为66.7%,无治疗相关死亡及严重不良反应。
成功建立ATG治疗儿童再障时药代动力学检测方法,为今后深入开展ATG药代动力学与不良反应防治、远期疗效等相关研究创造条件。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自从抗胸腺细胞球蛋白(ATG)成功应用于治疗再生障碍性贫血(再障)之后,为无法进行异基因造血干细胞移植(allo-HSCT)的重型再障(SAA)患者提供了有效的药物治疗方法,并显著提高了SAA的远期疗效、长期生存率与生活质量[1,2,3]。虽然ATG治疗再障已有近40年的历史,但目前国内外尚未见有关ATG治疗再障的药代动力学报道。如能通过深入研究以探索ATG治疗再障时的血药质量浓度及其变化规律,以及药代动力学主要参数,对于进一步阐明ATG药理作用机制、临床疗效预测、不良反应防治、及指导药物选择等方面均具有重要意义。为此,本研究经反复探讨之后,成功建立了ATG血药质量浓度与药代动力学检测方法,绘制了ATG血药质量浓度曲线和获得各项药代动力学数据研究结果。
儿童获得性再障初诊病例,符合中华医学会儿童再障诊断与分型标准[4],并符合ATG治疗指征者。
(1)先天性再障;(2)以往曾经接受过ATG治疗,或对ATG过敏者;(3)存在明显肝功能、肾功能、心肺功能异常,或严重感染者。
2011年11月至2012年5月在同济大学附属同济医院接受以ATG为主的联合免疫抑制治疗(combined immunosuppressive therapy,CIS)的儿童获得性再障共6例,并通过全面临床检查与丝裂霉素-染色体断裂实验,除外先天性再障[5]。男3例,女3例;年龄3~12岁,中位年龄6岁。其中极重型再障(vSAA)1例,重型再障Ⅰ型(SAA-Ⅰ)1例,重型再障Ⅱ型(SAA-Ⅱ)3例,依赖输血的非重型再障(NSAA)1例。
按治疗入组时间先后顺序,交替选择应用,兔抗人胸腺细胞球蛋白(R-ATG,美国Genzyme公司)和兔抗人T淋巴细胞球蛋白(德国Fresenius公司)各3例(见表1)。每日ATG剂量分别为:R-ATG(Genzyme)3.5 mg/kg,R-ATG(Fresenius)5 mg/kg,疗程连续5 d。首剂之前完成静脉过敏试验,阴性者开始治疗。单日剂量ATG以9 g/L盐水500 mL稀释后,缓慢匀速静脉滴注8 h。同时给予足量糖皮质激素,预防变态反应治疗前准备、静脉过敏试验步骤、治疗期间和治疗后不良反应防治等具体措施,参照文献[4,5,6]。
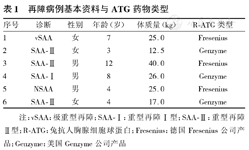
再障病例基本资料与ATG药物类型
再障病例基本资料与ATG药物类型
| 序号 | 诊断 | 性别 | 年龄(岁) | 体质量(kg) | R-ATG类型 |
|---|---|---|---|---|---|
| 1 | vSAA | 女 | 7 | 25.0 | Fresenius |
| 2 | SAA-Ⅱ | 女 | 3 | 12.5 | Genzyme |
| 3 | SAA-Ⅱ | 男 | 12 | 40.0 | Fresenius |
| 4 | SAA-Ⅰ | 男 | 8 | 26.0 | Genzyme |
| 5 | NSAA | 男 | 4 | 25.0 | Fresenius |
| 6 | SAA-Ⅱ | 女 | 4 | 17.0 | Genzyme |
注:vSAA:极重型再障;SAA-Ⅰ:重型再障Ⅰ型;SAA-Ⅱ:重型再障Ⅱ型;R-ATG:兔抗人胸腺细胞球蛋白;Fresenius:德国Fresenius公司产品;Genzyme:美国Genzyme公司产品
环孢素(CSA)口服[5~6 mg/(kg·d)]作为CIS的组成,同时口服常规剂量雄性激素和复方皂矾丸等,积极防治感染和酌情成分输血。
参照中华医学会儿科学分会血液学组制定的儿童再障疗效标准[4],根据外周血常规恢复程度、依赖输血与否等指标,将具体疗效分为基本治愈、缓解、明显进步和无效。将基本治愈、缓解和明显进步计入总有效率。
于ATG治疗前、治疗期间与治疗后90 d内,选取共12个时间节点,采集静脉血标本。具体采集时间为,治疗第1天:0 h、4 h、8 h;第2-5天均于ATG输注结束时采静脉1次,之后于第7、21、35、60、90天各采血1次。每次采血量均为2 mL,第1-5天期间标本采集均为ATG输注之对侧肢体静脉血。
静脉血标本于室温(20~25 ℃)下静置30 min,并于2 h内分离血清(24 ℃,1000 r/min离心10 min),取血清分装后放入-80 ℃冰箱保存待测。
采用ATG检测标准试剂盒(上海越研生物有限公司)。具体实验步骤如下:(1)包被:鼠抗兔IgG单克隆抗体1︰2000稀释,100 μL/孔包被96孔板,4 ℃冰箱孵育过夜。次日PBS洗板3次,5 min/次;洁净吸水纸拍干后加封闭液,200 μL/每孔,4 ℃过夜,洗涤3次,5 min/次。(2)加样:ATG标准品用含1 g/L小牛血清蛋白干粉(BSA)的PBS稀释一定浓度(0.75、1.50、3.00、6.00、9.00 mg/L),待测血清用含1 mL/L BSA的PBS 1︰20稀释。将ATG标准品及待测血清加于包被孔中,100 μL/孔,并设阴性对照(正常血清)和空白对照,封板胶封口,37 ℃孵育2 h,PBS洗涤3次,5 min/次。(3)二抗:将辣根过氧化物酶(HRP)标记的羊抗兔IgG多克隆抗体用含1 mL/L BSA的PBS 1︰2500稀释,100 μL/孔,封板胶封口,37 ℃孵育1 h,PBS洗涤5次,5 min/次。(4)显色:加入TMB显色剂,100 μL/孔,室温(20~25 ℃)显色30 min,再加入终止液100 μL/孔,避光5 min终止反应。(5)检测:酶标仪测定在450 nm波长下吸光度A值。(6)ATG浓度计算:以标准品ATG浓度为自变量,用所对应标准品A值减去空白对照A值为应变量,应用SPSS 17.0软件得回归方程,以回归方程计算待测血清ATG浓度。如测定A值超过线性检测范围,则将待测血清以稀释依次倍比稀释后重新测定,直至其测定结果落于线性检测范围内。
所得血药浓度数据录入计算机,采用药代动力学程序practical pharmacokineticsprogram(3P97)计算ATG各项药代动力学参数。
采用Excel 2007和SPSS 17.0统计软件进行数据分析。计量数据用 ±s表示,各组数据间比较采用非参数检验(Mann-Whitney和Kolmogo-rov-Smirnov检验),P<0.05为差异有统计学意义。
±s表示,各组数据间比较采用非参数检验(Mann-Whitney和Kolmogo-rov-Smirnov检验),P<0.05为差异有统计学意义。
以标准品ATG质量浓度为自变量,以所对应标准品A值减去空白对照A值为应变量,采用SPSS 17.0软件得回归方程,以标准品最大稀释度作为检测的灵敏度。本法检出的最小ATG质量浓度为0.53 mg/L。回归方程:自变量(y)=-0.398 311 0+ 4.885 033 1应变量(x);相关系数(R)=0.999 220 3。
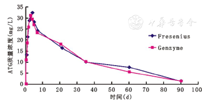
各时间点ATG血药质量浓度检测显示,第1天血药质量浓度快速上升,于输注结束(8 h)时达当日最高值,并于第3-4天时达到峰值(略超过30 mg/L),于第5天开始逐渐下降,3周(第21天)后降至峰质量浓度半数值(16~18 mg/L),5周(第35天)后降至峰质量浓度的1/3(10 mg/L左右),直至第90天时血中仍可测到微量ATG。血药质量浓度曲线显示特征为,ATG治疗期间血药质量浓度可迅速达到峰值,但无明显平台期;治疗后药物消除缓慢,可在体内长期存在。各时间点检测各项数据显示,R-ATG(Fresenius)与R-ATG(Genzyme),均未见统计学差异,见图1,表2。
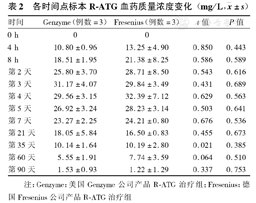
各时间点标本R-ATG血药质量浓度变化(mg/L, ±s)
±s)
各时间点标本R-ATG血药质量浓度变化(mg/L, ±s)
±s)
| 时间 | Genzyme(例数=3) | Fresenius(例数=3) | t值 | P值 |
|---|---|---|---|---|
| 0 h | 0 | 0 | ||
| 4 h | 10.80±0.96 | 13.25±4.90 | 0.850 | 0.443 |
| 8 h | 18.51±1.95 | 21.38±8.25 | 0.586 | 0.589 |
| 第2天 | 25.80±3.70 | 28.71±8.50 | 0.543 | 0.616 |
| 第3天 | 31.17±4.07 | 29.84±3.49 | 0.431 | 0.689 |
| 第4天 | 29.56±3.15 | 32.39±7.12 | 0.629 | 0.563 |
| 第5天 | 26.92±3.24 | 28.23±3.14 | 0.503 | 0.641 |
| 第7天 | 23.27±2.25 | 24.21±0.80 | 0.676 | 0.536 |
| 第21天 | 18.05±5.84 | 16.50±0.83 | 0.455 | 0.673 |
| 第35天 | 10.14±1.64 | 10.19±2.80 | 0.021 | 0.385 |
| 第60天 | 5.55±1.91 | 7.74±3.59 | 0.064 | 0.510 |
| 第90天 | 1.53±0.93 | 1.22±1.29 | 0.337 | 0.753 |
注:Genzyme:美国Genzyme公司产品R-ATG治疗组;Fresenius:德国Fresenius公司产品R-ATG治疗组

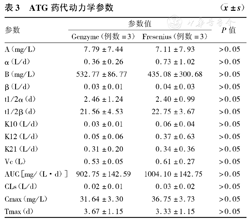
根据血药质量浓度数据,采用3P97计算方程进行拟合,确定权重和房室模型,计算获得ATG药代动力学的二室模型主要参数,包括分布半寿期(t1/2α)、消除半寿期(t1/2β) 、血药质量浓度-时间曲线下面积(AUC)、分布容积(Vc)和清除率(CLs)等,以及参数计算相关数据,包括清除速率常数(K10)、转运速率常数(K12、K21)、分布相和消除相浓度速率常数(A、B和α、β)等。峰浓度(Cmax)和达峰时间(Tmax)等采用实测值。结果数据显示,R-ATG(Genzyme)与R-ATG(Fresenius)的主要药代动力学参数统计比较,包括药物质量浓度与分布相关数据(t1/2α、Cmax、Tmax、Vc等),以及药物清除相关数据(t1/2β、CLs、K10)等均无统计学差异,具体结果见表3。
ATG药代动力学参数( ±s)
±s)
ATG药代动力学参数( ±s)
±s)
| 参数 | 参数值 | P值 | |
|---|---|---|---|
| Genzyme(例数=3) | Fresenius(例数=3) | ||
| A(mg/L) | 7.79±7.44 | 7.11±7.93 | >0.05 |
| α(L/d) | 0.36±0.26 | 0.73±1.02 | >0.05 |
| B(mg/L) | 532.77±86.77 | 435.08±300.68 | >0.05 |
| β(L/d) | 0.03±0.01 | 0.04±0.03 | >0.05 |
| t1/2α(d) | 2.46±1.24 | 2.40±0.99 | >0.05 |
| t1/2β(d) | 21.56±4.53 | 22.75±3.67 | >0.05 |
| K10(L/d) | 0.03±0.01 | 0.06±0.04 | >0.05 |
| K12(L/d) | 0.05±0.06 | 0.37±0.63 | >0.05 |
| K21(L/d) | 0.31±0.20 | 0.34±0.36 | >0.05 |
| Vc(L) | 0.53±0.05 | 0.61±0.27 | >0.05 |
| AUC[mg/(L·d)] | 902.75±142.59 | 1004.10±142.75 | >0.05 |
| CLs(L/d) | 0.02±0.01 | 0.03±0.02 | >0.05 |
| Cmax(mg/L) | 31.64±3.30 | 36.75±3.73 | >0.05 |
| Tmax(d) | 3.67±1.15 | 3.33±1.15 | >0.05 |
本组6例在接受以ATG为主的CIS治疗后,随访10~16个月(平均12个月),参照前述儿童再障疗效标准,共2例缓解,2例明显进步,2例无效,总有效率66.7%(4/6例)。在分别应用R-ATG(Genzyme)和R-ATG(Fresenius)的各3例患儿中,获得缓解和明显进步,以及无效者,均各为1例。
本组2例患儿在ATG治疗的1、2 d时出现发热、畏寒等类过敏反应,予暂停输注ATG,应用抗过敏治疗后缓解,症状消失后继续治疗。ATG治疗第10-14天,5例患儿出现血清病,表现为发热、皮疹或关节痛,经足量糖皮质激素等处理,均于1~3 d缓解。其中1例患儿于ATG治疗后1个月,发生肺部念珠菌感染,经抗念珠菌治疗后及时控制。其余5例患儿均无严重感染和出血并发症,均未发生严重脏器功能损害和治疗相关死亡。
ATG为选择性免疫抑制剂,是通过提取人类胸腺细胞或T淋巴细胞免疫动物(如兔、马、猪等),使其体内产生针对人T淋巴细胞的特异性抗体,经纯化后所制备的生物制品。目前,有关再障因T淋巴细胞功能异常,导致骨髓造血细胞免疫损伤的"免疫介导"致病机制,已成为国际共识[7,8,9]。ATG可通过抗体介导的细胞毒作用,清除再障患者体内异常T淋巴细胞,逆转再障的免疫介导发病机制,且经过近40年的临床实践验证,ATG治疗再障的显著疗效已被普遍确认[5,6,7,8,9,10,11]。因此,目前以ATG联合SA的CIS疗法已被推荐为无法接受allo-HSCT治疗的SAA或依赖输血的NSAA的首选药物疗法[5,12]。虽然ATG目前已被广泛应用于临床,但尚未见有关ATG治疗再障的药代动力学研究报道。
由于ATG为异种动物蛋白,可促发人体过敏和血清病等不良反应,也由于ATG的免疫抑制作用,存在导致继发感染之风险。此外,关于ATG的疗效影响因素相关研究虽已开展多年,但目前有关ATG的疗效预测指标仍远未明确。因此,ATG治疗再障就患者个体而言,是否获得理想疗效仍存在明显的不确定性。而且,即使起效以后,患者的造血功能重建和疗效程度,也存在个体差异。而药代动力学研究,将有助于深入了解药物在体内的代谢过程及其个体差异,为进一步阐明药物作用机制、疗效预测和病例选择、不良反应防治,以及探索更为合理的个体化治疗,以进一步提高疗效等创造条件。
本组对目前国内使用的R-ATG(Fresenius)和R-ATG(Genzyme)2种主要剂型同时进行对比研究,采用双抗体夹心ELISA法测定血清ATG质量浓度,以ATG作为抗原,鼠抗兔IgG单抗作为一抗,HRP标记的羊抗兔作为二抗,具有良好的检测特异性。实验过程中经重复性试验,也显示批内与批间变异系数小,检测结果数据精确。
本结果显示ATG治疗后,体内ATG血药质量浓度迅速升高,并于疗程第3-4天达到峰值。但清除时间较为缓慢,治疗第21天血药质量浓度降至峰值的50%左右,与药代动力学检测显示清除半衰期(t1/2β)为21~22 d相吻合,也符合人体内免疫球蛋白半寿期为16~24 d的规律。此后,ATG血药质量浓度呈缓慢降低,说明ATG可在体内存在并作用较长时间。
由于研究周期较短,例数有限,因此仅为初步结果,尚不能得出药代动力学与不良反应和疗效的相关性。本研究的主要意义在于成功建立了ATG血药质量浓度和药代动力学检测方法,为今后在更多样本资料积累的基础上,继续开展深入研究创造有利条件。



























