
百日咳是一种主要由百日咳杆菌感染引起的一种急性呼吸道传染性疾病。自1974年全球实施扩大免疫计划以来,世界范围内的百日咳得到有效控制,发病率和病死率大幅下降。百日咳主要发生于发展中国家的未免疫儿童,是导致年长儿及成人长期咳嗽的常见病因。由于年长儿及成人患百日咳时症状不典型性,使百日咳发病率上升,甚至发生局部暴发,从而对公共健康产生了巨大冲击。对百日咳患者进行快速正确的诊断及预防具有重要的意义。现就百日咳的病原学、流行病学、发病机制、治疗、预防等方面的进展进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
百日咳是一种主要由百日咳杆菌引起的急性呼吸系统传染性疾病。人类第1次认识百日咳时命名为"the kink"(和发作、痉挛是同义词的苏格兰术语)和"the kindhoest"(意思为儿童咳嗽的一种象声词)。据报道,每年全球有2000万~4000万例百日咳病例,且约有超过355 000例患者死亡。患者及病情严重者多为发展中国家的未免疫儿童。自1974年全球实施扩大免疫规划(EPI)以来,全球超过80%的婴儿接种了3针剂的白喉-百日咳-破伤风联合疫苗(diphtheria,tetanus and pertussis combined vaccine,DTP),这使得一段时期内百日咳在世界范围内得到了极其有效的控制,发病率和病死率大幅度下降。有资料报道DTP的实施已成功预防了600万例潜在患儿的死亡。然而,至20世纪70年代后期,由于百日咳的安全性问题减少,使得专业人员和公众对百日咳的重视程度下降,甚至有少数西方国家不再将百日咳疫苗列入国家免疫规划。也由于免疫接种后的年长儿及成人患百日咳时症状不典型,出现了百日咳在疫苗覆盖率高的国家发病率上升,甚至发生局部暴发。至此百日咳再次因其对公共健康的巨大冲击而引起诸多学者对百日咳的关注[1,2,3,4]。
近年来,WHO的疾病监测发现,长期接种疫苗后带来的百日咳发病率大幅下降趋势出现了逆转,突出表现为发达国家出现发病率的复升和发展中国家屡屡发生百日咳的暴发[2]。发展中国家百日咳暴发报道见于多个国家。1997年10月,巴西阿克里发生百日咳暴发,临床诊断98例,发病儿童中47%百日咳疫苗接种史不详,仅有2%完成全程免疫,4%为未全程免疫。1997年11月,危地马拉Ilom地区发生百日咳暴发,报告324例,死亡17例,病死率为5.2%。以上暴发均与百日咳疫苗免疫覆盖率低有关。我国的情况也不容乐观,贵州省1997年曾出现百日咳局部暴发,报告675例。据分析,局部暴发原因是由于百日咳疫苗接种率低、超生漏种及易感人群累积所致[5]。美国自1980年起,百日咳发病率呈周期性上升,每3~4年出现1次高峰。其中1993年报告6568例,2004年达25 827例,上升近4倍;1996年,爱达荷州、马萨诸塞州、佛蒙特州均出现了百日咳暴发,1996年报告7796例,是自1967年以来报告最多的病例。2000年澳大利亚报告百日咳为6000例,2005年增至9000例。在疫苗免疫覆盖率较高的地区,青少年和成人的发病率升高尤其明显。该人群的抗百日咳毒素(PT)和丝状血凝素(FHA)抗体维持在较高水平,提示这一人群的自然感染率较高。在美国,青少年和成人的百日咳占总病例数>50%,1994年至1996年10~19岁病例较1990年至1993年增加了1.05倍。在加拿大和澳大利亚,青少年和成人也已成为百日咳的高发人群[6,7]。
近年全球百日咳发病率出现了明显上升趋势,尤其在DTP覆盖率较高的发达国家,如澳大利亚、法国、英国、美国等。这些国家屡次出现百日咳局部暴发或流行,目前有学者将此种百日咳发病率再次出现明显上升或多个地区屡次出现百日咳局部暴发或流行的现象称为百日咳再现。同时也因百日咳对公共卫生所造成的严重冲击,关于百日咳再现的原因和应对策略日益引起各国相关领导人及学者的关注。近几年内,发达国家纷纷对传统的百日咳疫苗免疫策略进行了调整。对百日咳及其疫苗进行深入探讨对百日咳的防治具有极其重要的意义。
百日咳是由革兰阴性鲍特菌属的多性型杆菌引起,百日咳杆菌是最主要的病原菌,副百日咳杆菌也可引起典型的百日咳,而作为动物病原的支气管败血性鲍特杆菌也可引起极为罕见的人类慢性咳嗽的病例。也有报道,沙眼衣原体、腺病毒也可引起百日咳样疾病。日本的Hagiwara等[8]报道1994年6月至7月在农村的一所高中学生中发生了由肺炎衣原体引起的百日咳样疾病流行。
鲍特菌属杆菌能够产生许多毒性因子,包括:(1)黏附分子:FHA、PT及其他外膜蛋白,如:菌毛(FIM)、黏着素(PRN,相对分子质量为69 000的蛋白质)及支气管克隆因子等;(2)毒素:气管细胞毒素(TCT)、腺苷酸环化酶毒素(ACT)及PT。PT仅由百日咳杆菌产生,副百日咳杆菌和支气管败血性鲍特杆菌含有PT基因但不能表达。黏附分子作用于呼吸系统的纤毛细胞上,使细菌黏附于细胞表面,此外,有些黏附分子还可促使细菌与免疫效应细胞的黏着。毒素既可引起局部反应也可导致全身反应。
当百日咳杆菌通过飞沫进入宿主体内,即产生适当的黏附分子,使菌体黏附于呼吸道黏膜的纤毛细胞上,此时如机体未产生相应的免疫反应或免疫反应不强则细菌即可大量增殖,并向下呼吸道蔓延,黏附于下呼吸道黏膜的纤毛细胞上。同时,细菌可产生大量毒素并向局部和全身释放,引起纤毛停滞,导致呼吸道上皮细胞损伤。这些改变在临床上表现为"上呼吸道感染"及轻微咳嗽的卡他期,中后期随着病变的加重及毒素的增多,患者临床上表现出百日咳的特征性咳嗽。若百日咳杆菌持续增殖,并向下蔓延至肺泡,将会导致百日咳肺炎。
百日咳是一种流行周期为2~5年的地方性疾病,人类是百日咳杆菌的唯一宿主,细菌主要通过空气传播,通常是由直接吸入来自感染患者呼吸道的大量飞沫而引发感染。有学者报道,当家庭内有1例患者时,90%~100%的其他成员也会发展为百日咳。另外,通过接触新近污染的物体也可引起间接感染。极少数无症状携带者也可分离到百日咳杆菌,因他们无典型的百日咳症状,常被患者及其家属以及医务人员所忽略而成为主要的传染源[1]。目前,尚无有关百日咳慢性携带者的报道。有研究表明百日咳发病无季节性,而有学者则认为百日咳常见于春夏季。患病人群中,女童多于男童,发病的年龄随计划免疫状态而不同,根据WHO的数据,全世界3剂DTP的覆盖率达78%,2000年全球报道百日咳发病186 151例,而2004年全球报道百日咳发病则上升至236 844例,且在报告的病例中出现了青少年、成人发病率增高的现象。
我国自1951年实行疾病报告制度以来,对百日咳的流行病学研究从未停止[9,10,11,12]。在1978年我国实行计划免疫前,百日咳的年发病率为100/10万~200/10万,且每3~5年出现1次较大范围的流行。实行计划免疫后,百日咳的发病率大幅下降,近几年一般在1/10万以下。从20世纪90年代以来,国内百日咳发病率长期稳定在一个相当低的水平。但在2001年和2002年,一些地区百日咳发病率出现了明显反弹。佳木斯市1999年百日咳发病率为0.04/10万,2000年为0,2001年为0.12/10万,2002年为0.13/10万;河南省2000年百日咳发病率为0.25/10万,2001年为0.46/10万,2002年为0.84/10万。
总之,无论是否接种疫苗,百日咳流行在许多国家都发生,如澳大利亚、加拿大、挪威和美国等,特别是1996年荷兰发生了非常严重的百日咳大流行,其发病率是以往流行年的5倍。虽然,疫苗接种改变了百日咳流行的许多方面,但未改变流行周期的间隔,这表明疫苗可以控制百日咳疾病,但不能控制人群中百日咳杆菌的周期。我国在计划免疫前,百日咳一般每隔3~4年流行1次,但实行计划免疫后,百日咳流行周期不明显。基于百日咳的流行特点,更好地控制百日咳感染,应该加强年幼儿的免疫预防及年长儿和成人的免疫加强预防。
典型百日咳的潜伏期为6~20 d,大多数病例在接触后7~10 d发病,病程可分为3个阶段:卡他期、痉咳期和恢复期,持续4~8周,偶尔更长。初期如上呼吸道感染,有流涕、打喷嚏和轻咳,随后咳嗽逐渐加重。1~2周之后发展至痉咳期,以痉挛性咳嗽为主,咳后有呕吐和吸气性吼声。痉咳每天平均发生15次,夜间发作更明显。在痉咳期的最初1~2周痉咳频次不断增加,并保持同等的频率2~3周后才逐渐减弱。典型百日咳患者常无发热及全身症状和体征。非典型百日咳一般发生于已免疫的儿童和感染的成人[1]。成人感染百日咳杆菌的临床表现与儿童接种后感染百日咳杆菌不同,成人的主要表现为阵发性持续性咳嗽,应用传统治疗无效,很少能够正确诊断,易误诊为支气管炎,在儿童期未行典型百日咳免疫的成人可能发生典型百日咳。Bortolussi等[13]将非免疫的和不完全免疫的百日咳患者进行比较,结果表明后者具有较轻的症状和较短的病程。
百日咳感染的实验室检查方法主要包括细菌培养、免疫学检查和分子生物学检测[14]。病原学诊断是指在患儿卡他期和痉咳初期获得的鼻咽部样本中找到百日咳杆菌。这是百日咳诊断的金标准,但普遍认为这种培养的敏感性较低。如在疾病的早期采集标本,实现快速运转,并且实验室技术良好,其分离率可达80%以上,但如果患儿已经应用了抗生素,进行过免疫或采集标本时间过晚(咳嗽持续2周以上),则分离率常常较低。因此,经典的细菌培养法虽然具有较好的特异性,但其敏感性常常受到取标本前一系列因素的影响,且培养一般需要3~7 d才能出结果,所以也不利于疑似患者的快速诊断和治疗,不利于临床早期诊断。
百日咳杆菌感染还可用免疫学检测进行诊断,可分为抗体检查和抗原检查。抗体检查主要采用凝集试验、ELISA等方法。凝集试验可分为全量法、半量法和微量法,其中微量法更具优越性。抗原检查有定量凝集反应和双抗体夹心酶联免疫吸附(ELISA)法,多用于百日咳疫苗的生产过程,如应用ELISA法测定PT、FHA、PRN和FIM等IgA和IgG抗体,可对患者急性期和恢复期血清进行比较。分子生物学检测近年来得到了迅速发展,如PCR可鉴定鼻咽部标本中的百日咳杆菌,是较灵敏和快速的诊断方法。PCR敏感性可达90%以上,特异性也在95%以上。但国内该方面起步较晚,且做得很少。
由于计划免疫工作的有效开展,我国目前百日咳病例已经大幅下降,但在一些地区仍有暴发流行,因此进行高质量的疾病监测显得尤为重要。WHO与美国疾病预防控制中心(CDC)分别制定了百日咳诊断标准,现将我国目前执行的百日咳诊断标准阐述如下。
本诊断标准为卫生部1995年制定的国家标准[GB15998-1995] 《百日咳诊断标准和处理原则》,对于百日咳的诊断规定如下。(1)流行病学史:3周内接触过百日咳患者,或该地区有百日咳流行。(2)临床表现:流行季节有阵发性痉挛性咳嗽者;咳嗽后伴有呕吐,严重者有结膜下出血或舌系带溃疡者;新生儿或婴幼儿有原因不明的阵发性发绀或窒息者,多无典型痉咳;持续咳嗽2周以上,能排除其他原因者。(3)实验室诊断:白细胞总数显著升高,淋巴细胞占50%以上;从患者的痰或咽喉部分泌物分离到百日咳杆菌;恢复期血清凝集抗体较急性期抗体呈4倍以上升高。(4)病例分类:疑似病例:具备(2)4项中任何1项,或同时伴有(1)项者;临床诊断病例:疑似病例加(3)中的白细胞总数显著升高,淋巴细胞占50%以上者;确诊病例:疑似病例加(3)中的从患者的痰或咽喉部分泌物分离到百日咳杆菌;恢复期血清凝集抗体较急性期抗体呈4倍以上升高。
百日咳需与呼吸系统疾病,如支气管炎、肺炎、支气管异物、支气管哮喘等疾病进行鉴别。
百日咳杆菌对许多抗生素敏感,但治疗效果与应用抗生素的早晚有关,在疾病卡他期的早期开始采用抗生素治疗效果最好。红霉素的敏感性和效果最好。
由于PT在百日咳的发病中具有重要作用,Bruss和Siber[15]对静脉滴注抗百日咳免疫球蛋白(P-IVIG)进行了Ⅰ期实验,实验表明P-IGIV安全且可以提高婴儿的PT抗体滴度,对严重病例具有较好的疗效。
多年来,皮质激素被推荐用于治疗百日咳,认为可缓解病情,缩短病程,但也由于皮质激素不良反应大且危险,故仅限于6~9月龄以下的严重病例。
尽管疫苗诱导的免疫对百日咳发病率的降低起重要作用,但对于无免疫力而又与百日咳患者接触的易感人群,特别是未进行计划免疫的小婴儿,有必要进行药物预防。首选大环内酯类药物,代表药物为红霉素。对于百日咳应用红霉素进行预防评价不一,在流行病学的研究中,尽管有文献报道红霉素预防失败,但大多数学者对其保护作用持肯定态度,有研究认为应用红霉素进行预防的最佳时机为痉咳发作前21 d(最好14 d),特别是在接触感染患者发病前。推荐的红霉素用量为40~50 mg/(kg·d),成人250~500 mg,分3次给药,持续10~14 d。
接种百日咳疫苗是预防和控制百日咳流行的最有效手段,对其免疫接种在降低百日咳的发病率和病死率,阻止百日咳的流行中所起的重要作用已成为国内外学者的共识。国外于19世纪20年代初期至今,灭活的全细胞菌苗已成为儿童计划免疫的一部分,随后,百日咳与白喉、破伤风类毒素混合的DTP对百日咳具有较好的预防作用。我国在20世纪50年代研制出了全细胞百日咳疫苗,这从很大程度上控制了百日咳的流行,大大降低了病死率。但由于全细胞疫苗接种时不良反应大,导致接种覆盖率下降及近年来发病率上升。为了减轻全细胞百日咳疫苗的不良反应,国外从20世纪70年代,以日本为代表的一些国家先后成功研制了无细胞百日咳疫苗,我国从20世纪80年代开始研制无细胞百日咳疫苗。20世纪90年代,武汉、成都、兰州的生物制品研究所均自主研发出了含有PT和FHA的无细胞百日咳疫苗,并取得了正式生产批准文号。临床研究证实,无细胞百日咳疫苗不良反应少,且具有良好的免疫原性。但因为该疫苗对纯化工艺和设备要求高,纯化抗原效率低,成本高,不利于疫苗的大规模生产。所以,目前只应用于少数发达国家。我国基本是2类疫苗同时应用,约85%的地区仍然使用的是全细胞疫苗。随着生物技术的迅猛发展,人们对百日咳杆菌的基因组结构及各种毒力因子、抗原成分结构和功能有了更深入的了解,近年来有研究者利用基因重组技术研制出基因工程百日咳疫苗,这种疫苗虽然进入临床试验阶段,但仍处于研究阶段,我国也在进行这方面的研究。
目前已用于预防接种的百日咳疫苗有3种:全细胞疫苗、无细胞疫苗与基因工程疫苗。
全细胞百日咳疫苗于1914年首次研制成功,经临床证实该疫苗具有免疫保护作用。全细胞百日咳疫苗是将细菌大量培养增菌后采用适宜的方法杀菌,使其灭活成无传染性但具有良好免疫原性的百日咳全菌体,加入佐剂后作为疫苗使用。其是直接从细菌中提起各种抗原成分,按不同的种类和剂量组合而成。这些抗原成分主要包括PT、FHA、百日咳杆菌黏着素、凝集原等。由于使用百日咳全菌体作为疫苗的主要成分进行免疫,全细胞百日咳疫苗接种后的不良反应发生率很高,常见不良反应包括注射部位红晕、肿胀和疼痛等局部反应(约占接种者的50%)和发热、烦躁、嗜睡等全身反应。有研究认为,引发这些不良反应的主要毒力因子为脂多糖。另外,有学者报道儿童接种百日咳疫苗后引起癫 发作,大多数癫
发作,大多数癫 发作是由发热引起,患者一般有个人或家族癫
发作是由发热引起,患者一般有个人或家族癫 病史。接种该疫苗还可能引起低渗低反应发作的发生,低渗低反应发作是指10岁以下儿童接种疫苗后48 h内发生无力、反应能力下降、面色苍白或发绀,发作时间持续1 min~ 48 h。美国疫苗不良反应报告系统报告的215例低渗反应发作病例中有93%的病例是由接种含百日咳杆菌的疫苗引起的。全细胞百日咳疫苗的问世具有划时代的意义,其使百日咳成为疫苗可预防性疾病,在实施EPI的国家和地区,百日咳的发病率因此下降了90%以上。百日咳全细胞疫苗迄今为止已经应用了近70年,其在控制和降低儿童百日咳发病率方面作出了巨大贡献,但由于该疫苗不良反应较多,特别是20世纪70年代2名日本儿童在接种疫苗后死亡,导致公众对全细胞百日咳疫苗产生抵触,有些国家甚至因此不再将百日咳疫苗列入计划免疫的范围,这直接导致了百日咳发病的上升。以日本为例,在停止使用百日咳疫苗的几年里,百日咳的发病率上升了近20倍,已接近疫苗接种前的水平。
病史。接种该疫苗还可能引起低渗低反应发作的发生,低渗低反应发作是指10岁以下儿童接种疫苗后48 h内发生无力、反应能力下降、面色苍白或发绀,发作时间持续1 min~ 48 h。美国疫苗不良反应报告系统报告的215例低渗反应发作病例中有93%的病例是由接种含百日咳杆菌的疫苗引起的。全细胞百日咳疫苗的问世具有划时代的意义,其使百日咳成为疫苗可预防性疾病,在实施EPI的国家和地区,百日咳的发病率因此下降了90%以上。百日咳全细胞疫苗迄今为止已经应用了近70年,其在控制和降低儿童百日咳发病率方面作出了巨大贡献,但由于该疫苗不良反应较多,特别是20世纪70年代2名日本儿童在接种疫苗后死亡,导致公众对全细胞百日咳疫苗产生抵触,有些国家甚至因此不再将百日咳疫苗列入计划免疫的范围,这直接导致了百日咳发病的上升。以日本为例,在停止使用百日咳疫苗的几年里,百日咳的发病率上升了近20倍,已接近疫苗接种前的水平。
停止常规接种百日咳疫苗后,百日咳发病率大幅上升促使研究者研发更安全有效的百日咳疫苗。20世纪80年代初,美国和日本的研究者均成功分离提纯了PT和FHA,日本首先研制成功并使用无细胞百日咳疫苗。无细胞百日咳疫苗被认为是近数十年来疫苗学领域十大进展之一。无细胞百日咳的成功研制使得大多数发达国家采用无细胞疫苗取代了全细胞疫苗,解决了全细胞疫苗高反应原性带来的问题。此外,无细胞疫苗为以纯化百日咳杆菌蛋白为基础的儿童用联合疫苗提供了平台。无细胞百日咳疫苗是通过纯化工艺,提取细菌中具有免疫原性的抗原成分,去除无免疫原性并引起不良反应的毒性物质。目前抗原提取的方法有2种,其一是日本首先研制成功的共纯化工艺,同时收集PT和FHA等有效成分。我国和日本部分企业采用此种方法。其二是采用分别纯化的方法,用柱层析将不同的抗原分别纯化后按比例合并。前者的产率相对较高,成本低,但存在抗原间比例不稳定的问题,后者纯度与收率之间互为矛盾,尤其是PT,纯度达到90%以上时,收率很难超过70%,加之百日咳杆菌本身的PT产量就很低,一般每毫升培养基仅产3~ 8 μg,而且某些纯化工艺设备要求高,使得成本较高,但各抗原成分的比例等质量控制相对容易。不同生产企业生产的无细胞百日咳疫苗成分及比例均不尽相同,采用共纯化工艺生产的疫苗主要成分为PT和FHA,采用柱层析分别纯化工艺生产的疫苗成分为PT、FHA、PRN,在一些欧美国家疫苗中还加入了FIM(Fim2、Fim3)。在各种抗原成分中,PT是公认的保护性抗原,各企业的制品中均有该抗原成分。有学者认为FHA与接种疫苗后发生的不良反应有关,可能对增强免疫保护作用不大,一般认为PT的免疫原性大于PRN,而FHA的免疫原性较PRN弱。接种无细胞百日咳疫苗后不良反应的严重程度和发生率均远远低于全细胞百日咳疫苗。但目前无细胞百日咳疫苗的生产和质量控制仍存在一些问题,突出问题是对无细胞百日咳疫苗的保护效力很难评价和比较,这是由于疫苗临床有效性和和血清学终点的相关性仍未确定,不同生产企业的生产用菌种、抗原纯化方法及脱毒方法、疫苗抗原组成及含量、效力试验和毒性试验评价方法均不尽相同,而且WHO尚未建立无细胞百日咳疫苗的效力标准品。
近年来有研究者利用基因重组技术研制出基因工程百日咳疫苗。由于PT是公认的百日咳杆菌中强免疫原性抗原,研究者改造了PT基因,使其失去毒性而仅保留免疫活性,还有研究者使用沙门菌作为表达载体,通过基因工程技术使其表达PT、FHA等抗原。现在研究最多的是亚单位疫苗和DNA疫苗。
理想的重组亚单位疫苗应该是能引起显著保护性免疫应答的最小、无毒的蛋白片段。目前,百日咳亚单位疫苗的研究还较少,而且用于研究的抗原成分主要为PT、FHA和PRN。由于这些抗原成分相对分子质量均很大,难以实现直接重组表达,现在的研究主要是从中筛选具有免疫原性的片段,并对其保护性进行研究。
PT是由5个亚单位(S1~S5)构成的A-B型毒素,其中A原体由一分子的S1组成,为PT的毒性所在部位,PT的ADP-核糖转移酶活性和主要保护性决定簇即位于该亚单位上,传统百日咳疫苗的不良反应与S1亚单位的酶活性有关。B寡聚体为2分子的S4分别与1分子的S2、S3结合后,再与S5结合所形成的五聚体,介导毒素吸附至宿主细胞膜上,并辅助A原体进入靶细胞。天然的PT具有多种生物学活性,如ADP-核糖转移酶活性,通过将ADP-核糖转移至G蛋白的α亚单位而抑制G蛋白的活化,从而影响信号转导途径,进而引发一系列生物学效应,主要包括组胺敏感性和胰岛素增多活性。此外,天然PT还有促白细胞增多活性。PT基因的不连续性使其不能直接在体外表达。鉴于PT的主要保护性决定簇位于S1亚单位上,而且ADP-核糖转移酶试验表明,所有天然序列的rS1亚单位均具有酶活性,而部分变异的rS1亚单位均未检出酶活性,因此,突变的S1可能是良好的候选抗原。通过点突变技术,已获得了多种S1亚单位的突变体,其中S1-9K/129G最受关注。该双突变体失去了天然S1的ADP-核糖转移酶活性和天然PT的毒性,却保留了良好的免疫保护活性。S1亚单位含有235个氨基酸残基,其主要的抗原表位和毒性位点位于N-端的179个氨基酸残基,而上述S1突变体的2个突变位点正好在这一区域内,因此这一片段可作为良好的免疫原。Lee等[19]构建表达了一个S1'S1' CTB融合蛋白,其中CTB为霍乱毒素B亚单位,为一种良好的黏膜佐剂,可有效诱导体液免疫和黏膜sIgA应答。将该蛋白鼻内免疫小鼠后,血清和唾液中检测到了IgG和sIgA抗体,这些抗体可体外中和天然PT,但IgG水平要低于PT免疫组。国内也有许多关于S1亚单位的表达及免疫原性的研究,均证实S1具有良好的免疫原性,仅是存在表达量低的问题。
FHA是由百日咳杆菌fhaB基因编码的,与百日咳杆菌黏附和定居在呼吸道上皮细胞有关,基本无毒性。FHA相对分子质量大,前体蛋白为370 000,经蛋白酶作用后的成体蛋白为220 000,难于直接异源表达。FHA具有2个免疫活性位点,分别命名为type Ⅰ、Ⅱ结构域,位于FHA C-端的包含456个氨基酸的type Ⅰ结构域,具有更好的免疫原性,含有大部分活性表位。早在1997年,Leininger等[20]就通过合成肽段的方式,对这一片段的免疫原性进行了证实。
PRN属于自主转运蛋白家族的成员,前体蛋白相对分子质量为93 000,成熟蛋白为69 000。PRN编码基因具有多态性,主要局限于2个具有重复序列的区域,记为区域1和2,二者被289个氨基酸隔开。King等[21]研究表明,PRN具有良好的免疫原性,抗PRN抗体的水平与临床保护性呈正相关,在动物实验中,主动和被动免疫均证明PRN具有保护性。
综上,PT、FHA与PRN均具有良好的免疫原性,但单个亚基的疫苗一般不足以诱导机体产生强的免疫应答,多亚单位疫苗往往可更好地激发机体对疫苗的免疫应答。所以如果能构建含有多个亚单位的融合疫苗,则应会具有更好的免疫原性,达到更好的免疫效果。
百日咳的DNA疫苗主要是采用S1亚单位的编码基因作为研究对象,以日本研究最多。Kamachi等[22]将编码S1亚单位的基因插入到哺乳动物表达载体,免疫动物后,可以抑制天然PT所诱导的白细胞活化。以2 μg和6 μg DNA疫苗分别免疫小鼠,42 d后血清中抗PT IgG抗体浓度分别达到5450 U/L和15 060 U/ L,脑腔攻毒后,对照组全部死亡,免疫组保护率分别为26.7%和46.7%。随着对S1亚单位结构和生物学意义的进一步认识,为了降低天然S1的毒性和ADP-核糖转移酶活性,Kamachi和Arakawa[23]分别以编码S1亚单位N-端180个氨基酸和编码S1'的DNA序列构建DNA疫苗,在动物实验中同样具有一定的免疫原性,只是保护率不能达到理想水平。如果能构建多个亚单位DNA序列的融合DNA疫苗,可能会提高动物试验的保护率。
世界范围内,大多数国家使用WHO推荐的免疫程序[24,25],出生6个月内完成3针注射,而各国稍有差异,如有的国家在出生3~5个月完成;有的国家如美国2000年推荐的儿童免疫程序为出生后2、4、6、15~18个月分别进行4针白喉-破伤风-无细胞百日咳联合疫苗(DTaP)的注射及4~6岁进行加强注射。我国的免疫程序为DTP于出生后3、4、5个月及12个月进行共4针的接种。随着计划免疫的实施,婴幼儿百日咳发病率大幅下降,但是由于疫苗的免疫持久性不够,成人和青少年患者逐渐增多,在一些国家临床报告的病例中,近50%是10岁以上的患者,高发年龄为10~19岁青少年。针对这种情况,目前世界各国对原有的百日咳疫苗免疫程序纷纷进行了修订,青少年被列为加强免疫对象已成为共识,见表1。所有国家均认为,要在青少年和儿童期加强免疫,只是加强免疫的年龄有所差异。澳大利亚、加拿大、德国、瑞士、美国等采取加强免疫的年龄多为4~7岁、4~6岁、5~6岁,在进入青少年阶段(9~15岁)再次进行加强免疫。我国目前推荐的百日咳疫苗免疫程序为:3~5月龄基础免疫接种3剂,18~24月龄加强免疫1剂。在世界百日咳免疫策略发生改变的时候,中国的免疫策略是否需要进行改变,仍取决于我国的百日咳疾病负担和百日咳疫苗保护力的研究。虽然中国的百日咳也有回升,但回升的程度还无很好的数据,所以需要进一步探讨,在此基础上,我国的免疫策略应有改进的余地。
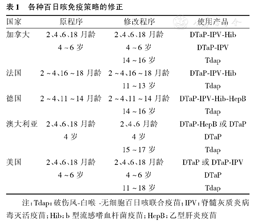
各种百日咳免疫策略的修正
各种百日咳免疫策略的修正
| 国家 | 原程序 | 修改程序 | 使用产品 |
|---|---|---|---|
| 加拿大 | 2、4、6、18月龄 | 2、4、6、18月龄 | DTaP-IPV-Hib |
| 4~6岁 | 4~6岁 | DTaP-IPV | |
| 14~16岁 | Tdap | ||
| 法国 | 2~4、16~18月龄 | 2~4、16~18月龄 | DTaP-IPV-Hib |
| 11~13岁 | Tdap | ||
| 德国 | 2~4、11~14月龄 | 2~4、11~14月龄 | DTaP-IPV-Hib-HepB |
| 14~16岁 | Tdap | ||
| 澳大利亚 | 2、4、6、18月龄 | 2、4、6月龄 | DTaP-HepB或DTaP |
| 4岁 | 4岁 | DTaP | |
| 15~17岁 | Tdap | ||
| 美国 | 2、4、6、18月龄 | 2、4、6、18月龄 | DTaP或DTaP-IPV |
| 4~6岁 | 4~6岁 | DTaP | |
| 11~18岁 | Tdap |
注:Tdap:破伤风-白喉-无细胞百日咳联合疫苗;IPV:脊髓灰质炎病毒灭活疫苗;Hib:b型流感嗜血杆菌疫苗;HepB:乙型肝炎疫苗
百日咳疫苗存在的问题主要体现在预防策略和质量控制上。其中质量控制方面包括疫苗的效力试验、毒性试验、内毒素试验和疫苗的临床评价等问题。
关于预防策略存在2个问题,其一是免疫程序,其二是无细胞百日咳疫苗取代全细胞百日咳疫苗。在实行扩大免疫规划之前,百日咳的主要发病人群为5岁以下的婴幼儿,5岁以上人群很少发病且发病者症状也较轻微。青少年与成人中百日咳发病率升高成为了危害公共健康的重要问题,因此,全球17个国家的37位专家提出了全球百日咳计划(GPI),用以评估百日咳控制策略。GPI这些策略分别是:(1)对成人进行普种;(2)对新生儿母亲及其家庭成员和新生儿密切接种者进行接种;(3)对卫生保健工作者和保育员进行选择性接种;(4)对青少年进行普种;(5)继续对4~ 6岁学龄前儿童加强免疫;(6)加强和(或)改进目前婴幼儿的免疫接种策略。成人普遍接种可能是最终解决问题的办法,但是成人依从性较低,且成本太高,难以实现。对青少年的普种相对容易实施。更有效易行的方法是针对高危人群进行接种,包括目前的儿童免疫程序及必要时加强免疫。此外,由于接种全细胞百日咳疫苗发生不良反应远多于接种无细胞百日咳疫苗,无细胞百日咳疫苗取代全细胞百日咳疫苗是必然的趋势。但也由于无细胞百日咳疫苗供应有限,成本较高,在许多国家还难以列入计划免疫范围,有学者建议在像我国这样的疫苗使用大国,可考虑在完全取代全细胞百日咳疫苗之前,使用无细胞百日咳疫苗进行加强免疫。
尽管无细胞百日咳疫苗的应用对百日咳的预防取得了较好的效果,但许多国家,如美国、澳大利亚等在20世纪90年代改用无细胞百日咳疫苗后,经过近20年的临床观察,学龄期儿童的百日咳发病出现明显增多的现象,且成人百日咳患者也呈上升的趋势,百日咳发病在年长儿与成人病例大幅度上升引起了各国的极大关注[2,4]。
对百日咳疫苗的效果评价,包括实验室效果(即效力试验)和临床效果评价,以及他们之间的相关性,是评价疫苗有效性的重要指标。全细胞百日咳疫苗效力试验采用的是小鼠脑腔攻击法,临床评价采用的是免疫后血清学凝集效价,临床试验证明这2个指标与疫苗的保护力有关。无细胞百日咳疫苗的效力试验问题主要是实验室血清学指标和临床效果的相关性仍未确定,目前的检测方法有3种:脑腔攻击法、鼻腔攻击法和免疫原性检测法。脑腔攻击法主要用于共纯化的无细胞百日咳疫苗,日本将脑腔攻击法用于无细胞百日咳疫苗已有多年,我国和韩国等国家也采用此种方法进行效力检测和疫苗签发。鼻腔攻击法是新建立的方法,接近于百日咳的真实感染情况,但该方法建立时间短,应用范围不广,目前仅应用于欧洲部分产品。免疫原性检测法是采用定量ELISA法检测各抗原在动物体内产生抗体的水平,该方法主要用于分别纯化的无细胞百日咳疫苗,已应用于欧美的产品。WHO曾经组织国际协作组对鼻腔攻击和脑腔攻击进行国际协作研究,认为对于鼻腔攻击方法用于预测无细胞百日咳疫苗临床效力的价值尚需进一步的资料加以确认,协作研究证实了脑腔攻击法可有效区分有免疫学活性和无免疫学活性的制品,因此目前仅推荐免疫原性试验或脑腔攻击试验作为百日咳疫苗的检测方法。
PT是保护性抗原,也是百日咳杆菌的主要毒力因子,其与附着纤毛上皮和阵发性咳嗽有关,所以在WHO举行的无细胞百日咳疫苗质量控制与规程修订研讨会上,提出应对无细胞百日咳疫苗进行可能的残余PT毒性检测,以保证疫苗的安全性。为监控无细胞百日咳疫苗有效成分的纯化分离效果,许多国内外学者认为应在无细胞百日咳疫苗生产和质量控制中增加内毒素含量的检测。建立内毒素含量的标准尚需要进行相关试验验证工作,目前该项工作正在研究试验阶段。
一般不良反应:(1)局部反应,包括注射部位局部肿痛、红肿,偶有硬结形成;(2)发热>38 ℃;(3)烦躁;(4)困倦;(4)食欲不振;(5)恶心。以上反应均为自限性,对症治疗即可。
与疫苗相关的特殊不良反应:(1)过敏反应:有资料报道接种DTP发生过敏者约2/10万剂,并且有充足的证据证明DTP与过敏有因果关系。但即刻过敏反应,如喉水肿、呼吸困难或休克极少见。(2)中枢神经系统疾患:包括长期持续的哭闹,急、慢性脑病或脑炎,吉兰-巴雷综合征,婴儿猝死综合征(SIDS),学习障碍和注意力障碍综合征,婴儿痉挛征,脑电节律异常综合征和雷利综合征。有资料报道接种DTP后引起长期持续的哭闹的发生率为0.1%~6.0%。这些疾病与DTP接种的关系尚无定论。Fine和Chen[26]综述了接种DTP与SIDS无关,由于SIDS的发病高峰期位于出生2~4个月,正好与接种DTP的时间巧合,所以DTP与SIDS无关。(3)其他疾病:有学者提出不良反应包括孤独症,多形红斑与其他皮疹,青春期糖尿病和血小板减少性紫癜。但Howson和Fineberg[27]报道接种DTP与上述疾病有关的证据不足。
尽管人们在连续不断地寻找较安全和免疫原较强的疫苗,但疫苗的不良反应仍在发生。但疫苗的这些不良反应一般来说是轻微的,极少有导致死亡和长期损伤的严重病例,而且对某些严重不良反应与疫苗的关系目前还不确切,大多持否定态度。一方面不能不关注和警惕这些反应,并需进一步加强研究;另一方面也应明白,对于每例被接种者,预防疾病的益处远远高于疫苗的危险。了解疫苗的不良反应是为了使疫苗更加完美,使免疫接种为人类预防感染性疾病,尤其为儿童健康作出更大贡献。
到目前为止,在疫苗研究和应用领域,仍有许多工作要做,如制备和标准化无细胞百日咳疫苗的效力标准品,完善现有的免疫程序,开发新型疫苗等。为解决这些问题,需要研究者进行不懈的努力,以尽早提供高效低不良反应的百日咳疫苗。
总之,百日咳是一种具有高度传染性的、疫苗可预防的疾病,尽管全球绝大多数国家应用全细胞菌苗或无细胞菌苗进行免疫已有70年之久,有效控制了百日咳的流行,但从20世纪80年代起,百日咳在疫苗覆盖率高的国家仍有发病率上升及百日咳局部暴发的报道,这与疫苗的效果及人群中年长儿及成人的免疫力低下有关,特别是当他们发病时,由于症状不典型而延误诊治,从而成为了主要的传染源而感染婴幼儿。因此,对于百日咳的病原学、病理生理、流行病学的深入研究,开发高效、不良反应少的疫苗,采用适当的免疫程序,加强对年长儿及成人的百日咳患者的重视,进一步预防和控制百日咳的感染,减少百日咳对公共健康的巨大冲击,是应该进一步研究的方向。



























