
评价多重探针连接依赖式扩增技术(MLPA)在快速诊断常染色非整倍体疾病中的有效性。
对730份羊水样本进行MLPA检测,同时进行常规染色体G显带核型分析,将检测结果进行比对,检测结果不一致的标本采用荧光原位杂交技术(FISH)进行检测,最后计算其检测的敏感度、特异度和阳性预测值。
730份羊水样本中,MLPA检出正常核型709例,21三体型12例,18三体型4例,13三体型1例,特纳综合征1例,47,XXX 1例,47,XYY 1例,46,XY/47,XY+21 1例。MLPA检测非整倍体异常的敏感度为95%,特异度为100%,阳性预测值为100%。
MLPA是一种快速、高效的诊断常染色体非整倍体疾病的产前诊断,有很好的临床应用价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
染色体非整倍体是导致新生儿染色体异常的主要因素之一。其中常染色体发病率最高的非整倍体是21三体综合征、18三体综合征和13三体综合征[1],性染色体发病率最高的非整倍体是XXY综合征、特纳综合征(45,XO)、XYY综合征和XXX综合征[2]。目前尚无有效的治疗措施,降低其发生最有效的干预措施是进行胎儿产前诊断。多重探针连接依赖式扩增技术(MLPA)作为一种新兴的检测方法,在产前诊断中有很大的潜力[3,4]。本实验采用该技术进行产前染色体非整倍体检测,为评估该技术的有效性提供佐证。
2009年1月1日至2011年1月1日在河南省计划生育科学技术研究院河南省出生缺陷中心就诊的产前筛查高风险孕妇730例,其孕周在16~26周,孕妇年龄在20~45岁。
孕妇在穿刺前行血常规、凝血四项、传染病、胎儿超声等常规检查。在无发热,穿刺部位无敏感不适,无凝血异常,胎儿羊水量足够的情况下,并告知相关风险,孕妇签署知情同意书的情况下行羊膜腔穿刺。取5 mL羊水标本,经3000 r/min离心10 min,弃上清,利用Thermo Scientific KingFisher自动磁珠提取纯化仪从羊水胎儿脱落细胞提取基因组DNA。
采用荷兰MRC-Holland公司的SALSA MLPA P095 Kit(lot 0307)染色体非整倍体试剂盒。将提取的羊水DNA依次进行变性、杂交、MLPA连接反应和常规PCR,最后将PCR反应产物在CEQ8800 Genetic Analysis分析仪进行电泳。
CEQ8800 Genetic Analysis分析仪收集荧光信号并自动生成MLPA图谱。用MRC-Holland公司提供的Coffalyser V8.0软件对图谱进行分析,计算扩增片段的相对峰高(relative peak height,RPH)。获得的男性与女性胎儿羊水标本的相关染色体RPH探针信号分别与健康男女性胎儿的相应染色体的标准RPH探针信号进行比较,RPH在0.8~1.2,判断为相应染色体正常整倍体信号;如果某染色体RPH探针信号低于0.4~0.6,判断为某染色体单倍体;某染色体RPH探针信号大于1.4~1.6,判断为某染色体三倍体;某染色体RPH探针信号0.6~0.8,判断为某染色体单倍体嵌合体;某染色体RPH探针信号1.2~1.4,判断为某染色体三倍体嵌合体。
常规抽取羊水,羊水培养后按照常规步骤进行染色体核型分析[5]。
当染色体核型分析与MLPA检测结果不一致时行FISH检测。应用含X、Y、21号、18号、13号染色体探针的荧光原位杂交试剂盒(金菩嘉公司产品),按试剂盒说明书与未经培养的羊水细胞进行原位杂交,对染色体G显带核型分析与MLPA结果不一致的羊水进行检测。
结果见表1、图1。2种检测方法同时显示为正常男性核型381例,正常女性核型328例,21三体型男性9例,女性3例;18三体型男性3例,女性1例;13三体型男性1例,女性0例;特纳综合征1例;47,XXX 1例;47,XYY 1例;46,XY/47,XY+21 1例。G显带核型分析检测结果:21三体型除经典核型外,还发现有罗伯逊易位(46,XY,rob(21;21),+21;46,XX,rob(14;21),+21)。2种方法检测不一致:G显带核型为45,XO[45]/47,XXX[5],MLPA检测显示X染色体信号增高,提示为X染色体三体嵌合体,该例未培养羊水细胞经X染色体探针FISH分析,计数100个间期羊水细胞,见图2,核型为47,XXX[59]/45,XO[41]。



注:绿色为X,显示核型为:45,XO/47,XXX
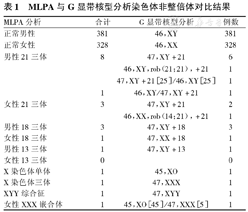
MLPA与G显带核型分析染色体非整倍体对比结果
MLPA与G显带核型分析染色体非整倍体对比结果
| MLPA分析 | 合计 | G显带核型分析 | 例数 |
|---|---|---|---|
| 正常男性 | 381 | 46,XY | 381 |
| 正常女性 | 328 | 46,XX | 328 |
| 男性21三体 | 8 | 47,XY+21 | 6 |
| 46,XY,rob(21;21),+21 | 1 | ||
| 47,XY+21[25]/46,XY[25] | 1 | ||
| 1 | 46,XY/47,XY+21 | 1 | |
| 女性21三体 | 3 | 47,XY+21 | 2 |
| 46,XX,rob(14;21),+21 | 1 | ||
| 男性18三体 | 3 | 47,XY+18 | 3 |
| 女性18三体 | 1 | 47,XX+18 | 1 |
| 男性13三体 | 1 | 47,XY+13 | 1 |
| 女性13三体 | 0 | 0 | |
| X染色体单体 | 1 | 45,XO | 1 |
| X染色体三体 | 1 | 47,XXX | 1 |
| XYY综合征 | 1 | 47,XYY | 1 |
| 女性XXX嵌合体 | 1 | 45,XO[45]/47,XXX[5] | 1 |
MLPA检测非整倍体异常的敏感度为95%,特异度为100%,阳性预测值为100%,见表2。
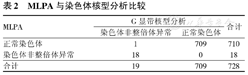
MLPA与染色体核型分析比较
MLPA与染色体核型分析比较
| MLPA | G显带核型分析 | 合计 | |
|---|---|---|---|
| 染色体非整倍体异常 | 正常染色体 | ||
| 正常染色体 | 1 | 709 | 710 |
| 染色体非整倍体异常 | 18 | 0 | 18 |
| 合计 | 19 | 709 | 728 |
产前诊断作为出生缺陷三级预防中的重要干预措施,在预防重大新生儿先天性遗传性疾病的发生中发挥着很大的作用。传统的产前诊断是抽取孕妇羊水,进行染色体核型分析。但是其存在一些缺陷[6]:(1)对人员技术要求较高;(2)完成一个核型分析需要2~3周,检测时间长;(3)广泛检测染色体可能得到不明确的核型异常和没有临床意义的微小缺失;(4)一次检测需要羊水量为16~20 mL,所需样本量较大。因此,作为金标准的核型分析正在面临着新的挑战。定量荧光(QF)-PCR能够在几个小时内对染色体序列的拷贝数进行检测。与核型分析相比,其优势是便宜,可以同时进行大样本的检测。然而多对引物PCR将降低定量的可靠性。为了解决这个问题,MLPA就应运而生了。首先,它可以在一个PCR反应中定量检测50个不同的目标序列,所以检测时间短,仅需2~4 d;其次,其模板是DNA,而不是活的细胞或培养的细,而且每次检测量仅需2 mL羊水;第三,技术要求不高,只要熟练掌握PCR技术的人员就可进行检测。本研究采用MLPA法检测728例羊水标本的21号、18号、13号、X 、Y染色体,结果与G显带染色体分析相比,仅有1例检测结果二者有差异,即G显带核型为45,XO[45]/47,XXX[5],MLPA检测显示X染色体信号增高。采用FISH对该标本再次检测,核型为47,XXX[59]/45,XO[41]。根据以上3种方法的检测结果该羊水标本应是以X三体型为主的嵌合体。随着科技的发展,Yan等[7]在2011年又利用MLPA-array技术设计探针,增加了对2、4、5、11、12、15号染色体的检测。有研究表明,MLPA有代替核型分析的潜能[8]。
在新生儿先天性遗传性疾病中染色体非整倍体是其主要发病因素之一,先天畸形、发育障碍相关的染色体数目和不平衡结构异常约占新生儿的1/200,13号、18号、21号、X、Y染色体非整倍体占有临床意义染色体异常的80%以上,是产前诊断的重心[9]。本研究对MLPA检测染色体非整倍体的效能进行评价,结果显示:敏感度95%,特异度100%,阳性预测值100%。近年来,早期胚胎停止发育发病率明显提高[10],而引起该疾病的主要原因是染色体异常,而21,18,13三体和性染色体非整倍体占胚胎染色体异常的50%~60%[11]。因此,MLPA也是对胚胎绒毛进行快速分析的良好方法。同时,研究表明,MLPA技术还可以分析微缺失或微重复[12,13],这将进一步扩展MLPA的应用范围。
当然,MLPA技术也存在有不足的地方:(1)MLPA技术的原理是对基因拷贝数变异的检测,如果染色体异常,如染色体倒位、易位或重复等不改变基因拷贝数,MLPA技术无法检测到。(2)在嵌合体中异常核型细胞的比例在20%以上才能被MLPA技术检测出来[14],虽然在本研究中利用MLPA技术检测到1例非整倍体嵌合体,但是若异常细胞所占比例较少则不能准确检出。(3)MLPA仅能检测出探针所显示的已知位点,无法检测未知的。但是若针对相应的染色体的基因设计特定探针是可以解决这个问题。
综上,MLPA技术可作为一种快速、准确、廉价的核酸拷贝数增减检测技术,同时随着无创产前诊断技术的推广,相信未来可利用母血游离胎儿DNA进行MLPA检测[15],从而消除羊水穿刺引起的流产风险。另外,随着分子诊断技术在产前诊断技术的广泛应用,MLPA技术将是在产前诊断技术中最理想的选择。



























