
再生障碍性贫血(再障)是严重的血液病之一,临床诊断与治疗难度较大。英国血液学会于2009年推荐的《再生障碍性贫血诊断与治疗指南》是由诸多血液病专家和学者,通过长期经验总结,并采用循证医学方法,收集近年来以英文发表的所有关于再障诊治报道资料,经严格甄别筛选和归纳整理后撰写完成的指导性文件,代表了当今国际上有关再障诊断和治疗原则与临床方法学方面的主流观点。内容全面,依据充分,观点鲜明,论述详尽,临床可操作性强,具有很高的参考价值。现对该指南中与临床诊治密切相关的内容加以精选和归纳,以便能更好地提供给同行参考与借鉴。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自从Ehrlich[1]于1888年首次报道再生障碍性贫血(再障),至今已有100余年的历史,但目前对于再障疾病本质与发病机制的认识仍比较有限。Camitta等[2]学者于1975年推荐的再障诊断与分型标准(Camitta标准)被国内外一直沿用至今,已充分显示了其科学性与实用性。我国专家学者也曾在Camitta标准的基础上,结合国内经验,先后于1987年和2000年发表了《再生障碍性贫血诊断标准》[3]和《小儿再生障碍性贫血的诊疗建议》[4]。随着对再障研究的逐步深入与临床资料的积累,上述标准与建议在再障流行病学、诊断与鉴别诊断细则等方面的论述有欠全面,治疗方法的选择原则有所滞后,也缺乏治疗方法学方面的直接指导意见,因此有必要不断予以充实与完善。
英国血液学会于2009年出版《再生障碍性贫血诊断与治疗指南(guidelines for the diagnosis and management of aplastic anaemia),简称《09版指南》[5],是由诸多血液病专家学者参与,通过长期经验总结,并采用循证医学的方法,以"aplastic anemia(再障)"为关键词,收集近年来以英文发表的所有文献,将其中具有较高证据水平的资料加以归纳与总结,代表了目前国际上有关再障诊断与治疗理论的主流观点,具有很高的参考价值与临床可操作性。正如《09版指南》所指出的,再障属于罕见病,又存在高度异质性,患者的发病也明显受到不同人群遗传背景、生活环境和生活方式等因素的多方面影响,故标准的制定难度较大。也许这也正是其他发达国家近年来并未推荐得到普遍认可、比较全面的再障诊疗指南或建议的主要原因。可见,以英国学者一贯的严谨作风,制定既符合现代研究理论,又能够达成临床普遍共识的"诊疗指南"实属难能可贵,非常值得血液病临床医师认真阅读与参照。现将《09版指南》中的主要内容加以适当整理,归纳如下。
再障为全血细胞降低,骨髓造血细胞减少或缺乏,但无骨髓异常细胞浸润和纤维化,并能除外射线或化疗,以及其他可能导致全血细胞下降的疾病。能除外先天性再障者,为获得性再障。后者大多数为病因不明的原发性再障,少数能明确病因者为继发性再障。《09版指南》仅针对获得性再障。
虽然包括氯霉素在内的多种药物均有可能导致再障,但目前仍均无确切依据。具体可能导致再障的药物见表1。此外,肝炎后再障(hepatitis associated aplastic anaemia,HAAA)为获得性再障的一种特殊类型,而导致HAAA的肝炎大多数并非我们已知的各类常见血清型肝炎。

与再生障碍性贫血发病可疑的相关药物
Suspected drugs associated with the pathogenesis of aplastic anemia
与再生障碍性贫血发病可疑的相关药物
Suspected drugs associated with the pathogenesis of aplastic anemia
| 抗生素 | 链霉素,磺胺类,利奈唑胺 |
| 抗感染药 | 青霉胺,保泰松,吲哚美辛,双氯芬酸,萘普生,吡罗昔康,水杨酸偶氮磺胺吡啶 |
| 抗惊厥药 | 苯妥英钠,卡马西平 |
| 抗甲状腺药 | 卡比马唑,硫脲嘧啶 |
| 抗抑郁药 | 度硫平,噻嗪类 |
| 抗糖尿病药 | 氯磺丙脲,甲苯磺丁脲 |
| 抗疟疾药 | 氯喹 |
| 其他 | 甲苯达唑,噻嗪类,别嘌呤醇 |
外周血常规显示红细胞系、粒细胞系和血小板下降,多数患者血细胞三系呈同步下降,常伴网织红细胞降低。但早期可仅显一系减少,且通常为血小板减少。符合再障诊断的外周血常规至少具备下列3项中的2项:(1)血红蛋白(Hb)<100 g/L;(2)中性粒细胞绝对计数(ANC)<1.5×109/L;(3)血小板(PLT)<50×109/L。
骨髓涂片显示红细胞系、粒细胞系和巨核细胞减少,淋巴细胞百分率增高,浆细胞、肥大细胞和巨噬细胞等非造血细胞增多,并可见巨噬细胞噬血现象。要求必须进行骨髓活检,以避免骨髓涂片穿刺时正好位于"局灶增生"而发生漏诊,也有助于发现异常细胞浸润,可资鉴别诊断。
在确诊再障之前,必须除外可能导致全血细胞下降和骨髓造血细胞减少的其他疾病,归纳主要鉴别诊断要点如下。
髓系和巨核细胞出现成熟障碍或原始细胞增高等病态造血表现、骨髓活检见残余造血区域中网状蛋白增多、7号染色体异常及胎儿血红蛋白(HBF)增高等现象,均为可除外再障并诊断MDS的重要证据。再障也可见红细胞系病态造血及未成熟前体细胞异常定位(ALIP),因此出现上述2种现象,并不足以鉴别再障与MDS。
恶性血液肿瘤,如低增生性白血病、毛细胞白血病和淋巴瘤等,均可出现类似再障的全血细胞下降与骨髓增生低下。但经骨髓检查发现细胞形态学异常及典型肿瘤细胞免疫表型,均为与再障的鉴别要点。
由于再障早期常可见仅血小板一系下降,《09版指南》特别强调易被误诊为ITP。但再障和ITP骨髓检查差别显著,两者鉴别并不困难。提示在诊断ITP时,应进行骨髓检查。
可采用流式细胞仪检测CD55和CD59(需在输血之前进行),以往采用的酸溶血试验和糖水试验法均已被建议放弃。
重症维生素B12(VitB12)或叶酸缺乏也可出现全血细胞下降,但常无明显骨髓增生低下。如检查发现存在VitB12或叶酸缺乏,需要营养补充予以纠正后再行诊断与鉴别。
自身免疫性疾病如系统性红斑狼疮可出现全血细胞下降,但抗核抗体和抗DNA抗体等表达阳性,且常伴骨髓纤维化,而罕见骨髓造血细胞明显减少。
确诊再障之后,仍然基本沿用Camitta等[2]于1975年推荐的重型再障(SAA)诊断标准,主要取决于外周血三系下降程度,并增加Bacigalupo等[9]于1988年提出的关于极重型再障(VSAA)标准。具体标准见表2。

再生障碍性贫血严重程度的诊断分型标准
Definition of severity of aplastic anemia
再生障碍性贫血严重程度的诊断分型标准
Definition of severity of aplastic anemia
| 分型 | 分型标准 |
|---|---|
| SAA | 骨髓:有核细胞百分率<0.25;或0.25~0.50,但残存的造血细胞<30%。血常规:同时具备下列3项中的2项或2项以上:ANC < 0.5×109/L;PLT<20×109/L;网织红细胞计数<20×109/L |
| VSAA | 达到SAA标准,但ANC<0.2×109/L |
| NSAA | 未达到SAA和VSAA诊断标准者 |
注:SAA:重型再障;VSAA:极重型再障;NSAA:非重型再障;ANC:中性粒细胞绝对计数;PLT:血小板 SAA:severe aplastic anemia;VSAA:very severe aplastic anenia;NSAA:non-severe aplastic anemia;ANC:absolute neutrophit count;PLT:platelet
在确诊再障之后,需进行先天性再障和获得性再障分类。
先天性再障常见疾病为范可尼贫血(fanconi anaemia,FA)、先天性角化不良(dyskeratosis congenita,DC)等。FA常见躯体或内脏畸形及智力发育障碍。对于某些不存在上述畸形表现的FA患者,可行丝裂霉素染色体断裂实验以助诊断。DC患者多见皮肤、黏膜与趾(指)甲异常,必要时可行端粒长度和端粒酶等相关检测。
在除外先天性再障之后,其余病例均可归类于后天获得性再障。
原则上能够明确找到导致再障的诱因,如某些药物、环境污染物或疾病[如肝炎、Epsten-Barr病毒(EBV)感染等]者为继发性再障。如前所述,目前认为可能导致再障的药物和化学物质均未能有确切的依据,导致HAAA的肝炎多为非已知的血清型肝炎,EBV等感染性疾病与再障的关系也远未明确,故再障的病因很难确定。因此,绝大多数获得性再障为原因不明的原发性再障。
在符合再障定义的基本条件下,首先需要除外也可能导致全血细胞下降和骨髓造血细胞减少的其他疾病方能确定再障诊断,然后参照表2所示相关标准进行严重程度分型,再根据相关检测,区分先天性再障和获得性再障。对于获得性再障,需要仔细甄别可能的病因,以区分继发性再障和原发性再障。可见临床完整的再障诊断需要包括再障类型,如先天性(具体疾病)或获得性、严重程度[SAA、VSAA、非重型再障(NSAA)]及病因分类,如继发性(确切病因)或原发性,而不能简单地冠以"再障" ,使诊断有欠完整,不利于治疗方法的正确选择。
为完成上述诊断与鉴别,分类与分型的目标,要求初诊病例的常规检测项目包括:(1)全血常规+血细胞形态;(2)骨髓涂片+活检;(3)肝功能与相关病毒学检测(肝炎病毒、EBV等);(4)血清VitB12与叶酸水平;(5)自身抗体(抗核抗体和抗DNA抗体);(6)流式细胞仪检测CD55和CD59;(7)细胞遗传学,如染色体核型与丝裂霉素染色体断裂实验;(8)必要的影像学检查,如胸部X线,以发现可能存在的感染等继发性疾病(但不能采用全身X检查以图发现FA的骨骼畸形);腹部B超,观察有无肝脾或深部淋巴结大,也能及时发现FA患儿常见的肾脏畸形(移位或缺失)。
MSD成功率已达到75%~90%,推荐作为SAA和依赖成分输血儿童NSAA的首选疗法。具体建议简要归纳如下:(1)指征:年龄≤40岁的SAA或VSAA,依赖成分输血或外周血常规进行性降低的儿童NSAA;(2)宜选择骨髓作为干细胞采集部位;(3)干细胞数量:骨髓有核细胞数>3×108/kg;CD34+细胞>3×106/kg;(4)预处理方案:年龄<30岁者,大剂量环磷酰胺(HD-CTX) 50 mg/kg,4 d;ATG 2.50~3.75 mg/kg,3 d;甲泼尼龙(MP)2 mg/kg,3 d(但MP不常用于儿童);不主张放疗作为预处理方案的组成;(5)移植物抗宿主病(GVHD)防治:CsA 5 mg/(kg·d),于移植前1 d起,持续口服9个月后减量,总疗程12个月;辅以短程MP。
虽然近年来MUD移植的5年生存率已上升到65%~73%。如欧洲骨髓移植协作组(EBMT)报道,采用氟达拉滨(30 mg/m2,4 d),低剂量CTX(300 mg/m2,4 d),ATG×4 d作为预处理方案,短程CsA和MP预防GVHD,2年生存率为73%。但《09版指南》仍然认为,MUD移植仅用于ATG+CsA无效者。具体建议简要归纳如下:(1)供体:HLA的Ⅰ类和Ⅱ类抗原全相合;(2)患者:SAA或VSAA,且至少1个疗程ATG+CsA无效者;(3)预处理:对于儿童和年轻患者,拟采用上述EBMT的预处理方案。
前期研究显示,ATG联合CsA治疗再障,有效率明显优于单独应用ATG或CsA的疗法。因此,ATG+CsA已作为标准的IST疗法。
(1)SAA和VSAA:无MSD供者;(2)NSAA:依赖成分输血,或因ANC明显降低,存在严重感染倾向者;(3)轻症患者(无需依赖成分输血,外周血常维持于安全水平的NSAA),可以先行观察,根据外周血常随访结果,再确定是否采用IST。
以往国外普遍以马-ATG(H-ATG)作为首选剂型,将兔-ATG(R-ATG)应用于H-ATG无效或复发者的第2次IST治疗。但由于目前H-ATG供应不足,且R-ATG和H-ATG的制药原理与作用靶点(T淋巴细胞)基本相似,近期报道采用R-ATG作为首选剂型也能获得显著疗效等原因,故《09版指南》已将R-ATG作为首选剂型。推荐R-ATG剂量为3.75 mg/(kg·d),5 d,每日剂量缓慢静脉输注12~18 h。不良反应防治要点:(1)过敏反应:治疗前需进行静脉过敏试验,采用R-ATG 2.5 mg溶于100 mL 9 g/L盐水中,缓慢静脉滴注>1 h,未见明显不良反应者方可接受ATG治疗。每天在输注ATG至少30 min前,需常规输注MP或口服泼尼松龙1~2 mg/(kg·d)及抗组胺药物。(2)严重出血:ATG治疗期间酌情输注血小板,使PLT计数维持于> 30×109/L。(3)血清病:ATG治疗结束后继续应用前述剂量糖皮质激素,每5天减量一半。一旦发生血清病,需采用静脉输注氢化可的松,并加强输注血小板。(4)感染:ATG治疗后出现感染发热,需及时采用广谱强效抗生素治疗。即使考虑为ATG反应所致,也必须在应用糖皮质激素治疗的同时,加用有效抗生素治疗。
CsA每日剂量5 mg/(kg·d),可与ATG同时开始。维持CsA血谷质量浓度在成人为150~250 μg/L,儿童为100~150 μg/L。强调:(1)近期研究表明,儿童维持高水平血浓度并未能提高疗效,但可增加不良反应发生率。(2)长疗程,慢减量:足量CsA需服用至达到该患者的最佳疗效,并维持12个月以上方能缓慢减量。每3个月减量1次,每次减量25 mg为宜,以降低复发率(作者认为25 mg约为成人初始剂量的10%,故儿童可能每次减量也应该为初始剂量的10%。但每次减少的剂量,也许还应该考虑扣除儿童可能存在随着体质量增加所出现的"被动药物减量"现象)。
参照《09版指南》示意图,简要归纳见图1。
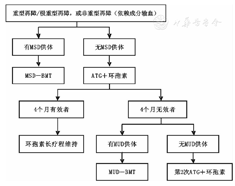
Principle diagram of the choice for children aplastic anemia treatment

注:BMT:骨髓移植;MSD:全相合同胞供体;ATG:胸腺细胞球蛋白;MUD:全相合无关供体 BMT:bone marrow transplantation;MSD:matched sibling donor;ATG:antithymocyte globulin;MUD: matched unrelated donor
Principle diagram of the choice for children aplastic anemia treatment
血小板输注指征为外周血PLT<10×109/L(处于感染发热状态时,PLT<20×109/L)。酌情红细胞输注,以争取维持于外周血Hb>80 g/L。
雄性激素的疗效得到了比较充分的肯定,可明显促进红细胞系造血,甚至可能有助于外周血三系回升,并有助于提高ATG的疗效。但由于雄性激素可导致比较明显的肝损害和男性化等不良反应,故需要谨慎使用,治疗期间需定期复查肝功能和肝脏B超。可能由于受到上述不良反应的限制,故仅推荐应用于IST无效或无法接受IST的患者。
目前已明确指出不存在安全有效并可长期应用于治疗再障的细胞生长因子。因此,反对常规使用促红细胞生成素(EPO)、促血小板生成素(TPO)和粒单细胞集落刺激因子(GM-CSF)等治疗再障。粒系集落刺激因子(G-CSF)也仅限于静脉输注抗生素或抗真菌药物治疗无效的感染病例,剂量为5 mg/(kg·d),但如使用1周后未见ANC上升,则建议停用G-CSF。
建议采用以氨基糖苷类和β-内酰胺类为主的抗生素积极控制感染。广谱抗生素无效者,需及时加用抗真菌药物。住院病例ANC<0.5×109/L时,需预防性口服抗生素(氨基糖苷类或喹诺酮类)和抗真菌药物(伊曲康唑或泊沙康唑)。对于近期接受BMT或IST治疗者,需行卡氏肺囊虫和病毒感染的预防性治疗。
初诊病例需严密询问病史,一旦发现在诊断前6个月至1个月之内接触过前述可疑药物或化学制剂者,必须立即和永远停止使用或接触。除非特殊原因,不能接种疫苗,尤其是减毒活疫苗。但BMT成功者,需要接种疫苗,以助免疫重建。凡血清铁蛋白>1 000 μg/L者,需选择采用合适的铁螯合剂(如去铁胺等)治疗。再障治疗是一个长期与困难的过程,需要由医护人员、家属成员与亲朋好友共同对患者进行合适的心理疏导。
推荐采用Camitta[10]于2000年提出的再障疗效评价标准,以非常明确的"量化指标"作为依据,临床可操作性强,具体见表3。疗效判断需至少参考连续2次以上的外周血常规(每次间隔4周以上),而且检测期间未接受成分输血或造血生长因子治疗。

免疫抑制治疗再生障碍性贫血疗效评价标准
Criteria for response to immunosuppressive therapy in aplastic anemia
免疫抑制治疗再生障碍性贫血疗效评价标准
Criteria for response to immunosuppressive therapy in aplastic anemia
| SAA疗效标准 | ||
| 无效 | 仍处于SAA程度 | |
| 部分反应 | 停止依赖输血;病情改善,外周血常规已经高于SAA标准 | |
| 完全反应 | Hb达到患者年龄段的正常范围;ANC>1.5×109/L;PLT>150×109/L | |
| NSAA疗效标准 | ||
| 无效 | 疾病进展,或未能达到下列有效指标 | |
| 部分反应 | 停止依赖输血(治疗之前依赖成分输血者) | |
| 或血常规中的至少一系细胞较原来增加一倍或已恢复到正常水平 | ||
| 或治疗前Hb<60 g/L者,现Hb较原先增加30 g/L以上 | ||
| 或治疗前ANC<0.5×109/L者,现ANC>0.5×109/L | ||
| 或治疗前PLT<20×109/L者,现PLT>20×109/L | ||
| 完全反应 | 与SAA标准相同 | |
注:SAA:重型再障;Hb:血红蛋白;ANC:中性粒细胞绝对计数;PLT:血小板;NSAA:非重型再障 SAA:severe aplastic anemia;Hb:hemoglobin;ANC:absolute neutrophit count;PLT:platelet;NSAA:non-severe aplastic anemia
由于再障在欧美地区属于罕见病,又存在高度异质性,故难以获得充分的大样本双盲对照研究临床资料,致使研究进展也相对比较缓慢,因此,某些观点还需要进一步探索、研究和总结。某些方面可能并不太非常符合亚裔人群再障患者,尤其是亚洲欠发达地区(包括我国)患者的病情受到诸多环境、经济与生活方式等国情因素的影响。虽然该指南主要针对于成人再障,但也基本能满足儿童再障的临床技术参照要求。但考虑到某些方面并不完全适合于儿童再障,主要包括流行病学和鉴别诊断等方面的问题。故《09版指南》推荐可适当参考有关儿童再障的专题文献[11]。



























