
观察蓝莓花青素对肥胖大鼠血脂、血清炎性因子及胰岛素敏感性的影响。
雄性SD大鼠30只随机数字表法分为对照组(7只,普通饲料喂养)和高脂组(23只,高脂饲料喂养)。6周后,肥胖造模成功的16只大鼠随机均分为肥胖组和花青素组。花青素组予蓝莓花青素200 mg/(kg·d)灌胃,其余2组予等量蒸馏水灌胃。4周后,空腹采血,全自动生化分析仪测血糖、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL),放射免疫分析法测空腹胰岛素,酶联免疫吸附实验测肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)、超敏C-反应蛋白(hs-CRP)。处死大鼠分离内脏脂肪组织称重,并计算稳态模型评估胰岛素抵抗指数(HOMA-IR)和内脏脂肪比。应用SPSS 19.0统计软件进行数据分析。
花青素组血糖[(9.15±1.10) mmol/L]、TC[(462.5±81.5) mg/L]、TG[(152.5±19.1) mg/L]、LDL[(203.7±31.1) mg/L]、TNF-α[(4.03±1.03) ng/L]、IL-6[(1.81±0.31) ng/L]、hs-CRP[(106.62±15.52) ng/L]和HOMA-IR(3.94±0.78)均较肥胖组[分别为(11.38±1.50) mmol/L、(566.2±113.2) mg/L、(192.5±24.9) mg/L、(253.7±58.3) mg/L、(5.74±1.61) ng/L、(3.85±0.93) ng/L、(132.62±17.18) ng/L、5.09±0.90]显著降低,差异均有统计学意义(P均<0.05);但仍高于对照组[(7.52±1.37) mmol/L、(377.1±71.3) mg/L、(124.2±26.3) mg/L、(135.7±38.2) mg/L、(2.41±0.42) ng/L、(1.12±0.46) ng/L、(72.28±12.11) ng/L、2.41±0.23];而HDL[(126.2±38.1) mg/L]显著高于肥胖组[(95.0±25.6) mg/L],但仍低于对照组[(165.7±22.3) mg/L];上述差异均有统计学意义(P均<0.05)。肥胖组体质量、内脏脂肪比及胰岛素[(439.75±19.44) g、(4.62±0.39)%、(10.22±1.42) mIU/L]与蓝莓花青素组[(431.38±13.10) g、(4.30±0.37)%、(9.81±0.98) mIU/L]相比,差异均无统计学意义(P均>0.05),但上述指标明显高于对照组[(358.86±15.32) g、(3.61±0.45)%、(7.22±2.06) mIU/L],差异均有统计学意义(P均<0.05)。肥胖大鼠体质量、内脏脂肪比、TC、TG、LDL、TNF-α、IL-6、hs-CRP、血糖、胰岛素与HOMA-IR呈正相关(r=0.733、0.668、0.602、0.607、0.683、0.728、0.784、0.907、0.743,P均<0.01),HDL与HOMA-IR呈负相关(r=-0.581,P<0.01)。
蓝莓花青素可增加肥胖大鼠胰岛素敏感性,这种作用可能与改善血脂紊乱及弱炎症状态有关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前,儿童肥胖在全世界已成流行趋势[1]。儿童肥胖不仅影响形象、心理和生理的发育,肥胖相关高脂血症、高胰岛素血症、胰岛素抵抗等也是2型糖尿病、心血管疾病等慢性病的高危因素[2]。因此,早期预防及治疗极为重要。但是,手术和药物均不适用于儿童;运动治疗疗效欠佳且难以维持。因此,饮食干预治疗成为首选方法。花青素(anthocyanidin)是广泛存在于深红色、紫色和蓝色蔬菜、水果中的一种天然色素,常应用于食品工业。近年来的研究显示其具有抗炎、抗氧化、降血脂、抗动脉粥样硬化等功效[3,4,5,6]。蓝莓花青素(blueberry anthocyanidin)是从水果蓝莓中提取的一种新型花青素(基本结构为3,5,7-三羟基-2-苯基苯并吡喃),其抗炎、降血脂等功效尚不确切。本研究通过构建肥胖大鼠模型,观察饮食补充蓝莓花青素对肥胖大鼠体质量、血脂、血清炎性因子及胰岛素敏感性的影响,为其防治肥胖相关心血管疾病危险因素提供理论依据。
实验动物:3周龄(相当于人类幼儿期)健康雄性清洁级SD大鼠30只,体质量50~60 g,购自大连医科大学动物实验中心[许可证号:SYXK(辽)20080002]。饲料:基础饲料购自大连医科大学动物实验中心;高脂饲料参照文献[7]自制。
蓝莓花青素(纯度25%,批号:20120522,大连美仑生物科技有限公司)。大鼠胰岛素放射免疫试剂盒(编号RI-13K,北京福瑞生物工程公司),血糖试剂盒(批号:20120310,日本和光纯药工业株式会社),三酰甘油(TG)、总胆固醇(TC)试剂盒(批号:20120702,北京九强生物技术股份有限公司),高密度脂蛋白(HDL)、低密度脂蛋白(LDC)试剂盒(批号:20090918,温州市维日康生物科技有限公司),大鼠肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)酸联免疫吸附实验(ELISA)试剂盒(编号:F16960、F15870,上海西唐生物科技有限公司),大鼠hs-CRP ELISA试剂盒(编号:RBE007,上海博谷生物科技有限公司)。全自动生化分析仪(日立HITACHI7600-110),酶标仪(美国AWARENS Stat Fax-3200),离心机(德国sigma 3-16PK),电子天平(美国OHAUS CP153),电子秤(上海舜宇恒平,JA12K-1)。
大鼠适应性喂养3 d,随机分为对照组(7只,普通饲料喂养)和高脂组(23只,高脂饲料喂养),2组体质量差异无统计学意义[(56.43±2.76) g比(55.64±2.16) g,t=0.721,P>0.05]。6周后,高脂组中体质量超过对照组平均体质量20%的16只大鼠作为实验用肥胖大鼠[8]。肥胖大鼠均分为肥胖组和花青素组,2组体质量差异无统计学意义[(259.50±13.25) g比(266.38±17.97) g,t=-0.871,P>0.05]。在原有饮食的基础上,花青素组以200 mg/(kg·d)蓝莓花青素蒸馏水溶液灌胃,其余2组等量蒸馏水灌胃;每天1次,连续4周。实验期间,所有大鼠饲养于大连医科大学清洁级动物饲养中心,自由摄食及饮水,环境温度(20~24 ℃)和湿度(45%~65%)适宜,明暗周期12 h∶12 h,每周同一时间称量体质量1次。
实验结束前,大鼠过夜禁食12 h,不禁水,次日以100 mL/L水合氯醛(每100 g体质量0.3 mL)腹腔麻醉后,右心室采血3~4 mL,低速离心机(3 000 r/min,离心半径13.5 cm)离心10 min,分离血清,-20 ℃冰箱保存待检。采血后大鼠断颈处死,分离内脏脂肪组织(包括附睾脂肪垫、肾周脂肪、肠系膜脂肪),滤纸吸干后电子天平称重(精确到0.001 g)。
放射免疫分析法测空腹胰岛素(FINS),全自动生化分析仪检测空腹血糖(FPG,G-6-PDH法)、TC(CHOD-PAP法)、TG(GPO-PAP法)、HDL(PEG直接法)、LDL(表面活性剂直接法),ELISA测TNF-α、IL-6和hs-CRP水平。上述指标的检测严格按照说明书操作。计算公式:胰岛素抵抗指数(HOMA-IR)=[FPG(mmol/L)×胰岛素(FINS)(mIU/L)]/22.5,内脏脂肪比=[内脏脂肪组织质量(g)/体质量(g)]×100%。
应用SPSS 19.0软件进行统计分析。计量资料以 ±s表示;2组间均数比较采用成组样本t检验;多组组间均数比较采用单因素方差分析,组间两两比较采用SNK法;采用Pearson相关,双侧检验行线性相关分析。P<0.05为差异有统计学意义。
±s表示;2组间均数比较采用成组样本t检验;多组组间均数比较采用单因素方差分析,组间两两比较采用SNK法;采用Pearson相关,双侧检验行线性相关分析。P<0.05为差异有统计学意义。
肥胖组和花青素组体质量、内脏脂肪比显著高于对照组,差异有统计学意义(P<0.05);肥胖组与花青素组体质量及内脏脂肪比差异均无统计学意义(P均>0.05),见表1。
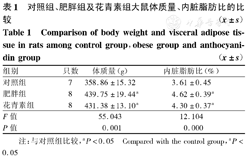
对照组、肥胖组及花青素组大鼠体质量、内脏脂肪比的比较( ±s)
±s)
Comparison of body weight and visceral adipose tissue in rats among control group,obese group and anthocyanidin group( ±s)
±s)
对照组、肥胖组及花青素组大鼠体质量、内脏脂肪比的比较( ±s)
±s)
Comparison of body weight and visceral adipose tissue in rats among control group,obese group and anthocyanidin group( ±s)
±s)
| 组别 | 只数 | 体质量(g) | 内脏脂肪比(%) |
|---|---|---|---|
| 对照组 | 7 | 358.86±15.32 | 3.61±0.45 |
| 肥胖组 | 8 | 439.75±19.44a | 4.62±0.39a |
| 花青素组 | 8 | 431.38±13.10a | 4.30±0.37a |
| F值 | 55.043 | 12.104 | |
| P值 | 0.001 | 0.000 |
注:与对照组比较,aP<0.05 Compared with the control group,aP<0.05
与对照组比较,肥胖组TC、TG、LDL显著增高,HDL显著降低。与肥胖组相比,花青素组TC、TG、LDL显著降低,但仍高于对照组;HDL显著增高,但仍低于对照组。上述差异均具有统计学意义(P均<0.05),见表2。
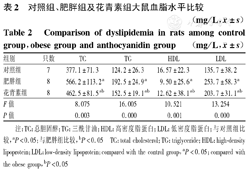
对照组、肥胖组及花青素组大鼠血脂水平比较(mg/L, ±s)
±s)
Comparison of dyslipidemia in rats among control group,obese group and anthocyanidin group(mg/L, ±s)
±s)
对照组、肥胖组及花青素组大鼠血脂水平比较(mg/L, ±s)
±s)
Comparison of dyslipidemia in rats among control group,obese group and anthocyanidin group(mg/L, ±s)
±s)
| 组别 | 只数 | TC | TG | HDL | LDL |
|---|---|---|---|---|---|
| 对照组 | 7 | 377.1±71.3 | 124.2±26.3 | 16.57±22.3 | 135.7±38.2 |
| 肥胖组 | 8 | 566.2±113.2a | 192.5±24.9a | 9.50±25.6a | 253.7±58.3a |
| 花青素组 | 8 | 462.5±81.5ab | 152.5±19.1ab | 12.62±38.1ab | 203.7±31.1ab |
| F值 | 8.075 | 16.005 | 10.521 | 13.254 | |
| P值 | 0.003 | 0.000 | 0.001 | 0.000 |
注:TC:总胆固醇;TG:三酰甘油;HDL:高密度脂蛋白;LDL:低密度脂蛋白;与对照组比较,aP<0.05;与肥胖组比较,bP<0.05 TC:total cholesterol;TG:triglyceride;HDL:high-density lipoprotein;LDL:low-density lipoprotein;compared with the control group,aP<0.05;compared with the obese group,bP<0.05
与对照组相比,肥胖组血清炎性因子TNF-α、IL-6、hs-CRP显著增高;与肥胖组相比,花青素组上述指标显著降低,但仍高于对照组;上述差异均有统计学意义(P均<0.05),见表3。

对照组、肥胖组及花青素组大鼠血清炎性因子水平比较(ng/L, ±s)
±s)
Comparison of TNF-α,IL-6 and hs-CRP among control group,obese group and anthocyanidin group(ng/L, ±s)
±s)
对照组、肥胖组及花青素组大鼠血清炎性因子水平比较(ng/L, ±s)
±s)
Comparison of TNF-α,IL-6 and hs-CRP among control group,obese group and anthocyanidin group(ng/L, ±s)
±s)
| 组别 | 只数 | TNF-α | IL-6 | hs-CRP |
|---|---|---|---|---|
| 对照组 | 7 | 2.41±0.42 | 1.12±0.46 | 72.28±12.11 |
| 肥胖组 | 8 | 5.74±1.61a | 3.85±0.93a | 132.62±17.18a |
| 花青素组 | 8 | 4.03±1.03ab | 1.81±0.31ab | 106.62±15.52ab |
| F值 | 15.533 | 43.918 | 29.377 | |
| P值 | 0.001 | 0.000 | 0.000 |
注:TNF-α:肿瘤坏死因子-α;IL-6:白细胞介素-6;hs-CIRP:超敏C-反应蛋白;与对照组比较,aP<0.05;与肥胖组比较,bP<0.05 TNF-α:tumor necrosis factor-α;IL-6:interleukin-6;hs-CRP:high sensitive C-reactive protein;compared with the control group,aP<0.05;compared with the obese group,bP<0.05
与对照组相比,肥胖组FPG、FINS及HOMA-IR显著增高;与肥胖组相比,花青素组FPG、HOMA-IR显著降低,但仍高于对照组;上述差异均有统计学意义(P均<0.05)。花青素组与肥胖组FINS差异无统计学意义(P>0.05),见表4。

对照组、肥胖组及花青素组大鼠FPG、胰岛素及HOMA-IR指数的比较( ±s)
±s)
Comparison of FPG,FINS and HOMA-IR among control group,obese group and anthocyanidin group( ±s)
±s)
对照组、肥胖组及花青素组大鼠FPG、胰岛素及HOMA-IR指数的比较( ±s)
±s)
Comparison of FPG,FINS and HOMA-IR among control group,obese group and anthocyanidin group( ±s)
±s)
| 组别 | 只数 | FPG(mmol/L) | FINS(mIU/L) | HOMA-IR |
|---|---|---|---|---|
| 对照组 | 7 | 7.52±1.37 | 7.07±2.06 | 2.41±0.23 |
| 肥胖组 | 8 | 11.38±1.50a | 10.22±1.42a | 5.09±0.90a |
| 花青素组 | 8 | 9.15±1.10ab | 9.81±0.98a | 3.94±0.78ab |
| F值 | 8.761 | 15.859 | 24.717 | |
| P值 | 0.000 | 0.000 | 0.000 |
注:FPG:空腹血糖;FINS:空腹胰岛素;HOMA-IR:胰岛素抵抗指数;与对照组比较,aP<0.05;与肥胖组比较,bP<0.05 FPG:fasting plasma glucose;FINS:fasting insulin;HOMA-IR:homeostasis model of assessment insulin resistence;compared with the control group,aP<0.05;compared with the obese group,bP<0.05
肥胖大鼠体质量、内脏脂肪比、TC、TG、LDL、TNF-α、IL-6、hs-CRP、FPG、FINS与HOMA-IR均呈正相关(r=0.733、0.668、0.602、0.607、0.683、0.728、0.784、0.907、0.743,P均<0.01),HDL与HOMA-IR呈负相关(r=-0.581,P<0.01)。
既往已有大量研究报道花青素对高脂饮食饲养的鼠科动物体质量及体脂的影响,但结果不一致。Roopchand等[4]的研究显示花青素可降低肥胖小鼠血糖、体质量及血清胆固醇;而Marques等[5]的研究显示其并不能降低肥胖大鼠及小鼠体质量及血清胆固醇水平。既往研究显示花青素的安全有效剂量为50~300 mg/kg体质量[9,10]。本研究选用较大剂量蓝莓花青素对肥胖大鼠进行干预,以期观察其对肥胖相关糖脂代谢紊乱及可能出现的糖尿病糖脂代谢紊乱的影响。结果显示饮食补充蓝莓花青素(纯度25%)4周对肥胖大鼠体质量及内脏脂肪量无明显影响。然而,有学者报道提纯的花青素可明显抑制肥胖大鼠体质量及体脂增加[11]。本研究与Prior等[12]的研究中使用的花青素与提纯花青素相比,纯度尚不够高,混杂的其他成分可能通过影响花青素的吸收与代谢削弱其降低体质量与体脂的功效。
蓝莓花青素虽不能降低肥胖大鼠体质量及体脂,但本研究显示其可明显降低肥胖大鼠血清TC、TG、LDL,增加血清HDL,改善肥胖大鼠的血脂紊乱,与Roopchand等[4]的研究结果一致。蓝莓花青素改善肥胖相关血脂紊乱的可能机制为:激活肝脏腺苷酸活化蛋白激酶(AMPK),抑制胆固醇合成的限速酶——羟甲基戊二酸单酰辅酶A还原酶的活性,减少胆固醇合成;激活肝脏AMPK,抑制乙酰辅酶A羧化酶的活性,增加脂肪酸的氧化,减少脂肪酸的合成;抑制肝脏胆固醇酯转运蛋白(CETP)活性,降低LDL,增加HDL[6,9,13]。
蓝莓花青素除能改善肥胖大鼠血脂紊乱外,亦明显降低高脂饮食导致的血清TNF-α、IL-6和hs-CRP水平增高,改善肥胖诱导的慢性弱炎症状态,与Guo等[10,14]等的研究结果一致。既往研究显示,长期高脂饮食或肥胖导致脂肪细胞肥大、脂肪组织巨噬细胞浸润,进而脂肪组织功能紊乱,脂肪细胞分泌的促炎性细胞因子TNF-α、IL-6 、hs-CRP等增多,抗炎性细胞因子脂联素等减少,导致脂肪组织的弱炎症[15];当炎症持续加重,脂肪组织炎性因子经门脉循环释放入外周血,导致外周血抗炎性与促炎性细胞因子失调,使机体处于慢性弱炎症状态,并导致胰岛素抵抗[16,17,18]。蓝莓花青素通过激活肝脏AMPK,增加脂肪酸氧化、减少脂肪酸合成,进而减少脂肪细胞脂质沉积,逆转脂肪细胞肥大,最终减少脂肪组织及肝脏、骨骼肌等器官脂肪组织堆积,促进抗炎性细胞因子的分泌,抑制促炎性细胞因子的分泌,改善机体弱炎症状态及胰岛素抵抗[6,10]。
高脂饮食诱导的肥胖除导致血脂紊乱及机体弱炎症状态外,常伴有不同程度的血糖、胰岛素增高及胰岛素抵抗[19]。本研究中肥胖大鼠FPG、FINS及HOMA-IR明显增高,饮食补充蓝莓花青素4周,空腹血糖及HOMA-IR明显降低,说明蓝莓花青素能有效改善肥胖相关高糖血症及胰岛素抵抗。既往研究表明高脂饮食通过增加机体炎症、改变脂质代谢及改变肠道菌群导致胰岛素抵抗[18]。蓝莓花青素作用机制:(1)激活肝脏AMPK,抑制糖异生,增加脂肪酸氧化,减少脂肪酸及胆固醇合成;激活骨骼肌和白色脂肪组织AMPK,增加葡萄糖的利用[6]。(2)降低脂肪组织及外周血TNF-α、IL-6等炎性因子水平[20],减弱炎性因子对胰岛素受体/胰岛素受体底物1/蛋白激酶B/叉头框转录因子O胰岛素信号通路的抑制作用[14]。此外,本研究亦显示肥胖大鼠FPG、TC、TG、LDL、TNF-α、IL-6、hs-CRP与HOMA-IR呈正相关,HDL与HOMA-IR呈负相关;蓝莓花青素降低血糖、血脂(TC、TG、LDL)及血清炎性因子(TNF-α、IL-6、hs-CRP)水平,增加HDL水平。据此,推测蓝莓花青素可能通过改善糖脂质代谢紊乱及机体弱炎症状态增加胰岛素敏感性。
综上所述,蓝莓花青素能明显改善肥胖相关糖脂代谢紊乱、机体弱炎症状态及胰岛素抵抗,但对肥胖大鼠体质量及体脂无明显影响。蓝莓花青素可能通过改善糖脂代谢紊乱及减轻机体弱炎症状态增加胰岛素敏感性,在未来的研究中需从基因水平进一步证实。此外,受目前国内提取工艺的限制,本研究使用的蓝莓花青素为非纯化蓝莓花青素,未来的研究中仍需观察纯化蓝莓花青素对肥胖大鼠体质量及体脂的影响。



























