
B淋巴细胞起源于骨髓中的造血干细胞,骨髓(禽类为法氏囊)是B淋巴细胞发育和成熟的场所。B淋巴细胞在骨髓内的发育,经历了祖B淋巴细胞、前B淋巴细胞、未成熟B淋巴细胞及成熟B淋巴细胞几个阶段。B淋巴细胞的分化过程可分为抗原非依赖期和抗原依赖期。在B淋巴细胞亚群中,CD5+B1细胞和分泌IL-10的B调节细胞(B10细胞)与自身免疫性疾病的发生发展可能相关,前者可能促进炎性反应发生,后者可能有下调和抑制自身免疫性炎症的作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
B淋巴细胞是由骨髓中的造血干细胞分化发育而来,在禽类是在法氏囊内发育生成,故又称囊依赖淋巴细胞(bursa dependent lymphocyte)或骨髓依赖性淋巴细胞(bone marrow dependent lymphocyte),简称B细胞。B细胞分化过程可分为2个阶段,即抗原非依赖期和抗原依赖期。在B细胞亚群中,CD5+B1细胞和分泌白细胞介素(IL)-10的B调节细胞(B10细胞)在自身免疫性疾病的发病中可能起重要作用。
人类B细胞的分化过程主要分为前B细胞、未成熟B细胞、成熟B细胞、活化B细胞和浆细胞5个阶段。其中前B细胞和未成熟B细胞的分化是抗原非信赖的,其分化过程在骨髓中进行。成熟B细胞在抗原刺激后活化,继续分化为分泌抗体的浆细胞,这一过程是抗原依赖性的,主要在外周免疫器官(淋巴结、脾脏)中进行[1]。
前B细胞是从骨髓中淋巴干细胞分化而来,只存在于骨髓和胎肝等造血组织。前B细胞能检出的最早标志是Ig重链基因重排,随后在胞质中可检测出IgM的重链分子,即μ链。但无轻链基因重排,也无膜Ig表达,因此前B细胞对抗原无应答能力,不表现免疫功能。末端脱氧核甘酸转移酶(terminal deoxy nucleotidyl transferase,TdT)及共同型急性淋巴母细胞白血病抗原(common acute lymphoblastic leukaemia antigen,CALLA)即CD10为前B细胞的特异性标志,开始表达CD19、CD20和主要组织兼容性复合体(MHC)Ⅱ类抗原。
此阶段未成熟B细胞发生轻链基因重排,故可组成完整的IgM分子,开始表达膜表面IgM,并可与抗原结合使膜受体交联,产生负信号,从而使B细胞处于受抑状态,这种作用可能是使自身反应B细胞克隆发生流产,不能继续分化为成熟B细胞,是形成自身免疫耐受的重要机制之一。未成熟B细胞开始丧失TdT和CD10,但可表达CD22、CD21及Fc受体,同时CD19、CD20以及MHCⅡ类分子表达量增加。
随着B细胞的进一步分化,成熟B细胞离开骨髓进入周围免疫器官。此时膜表面可同时表达膜表面免疫球蛋白(surface membrane immunoglobulin,mIg)M和mIgD,mIgD的表达防止了B细胞与抗原结合后所引起的免疫耐受。成熟B细胞可发生一系列膜分子变化,表达其他多种膜标志分子,如丝裂原受体、补体受体、Fc受体、细胞因子受体、病毒受体及一些其他分化抗原等。
成熟B细胞可在周围淋巴器巴接受抗原刺激,在Th细胞及抗原提呈细胞的协助下,及其产生的细胞因子作用下可使B细胞活化,称为活化B细胞。在此过程中,膜结合免疫球蛋白水平逐渐降低,而分泌型免疫球蛋白逐渐增加,并可发生免疫球蛋白基因重链类别的转换。活化B细胞中的一部分可分化为小淋巴细胞,停止增殖和分化,并可存活数月至数年,当再次与同一抗原接触时,很快发生活化和分化,产生抗体的潜伏期短,抗体水平高,维持时间长,这种B细胞称为记忆性B细胞(memory B cell),与机体的再次免疫应答相关。
浆细胞又称抗体分泌细胞(antibody secreting cell)。成熟B细胞接受抗原刺激,在抗原提呈细胞及Th细胞的辅助下成为活化B细胞,继而发生增殖分化,成为具有合成和分泌各类免疫球蛋白的浆细胞。当成熟B细胞分化为浆细胞时,可出现一些新的浆细胞特有标志,如浆细胞抗原-1(plasma cell antigen-1,PCA-1)等分子,同时B细胞表面的部分标志,如mIg、MHCⅡ类抗原、CD19、CD20、CD21等消失。一种浆细胞只能产生一种类别的Ig分子,并且丧失产生其他类别的能力。浆细胞寿命常较短,其生存期仅数日,随后即死亡。
人类B细胞分化的最早部位是卵黄囊,此后在脾和骨髓,出生后则在骨髓内分化发育成熟。B细胞分化过程可分为2个阶段,即抗原非依赖期和抗原依赖期。在抗原非依赖期,B细胞分化与抗原刺激无关,主要在骨髓内进行。而抗原依赖期是指成熟B细胞受抗原刺激后,继续分化为合成和分泌抗体的浆细胞阶段,主要在周围免疫器官如淋巴结和脾脏内进行。小鼠及人类B细胞发育过程见图1[2]。人类B1a,B1b和B10细胞亚群的特征尚不清楚。
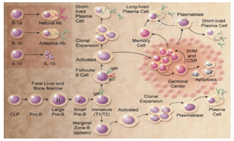

注:CLP:共同淋巴系前体细胞;SHM:体细胞高频突变;CSR:类别转换重组 CLP:indicates common lymphoid progenitor; SHM:somatic hypermutation; CSR:class switch recombination
早期B细胞的增殖与分化,与HIM密切相关。HIM是由造血细胞以外的基质细胞(stroma cell)及其分泌的细胞因子和细胞外基质(extracellular matrix, ECM)组成。HIM的作用主要是通过细胞因子调节造血细胞的增殖与分化,通过黏附分子使造血细胞与间质细胞相互直接接触,促进造血细胞的定位和成熟细胞的迁出。
目前已证明,B细胞在骨髓内的发育,可经过祖B细胞(pro-B cell)、前B细胞、未成熟B细胞、活化B细胞及成熟B细胞几个阶段。B细胞在骨髓内分化各阶段的主要变化为免疫球蛋白基因的重排和膜表面标志的表达。B细胞在发育分化过程中,同样也经历选择作用以除去非功能性基因重排B细胞和自身反应性B细胞,形成周围成熟的B细胞库。在此阶段,成熟B细胞经抗原刺激后可继续分化为合成和分泌抗体的浆细胞,即抗原依赖的分化阶段。
B细胞的细胞膜上有许多不同的标志,主要是表面抗原及表面受体。这些表面标志均是结合在细胞膜上的巨蛋白分子,籍以识别抗原、与免疫细胞和免疫分子相互作用,也是分离和鉴别B细胞的重要依据。B细胞表面标志主要有白细胞分化抗原(CD抗原)、MHC抗原及多种膜表面受体。
CD抗原是B细胞表面重要的膜表面标记,与B细胞识别、黏附、活化功能密切相关。应用某些B细胞CD抗原相应的单克隆抗体可鉴定和检测B细胞的数量、比例、不同的分化阶段和功能状态,如CD10为前B细胞的特异性标志,而CD19可表达于除浆细胞外B细胞发育的所有阶段,且随着B细胞的成熟其表达量增加。
B细胞不仅表达MHCⅠ类抗原,而且表达高比例的MHCⅡ类抗原。除了浆细胞外,从前B细胞至活化B细胞均表达MHCⅡ类抗原,在B细胞的抗原提呈过程及T、B细胞相互接触中起重要作用。
B细胞膜表面具有多种类型的受体,能识别特异性抗原并与之结合后发挥相应功能[2,3]。
mIg是B细胞特异性识别抗原的受体,也是B细胞重要的特征性标志。未成熟B细胞表达mIgM,成熟B细胞同时表达mIgM和mIgD,这2种Ig是B细胞抗原受体(B cell receptor, BCR)的主要组成成分。BCR具有抗原结合特异性,在同一个体内,其多样性高达109~1012,构成BCR库,发挥识别个体的各种抗原、产生特异性抗体的功能。在成熟B细胞表面,同时存在Igα和Igβ二聚体,2条肽链可分为胞外区、跨膜区和胞质区,Iga、Igβ和BCR共同表达,形成BCR-Igα/Igβ复合体,执行识别抗原,并转导BCR接受的抗原刺激信号的作用。
B细胞膜表面具有CR1和CD2。CR1(CD35)可与补体C3b和C4b结合,促进B细胞的活化。CD2(CD21)的配体是C3d,C3d与B细胞表面CR2结合,在调节B细胞分化中起辅助作用。
EB病毒选择性感染具有EB病毒受体的B细胞,临床上可导致传染性单核细胞增多症、Burkitt淋巴瘤及鼻咽癌等。CR2即是EB病毒受体之一。
可通过与mIg结合刺激人B细胞的增殖,如美洲商陆丝分裂原(PWM)对T、B细胞均有致有丝分裂的作用。在实验小鼠,脂多糖(LPS)是常用的致有丝分裂原。此外金黄色葡萄球菌CowanI株(Staphylococcus aureusstrain CowanI,SAC)可通过与mIg结合刺激人B细胞的增殖。
细胞因子通过与B细胞表面相应的细胞因子受体结合而发挥调节B细胞的活化、增殖和分化作用。B细胞表面的细胞因子受体主要有IL-1R、IL-2R、IL-4R、IL-5R、IL-6R、IL-αR和TGF-βR等。
根据B细胞表面是否存在CD抗原5(CD5)的表达,可以将人类B细胞分为B1细胞和B2细胞。B1细胞为CD5+B细胞,占B细胞总数的5%~10%,属固有免疫细胞,在免疫应答早期发挥作用,无需Th细胞的辅助,因此,该类细胞为T细胞非依赖性B细胞[4]。B1细胞的作用除参与非特异性免疫,产生抗细菌抗体发挥抗感染免疫效应外,同时能产生多种反应性自身抗体,以清除变性的自身抗原。此外,B1细胞还能产生致病性自身抗体,介导自身免疫性损伤,与自身免疫性疾病的发生有关[5]。
B2细胞为CD5-B细胞,占B细胞中的大多数比例,经过从祖B细胞到浆细胞的分化过程,经抗原刺激后,在Th细胞辅助下浆细胞产生各种抗体,发挥体液免疫的作用。此过程依赖T细胞的辅助和参与,故B2细胞又称为T细胞依赖性B细胞。B2细胞在抗原提呈、介导机体特异性体液免疫应答及免疫调节方面发挥主要作用。
Bregs与调节性T细胞(Treg)相似,B细胞中新的细胞亚群——Bregs同样发挥着双向免疫调节的作用。Bregs可通过细胞间接触的方式抑制免疫反应,具有抑制树突状细胞和巨噬细胞活性的负性调节作用[6,7]。已知的人类Bregs表面标志为CD48,CD148,CD24,CD27和CD38,人类与鼠Bregs的共同特征是均可分泌IL-10,IL-10可协助Breg发挥免疫抑制作用。
按照分泌不同的细胞因子分类,Bregs可分为分泌IL-10的Bregs(B10细胞)、分泌转化因子β1(TGF-β1)的Bregs及Foxp3相关Bregs[1]。其中B10细胞的调节功能受到广泛关注。已有研究证实,IL-10具有诱导Th0细胞向Th2分化,抑制Th1的分化,进而影响Th1/Th2的平衡;阻止抗原提呈,阻止单核细胞及巨噬细胞产生促炎因子;抑制DC分泌IL-6和IL-12,抑制Th17细胞的诱导分化等作用[8,9]。
自身免疫性疾病是由于血清中各种自身抗体产生增多,引起多器官特异性抗原抗体反应,导致多系统多脏器损伤的一大类疾病。与近年来Th17/Treg细胞平衡的研究一样,B细胞亚群,尤其是B1细胞和B10细胞在这类疾病发生发展中的作用也越来越受到关注。
最近有文献表明,CD5可能激活多种信号通路,包括细胞外信号调节激酶(ERK1/2)、磷脂酰肌醇3激酶(PI-3K)、雷帕霉素靶蛋白(mTOR)和磷酸酶-细胞核因子(NFAT)信号通路,并且通过转录因子NFAT2和STAT3的激活,改变了包括IL-10在内的细胞因子产生。该结果可能是CD5+B1细胞发挥不同与CD5-B2细胞的功能特性的基础[10]。另外,在自身免疫性疾病系统性红斑狼疮(SLE)和脐血的体外实验中发现,IL-21可直接诱导CD5+B细胞中颗粒酶B的表达和分泌,同时BCR的刺激放大了这一效应过程。血清中IL-21和颗粒酶水平显著增高,表明IL-21可能通过介导CD5+B细胞中颗粒酶表达而抑制CD5+B细胞的扩张增殖,从而起到对SLE疾病修饰的作用[11]。在SLE患者血清中检测出高浓度的B细胞趋化因子CXCL13,且该浓度的增高与SLE活动度呈正相关;同时,活化的CD5+B1细胞可能具有促进自身抗体的产生及抑制炎性反应的双重作用[12]。
Bregs对自身免疫性疾病的免疫抑制作用也相继被报道[13]。Bregs可通过CD40、B7-2通路抑制效应性T细胞的增殖,从而抑制自发的慢性结肠炎[14]。还可通过召集Tregs、NKT细胞等抑制性细胞,起到下调自身炎症的作用。在IL-10--小鼠关节炎模型中,Tregs数量及Foxp3表达明显降低,Th1和Th17细胞数量显著增加,进一步证实B10细胞及极其细胞因子IL-10可能协同其他的免疫细胞及Tregs,抑制Th1和Th17细胞分化发育,发挥负性免疫调节作用[8]。此外,在其他自身免疫性疾病,如1型糖尿病(T1D)[15]、多发性硬化(MS)[16]及溃疡性结肠炎(UC)[17]等实验动物及患者研究中均报道了相似的结果。
当然,目前人类对于B细胞各阶段的分化发育过程,T、B细胞间的相互作用,尤其是对CD5+B1细胞可能的致炎作用,Bregs的可能抑炎作用尚缺乏权威的文献报道。对于人类B细胞各亚群的功能、具体作用机制、与其他免疫细胞的相互作用及与自身免疫性疾病发病的关系等多数停留在实验动物阶段。如何有效利用B细胞各亚群之间的相互作用,Bregs与其他免疫细胞之间的平衡,达到预防和治疗自身免疫性疾病的目标,期待更多细致深入的研究报道。



























