
探讨C57BL/6J小鼠棕色脂肪成脂分化功能随着年龄增加的变化情况。
选取0周(初生)、4周、8周、12周C57BL/6J雌雄小鼠各4只,分别取其肩胛部的棕色脂肪组织。采用免疫组织化学法来鉴别其棕色脂肪,之后提取棕色脂肪的总RNA,并对总RNA的质量进行鉴定。通过实时荧光定量PCR法检测0周、4周、8周、12周C57BL/6J小鼠棕色脂肪成脂分化相关基因PPARα、C/EBPα、PGC–1α、PPARγ、FOXC2、BMP7的表达水平。
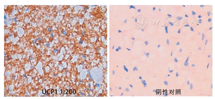
解耦联蛋白–1(UCP1)免疫组织化学显示阳性着色较深的为C57BL/6J小鼠棕色脂肪组织,实时荧光定量PCR结果显示成脂分化基因的表达量随着小鼠年龄增加逐渐降低,各时间点之间差异有统计学意义[PPARα(F=11.96,P<0.000 1)、C/EBPα(F=9.39,P<0.000 1)、PGC–1α(F=17.21,P<0.000 1)、PPARγ(F=13.11,P<0.000 1)、FOXC2(F=12.23,P<0.000 1)、BMP7(F=16.44,P<0.000 1)]。
小鼠棕色脂肪成脂分化能力随着小鼠年龄增长逐渐减退,活性逐渐降低。但其功能的调控因素尚需进一步研究探索。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
众所周知,哺乳动物有2种脂肪组织:白色脂肪组织(WAT)和棕色脂肪组织(BAT)[1]。WAT是储能组织,而BAT是耗能组织,通过消耗脂肪产热,维持体温以适应环境[2]。BAT主要由棕色脂肪细胞组成,细胞内含有丰富的线粒体[3]。线粒体内膜上存在特有的解偶联蛋白–1(UCP1 ),线粒体产生大量的ATP通过UCP1解偶联作用,最终导致产热和大量化学能的消耗[4]。起初BAT被认为只存在新生儿体内,成年后逐渐消失,最近有研究通过正电子发射计算机断层显像(PET–CT)证实在成人体内也存在BAT[5,6]。因为BAT可以消耗体内的能量,所以激活BAT的活性被人们视为减肥的好方法。有文献报道BAT的活性与年龄、肥胖、温度有关[7]。本研究通过实时荧光定量PCR(RT–PCR)检测不同年龄段小鼠棕色脂肪成脂分化相关基因的表达变化,探讨小鼠棕色脂肪成脂分化功能随着年龄增加的变化情况。现报告如下。
实验动物购自南京医科大学动物中心并通过南京医科大学动物伦理委员会批准(批号:20120108)。匀浆器(IKA,德国),Trizol (Invitrogen Carlsbad CA,USA),RNeasy mini–试剂盒(Qiagen Hilden,德国),Thermo Scientific RevertAid First Strand cDNA Synthesis kit (Thermo Scientific,Wilmington DE),UCP1一抗(ABcame公司,浓度1:200),二抗兔源(北京中杉金桥生物技术有限公司,滴度1:100)。
每个周龄选取C57BL/6J雌雄小鼠各4只,按周龄分为:初生(0周)、4周、8周、12周,它们分别相当于人类的新生儿期、青春期、青春后期及成年期。实验小鼠在同一环境中生存。取已选好周龄的C57BL/6J小鼠,拉颈处死,然后浸泡在750 mL/L的乙醇中10 min。在超净工作台内取出小鼠双肩胛部皮下脂肪组织,在无菌PBS缓冲液中除去表面的结缔组织及WAT。清洗完立即保存在液氮中。
用40 g/L多聚甲醛固定组织27 h。组织固定后用常规方法制作石蜡切片,切片常规脱蜡至水;进行抗原修复,把切片放在0.01 mol/L枸橼酸钠缓冲液中煮沸15 min。500 mg/L牛血清清蛋白(BSA)封闭,室温孵育20 min倒去血清,滴加UCP1一抗4 ℃过夜;滴加二抗兔源37 ℃孵育30 min;二氨基联苯胺(DAB)显色,苏木精复染,脱水,透明,封片,最后拍照。根据细胞显色有无分为阳性和阴性,细胞中出现棕黄色颗粒为阳性。
从液氮中取出脂肪组织,加入700 μL Trizol,用匀浆器匀浆。根据RNeasy mini–试剂盒说明书提取组织总RNA。采用Agilent BioAnalyzer 2100进行RNA样品的质量、浓度和纯度的测定,并用10 g/L的变性琼脂糖凝胶电泳检定。按照反转录Thermo Scientific Revert Aid First Strand cDNA Synthesis kit的说明书要求混合各组分后,8 000×g离心30 s,65 ℃ 5 min,冰上激冷;然后按照反转录体系说明书加入反转录酶(MIX),混匀;最后置于PCR反应仪器中进行反转录,反应条件为:65 ℃ 5 min,45 ℃ 60 min,70 ℃ 5 min,4 ℃。
通过加州大学基因数据库(UCSC)、生物信息学数据库(Ensembl)等基因库查找基因PPARα、C/EBPα、PGC–1α、PPARγ、FOXC2、BMP7的正确序列,选择小鼠18S作为内参。采用Primer 3 (http://sourceforge.net/projects/primer3/)在线软件设计引物,然后通过美国国立生物技术信息中心基因数据库(NCBI)中的Blast进行引物特异性验证,送公司合成引物。引物序列见表1。

成脂分化相关基因引物序列
Primer sequences of adipogenic differentiation associateted gene
成脂分化相关基因引物序列
Primer sequences of adipogenic differentiation associateted gene
| 基因名称 | 上游引物 | 下游引物 |
|---|---|---|
| PPARα | AGAGCCCCATCTGTCCTCTC | ACTGGTAGTCTGCAAAACCAAA |
| C/EBPα | TGCGCAAGAGCCGAGATAAA | CCTTCTGTTGCGTCTCCACG |
| PGC–1α | CCCTGCCATTGTTAA GACC | TGCTGCTGT TCCTGT TTTC |
| PPARγ | GTGCCAGTTTCGATCCGTAGA | GGCCAGCATCGTGTAGATGA |
| FOXC2 | CCTTCTACCGCGAGAACAAG | CCGGGTCGAGCGTCCAGTAG |
| BMP7 | CCTGATTGGACGGCATGGAC | CCTCTTGGTTCTTTGGCGTC |
| 18S | GTAACCCGTTGAACCCCATT | CCATCCAATCGGTAGTAGC |
参照SYBR® Select Master Mix (Life Technologies,US)试剂盒进行RT–PCR。其反应体系为20 μL,由10 μL SYBR Green PCR Master Mix、1 μL Forward Primer、1 μL Reverse Primer、1 μL cDNA和7 μL灭菌双蒸水组成。PCR反应条件:50 ℃预变性2 min,95 ℃预变性2 min,95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸1 min,40个循环。溶解曲线分析:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。每个样品重复3次。
应用SPSS 17.0统计软件进行分析,实验数据用 ±s表示,组间数据比较采用单因素方差分析,P<0.05为差异有统计学意义。
±s表示,组间数据比较采用单因素方差分析,P<0.05为差异有统计学意义。
RNA样品电泳28S、18S条带清晰可见,用Agilent BioAnalyzer 2100测定仪检测所有样本OD260/OD280在1.9~2.0(图1)。

注:1~3为0周;4~6为4周;7~9为9周;10~12为12周 1–3:0 week;4–6:4 weeks;7–9:8 weeks;10–12:12 weeks
阳性着色较深的为BAT,图2示所取小鼠肩胛区的脂肪组织为棕色脂肪。

结果显示随着小鼠年龄的增长,成脂分化基因的表达量逐渐降低,提示随着小鼠年龄的增长棕色脂肪成脂分化功能逐渐降低,且各时间点之间差异有统计学意义[PPARα(F=11.96,P<0.000 1)、C/EBPα(F=9.39,P<0.000 1)、PGC–1α(F=17.21,P<0.000 1)、PPARγ(F=13.11,P<0.000 1)、FOXC2(F=12.23,P<0.000 1)、BMP7(F=16.44,P<0.000 1)],见表2。
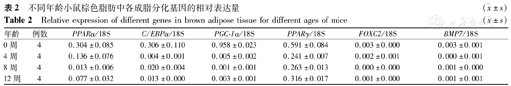
不同年龄小鼠棕色脂肪中各成脂分化基因的相对表达量( ±s)
±s)
Relative expression of different genes in brown adipose tissue for different ages of mice( ±s)
±s)
不同年龄小鼠棕色脂肪中各成脂分化基因的相对表达量( ±s)
±s)
Relative expression of different genes in brown adipose tissue for different ages of mice( ±s)
±s)
| 年龄 | 例数 | PPARα/18S | C/EBPα/18S | PGC–1α/18S | PPARγ/18S | FOXC2/18S | BMP7/18S |
|---|---|---|---|---|---|---|---|
| 0周 | 4 | 0.304±0.085 | 0.306±0.110 | 0.958±0.023 | 0.591±0.084 | 0.003±0.000 | 0.003±0.001 |
| 4周 | 4 | 0.136±0.076 | 0.004±0.001 | 0.005±0.002 | 0.241±0.007 | 0.002±0.001 | 0.000±0.001 |
| 8周 | 4 | 0.013±0.006 | 0.020±0.004 | 0.001±0.001 | 0.263±0.013 | 0.000±0.000 | 0.001±0.000 |
| 12周 | 4 | 0.077±0.032 | 0.013±0.000 | 0.003±0.001 | 0.316±0.017 | 0.001±0.000 | 0.001±0.001 |
肥胖和高脂血症是2型糖尿病和心血管疾病的危险因素[8]。研究发现50 g BAT能增加每天20%的能量消耗[9],而BAT活性增加能使代谢率增加[10]。有研究证实,BAT除了存在于婴儿体内外,在成人体内也存在一定比例[6,11]。
有研究通过18F–氟脱氧葡萄糖(FDG)结合断层显像技术检测暴露于热中性(22 ℃)和寒冷环境(16 ℃)中BAT的活性,发现寒冷环境下可检测到BAT,而热中性环境未检测到,且超重和肥胖受试者BAT摄取葡萄糖的活性显著低于消瘦者[11]。Yoneshiro等[12]通过FDG–PET–CT技术检测暴露于寒冷刺激下的BAT活性,结果显示59%未检测到BAT,而41%人群可检测到,且与未检测到组相比,受试者年龄、体质量指数及体脂含量均显著降低(P均<0.01),提示BAT的活性可能与机体内脂肪及年龄相关。Cypess等[5,13]研究发现BAT的水平及活性随着年龄增加而显著下降。
本研究通过检测不同年龄段小鼠的棕色脂肪成脂分化相关基因的表达,发现成脂分化相关基因的表达随着年龄增加显著降低,但在4周龄和8周龄,部分基因的表达量高,而这一时期小鼠正处在青春发育期,推测可能与这一时期的身体发育有关,这需要进一步研究。有研究发现棕色脂肪细胞起源于肌源性因子5(Myf5),但是BAT的生成受很多因素的调节,调控中胚层发育的信号分子可影响BAT的早期发育,如骨形态发生蛋白(BMP)、Wnt蛋白家族、纤维母细胞生长因子(FGF)等[13]。去甲肾上腺素是调节BAT生理功能的重要因子,可通过PPARs、PPARγ共激活因子(PGC–1α),PRDM–16等转录因子和辅因子等诱导BAT的发育分化和代谢功能的发挥。
BMP家族属于分泌因子转化生长因子–β(TGF–β)超家族成员,对脂肪分化具有重要的调节作用。Tseng等[14]发现BMP–7可启动中胚层前体细胞向BAT方向分化,同时还能诱导BAT调节因子缺陷的胚胎BAT含量和UCP1表达量明显降低。Cederberg等[15]发现在WAT中过表达FOXC2可诱导棕色脂肪样细胞生成,线粒体数目增加及产热相关基因UCP1、PGC–1α表达上升。PGC–1α被认为是PPARγ的冷诱导共激活剂,越来越多的证据表明PGC–1α是棕色脂肪细胞和骨骼肌细胞线粒体生物合成和氧化代谢的重要调控因子,其在棕色脂肪细胞发育和产热功能中发挥着重要作用。尽管棕色和白色脂肪细胞发育起源和生理功能有着显著差异,但这2种细胞类型有着非常相似的转录水平的级联反应,控制着脂肪细胞的分化过程。PPARγ和C/EBPs是促使脂肪细胞分化的重要的转录调控因子,C/EBPs通过调控PPARγ的表达参与脂肪细胞分化的转录级联反应。而PPARα是脂肪酸代谢的重要调控因子,高表达于小鼠的BAT中[16]。
本研究仅对BAT的功能做了初步研究,是对BAT的重新发现,给肥胖的治疗带来新的希望,但本研究中的基因在衰退中发挥的功能调控并不明确,其功能的调控因素尚需进一步研究探索。



























