
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
干扰素(interferon,IFN)是一类具有广谱抗病毒、抗肿瘤和免疫调节作用的蛋白质,包括Ⅰ型、Ⅱ型和Ⅲ型,分别具有不同的受体和功能,是机体天然免疫的关键组成部分。其中Ⅰ型IFN于1957年发现[1],是人和动物受病毒感染后产生的重要抗病毒物质,根据其基因和蛋白结构的不同,又分为IFN-α、IFN-β、IFN-ε、IFN-κ、IFN-ω等[2]。IFN-α已有3个亚型被批准为药品在临床使用,分别为IFN- α1b、IFN- α2a和IFN- α2b,目前均为基因重组产品。国外使用的IFN-α主要是IFN-α2a和IFN-α2b,其基因来源于西方白种人。国内使用的IFN-α主要是IFN-α1b,其基因由我国侯云德院士于1982年从健康中国人脐血白细胞中获得[3]。
IFN-α1b注射液是我国第一个具有自主知识产权的基因工程Ⅰ类新药,已经在国内儿科领域广泛应用20余年,积累了大量文献和临床使用经验。多个多中心临床研究的资料显示,IFN-α1b治疗呼吸道合胞病毒(RSV)肺炎、毛细支气管炎、手足口病(HFMD)和病毒性肠炎等疗效好,不良反应轻[4,5,6,7]。由于其他亚型的IFN-α临床应用较少,且无多中心临床研究资料,因此,经过专家多次讨论,形成本共识,并主要涉及IFN-α1b,以规范地指导临床的合理使用。
IFN-α1b的抗病毒作用主要通过诱导细胞产生抗病毒蛋白和激活细胞免疫这2条途径实现。前者是通过其与细胞表面受体结合,激活JAK-STAT信号通路,诱导2',5' -寡腺苷酸合成酶(OAS)、磷酸二酯酶和蛋白激酶等多种抗病毒蛋白表达,进而抑制感染细胞内病毒的复制,保护正常细胞免除病毒的侵入[8,9]。后者是通过增强机体细胞免疫,包括促进细胞毒性T淋巴细胞(CTL)增殖、激活自然杀伤(NK)细胞杀伤活性和巨噬细胞吞噬功能,发挥清除病毒的作用(图1)。
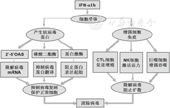

注:IFN:干扰素;2',5'-OAS:2',5'-寡腺苷酸合成酶;CTL:细胞毒性T淋巴细胞;NK:自然杀伤 IFN:interferon;2',5' -OAS:2',5'-oligoadenylates synthesis;CTL:cytotoxic lymphocyte;NK:natural killing
IFN-α1b是中国人机体抗病毒的主要IFN亚型,如果机体内源性IFN缺乏和生成不足,则抗病毒能力下降[10]。儿童由于免疫功能尚不成熟,特异性体液免疫和细胞免疫水平及IFN相对较低,易发生病毒感染。许多病毒,如RSV[11]、人鼻病毒(HRV)[12] 、流感病毒(IFV)[13]、副流感病毒(PIV)[14]、肠道病毒71型(EV71)[15]、柯萨奇病毒(CoxV)[16]、轮状病毒(RV)[17]、EB病毒(EBV)[18]等感染机体后,病毒会产生一些特定的蛋白,主动逃避或抑制免疫系统,特别是抑制内源性IFN的产生,使机体不能形成有效的抗病毒状态。给予外源性IFN-α1b能提高机体IFN水平,促进JAK-STAT信号通路的激活,增强机体组织细胞产生抗病毒蛋白的能力和免疫细胞清除病毒的能力,减少组织病理损伤[19];IFN-α1b还能调节病毒感染引起的T淋巴细胞亚群失衡[20]。
大量儿科临床用药经验和多中心研究资料表明,通过肌肉注射和呼吸道雾化吸入等途径给予IFN-α1b,对儿童病毒感染的治疗有重要作用,尤其雾化吸入IFN- α1b治疗病毒感染,药物能直接作用于呼吸道黏膜,具有靶向性强、疗效高、安全性好、操作简便、儿童依从性高等优点,并可经支气管、细支气管到达肺部,较多地集中在肺部组织,缓慢入血,较肌肉注射给药作用更持久[21],因此,雾化吸入IFN-α已被国家标准处方集[22]和《儿童雾化中心规范化管理指南》[23]推荐使用。
IFN-α1b是通过基因重组技术生产的生物制剂,临床应用20年的结果证明具有良好的安全性。
通过万方数据库和中国知网检索,截止到2015年4月,对公开报道的410篇儿童应用IFN-α1b的文献进行统计分析,在用IFN-α1b的29 378例病例中,总不良反应发生率为12.1‰,其中肌肉注射和雾化吸入分别为17.3‰和3.0‰,低于其他IFN亚型。肌肉注射不良反应主要为低度发热和流感样症状,少数患肝炎等长期用药的患儿可出现轻度食欲减退、轻度脱发和轻度白细胞总数下降。雾化吸入不良反应很少,偶见低度发热。IFN-α1b不良反应常为一过性,一般不需对症处理,即可缓解[24,25]。
西京医院药物临床试验机构儿科感染专业组按照国家临床药物试验的批件要求,对IFN-α1b注射液(运徳素)在病毒性肺炎恢复期患儿的耐受性及安全性(Ⅰ期临床)进行研究,结果表明肌肉注射IFN-α1b注射液最大剂量2.0 μg/(kg·次),雾化吸入最大剂量4.0 μg/(kg·次),应用于4个月以上年龄的儿童是安全的,且耐受性好,无严重不良反应发生[26]。
国内关于毛细支气管炎[5]、小儿病毒性肺炎[4]、HFMD[6]和腹泻[7]等较大样本的多中心临床研究结果也显示,IFN-α1b雾化吸入2~4 μg/(kg·次)和肌肉注射1~2 μg/(kg·次),治疗5~7 d,对儿童均是安全的;在这些多中心研究中患儿最小年龄为45 d。也有IFN-α1b治疗新生儿安全性良好的报道[27,28]。
有关IFN-α1b长期肌肉注射影响儿童生长发育的报道至今尚未见到。有一项261例的小儿病毒性肝炎长期肌肉注射IFN-α1b不良反应的研究,全程监测时间最长为10年,平均为5~6年,结果显示IFN-α1b的不良反应发生率和发热及白细胞下降程度明显低于IFN-α2b,IFN-α1b长期注射未引起患儿肾功能、甲状腺功能、精神和神经系统、听力和生长发育的异常[24]。
但是,下列情况应禁用IFN-α1b:已知对IFN制品过敏者、有严重心血管病史者和癫 。病毒感染导致的重度血小板减少、严重出血性疾病的患儿不宜肌肉注射IFN-α1b,病情需要时可用雾化吸入给药。
。病毒感染导致的重度血小板减少、严重出血性疾病的患儿不宜肌肉注射IFN-α1b,病情需要时可用雾化吸入给药。
为了对IFN-α1b在儿科疾病中的应用做出推荐意见,参考相关文献[29]制定了推荐意见强度分级标准,即本专家共识依据的研究或文献证据分级和推荐分级系统。依据证据等级强度,将推荐意见分为A、B、C、D、E共5个等级(表1)。

推荐分级和证据级别
Grading system used for this consensus
推荐分级和证据级别
Grading system used for this consensus
| 项目 | 级别 | 证据来源 |
|---|---|---|
| 推荐分级 | A | 被至少2项Ⅰ级证据支持 |
| B | 被1项Ⅰ级证据支持 | |
| C | 只被Ⅱ级证据支持 | |
| D | 被至少2项Ⅲ级证据支持 | |
| E | 被Ⅳ或Ⅴ级证据支持 | |
| 证据级别 | Ⅰ | 结果很明确的大型随机研究;假阳性和/或假阴性错误的风险低 |
| Ⅱ | 结果不明确的小型随机研究;假阳性和/或假阴性错误的风险中到高 | |
| Ⅲ | 非随机的同期对照队列研究 | |
| Ⅳ | 非随机的历史对照队列研究 | |
| Ⅴ | 病例报道、非对照研究、专家意见 |
注:用来支持Ⅰ级证据的大型研究的定义为病例数≥100例或完成预设终点评价且具有足够把握度的研究 Large studies warranting level Ⅰ evidence were defined as those with ≥100 patients or those which fulfilled end point criteria predetermined by power analysis
毛细支气管炎(又称细支气管炎)常见于婴幼儿,6个月以下婴儿最多见,主要由RSV、HRV和PIV等引起,其中RSV是最常见的病原[30,31]。本病尚无特效治疗,临床以氧疗、补液、控制喘息等对症治疗为主[32,33],可使用IFN-α1b抗病毒进行早期对因治疗。IFN-α1b治疗毛细支气管炎有雾化吸入和肌肉注射2种给药方式。
最近一项330例关于毛细支气管炎的随机、对照、多中心临床研究证实,在常规治疗基础上,雾化吸入IFN-α1b注射液2~4 μg/(kg·次),2次/d,疗程5~7 d,疗效显著,安全性好;低剂量组2 μg/(kg·次)和高剂量组4 μg/(kg·次)的总改善率分别为92.3%和95.0%,均显著优于对照组,喘息、哮鸣音、三凹征等症状的持续时间明显缩短;高剂量组的症状改善率高于低剂量组;发病72 h内治疗组改善率高于发病72 h后治疗组;雾化吸入IFN-α1b对RSV阳性和RSV阴性的毛细支气管炎患儿均有良好疗效,对RSV阳性者疗效更好[5]。另有多个单中心的研究均表明IFN-α1b雾化吸入治疗毛细支气管炎有良好效果[34,35,36,37,38]。
我国小儿病毒性肺炎的主要病原是RSV、HRV、PIV,其他病原有腺病毒(ADV)、人偏肺病毒(HMPV)、IFV和巨细胞病毒(CMV)等[41]。目前,仅IFV、CMV有针对性治疗药物,其他病毒感染均以对症、支持治疗为主。
有研究显示RSV和PIV能分别通过表达非结构蛋白NS1和NS2及P/C基因产物而抑制内源性IFN的产生[11,14],HRV也有类似的作用机制[12]。动物实验结果显示IFN-α1b抗RSV的作用优于利巴韦林和常用中药,并呈剂量-疗效依赖关系[42,43]。临床研究表明IFN-α1b治疗RSV、PIV、ADV和HRV等病毒性肺炎,能改善患儿预后,提高治愈率,尤其是其对RSV引起的肺炎疗效更显著,总有效率达95%以上,并有助于减少心力衰竭和呼吸衰竭等严重并发症的发生[44,45,46,47,48]。
HFMD是由EV71及柯萨奇病毒A组16型(CoxA16)等多种肠道病毒引起的婴幼儿常见传染病[51]。EV71等病毒可通过3C蛋白抑制内源性IFN的表达,引起多系统感染甚至重要器官的严重损伤[15,16]。给予IFN能抑制EV71和CoxA16复制,减轻感染组织的炎症反应,保护未感染的细胞,提高实验动物存活率[52,53]。IFN的这种抗病毒效应与给药剂量呈正相关[54]。预防性或感染早期及时给药对EV71感染的机体保护作用更明显[52,53,54]。
多项临床研究显示,HFMD轻型病例在发病早期使用IFN-α1b肌肉注射或雾化吸入治疗有助于缩短发热时间,促进手足皮疹及口腔溃疡愈合[55,56,57,58],亦可同时涂抹患处[59]。
对HFMD重型患儿,IFN-α1b雾化吸入和肌肉注射也有确切疗效。一项针对HFMD神经系统受累期病例(其中97%为EV71感染患儿)的随机对照、多中心临床研究显示,在常规对症治疗基础上加用IFN-α1b雾化吸入,可以显著缩短患儿热程,缩短易惊、肢体抖动等神经系统症状的持续时间,且安全性良好[6,60]。IFN-α1b肌肉注射亦可缩短HFMD合并病毒性脑炎患儿的神经系统病理征持续时间,促进体温恢复和脑脊液白细胞计数恢复正常,提高治愈率[61]。
IFN-α1b治疗CoxV引起的疱疹性咽峡炎,能缩短热程,促进疱疹愈合,提高总有效率[62]。
推荐方案 IFN-α1b注射液治疗和预防HFMD,雾化吸入:1~2 μg/(kg·次)(轻型),2~4 μg/(kg·次)(重型),2次/d,疗程3~7 d(A级);肌肉注射:1 μg/(kg·次)(轻型),2 μg/(kg·次)(重型),1次/d,疗程3~5 d(A级)。
选择恰当的抗病毒治疗时机对于儿童CHB的有效治疗非常关键。迄今为止,美国食品和药物管理局(FDA)只批准了IFN-α和4种核苷类似物用于治疗儿童CHB,其中只有IFN-α能使患儿在停药后仍能获得持续的应答反应,不会发生基因耐药,且适用年龄范围最广(12个月以上) [63]。当CHB患儿丙氨酸氨基转移酶(ALT)>60×103 IU/L或大于正常值上限的1.5倍,血清乙型肝炎病毒(HBV) DNA水平较高、肝组织学显示炎症坏死或中度以上纤维化的患儿,更需要及时有效地抗病毒治疗[64]。
对于乙型肝炎e抗原(HBeAg)阳性伴ALT水平升高的CHB患儿,IFN-α抗病毒治疗是首选方案[64],治疗24~36周后,患儿HBV DNA、HBeAg和乙型肝炎表面抗原(HBsAg)的阴转率分别可达到40%~60%、50%和10%,患儿ALT的复常率达80%~90%,且停药24周后各项指标也基本维持在结束治疗时的水平[65,66]。
对于HBeAg阴性、HBV DNA阳性且伴持续ALT升高的患儿,可参考成人诊治指南建议,考虑更长疗程的IFN-α抗病毒治疗[67]。对使用核苷类似物疗效不佳的患儿,可考虑换用或加用IFN-α治疗[68]。
推荐方案 IFN-α1b治疗CHB,肌肉注射:1~2 μg/(kg·次),3次/周,疗程24~48周;其中HBeAg阴性患儿可酌情延长疗程。如果治疗16~24周无效,建议停止治疗(C级)。
丙型肝炎病毒(HCV)慢性感染可导致患儿肝脏慢性炎症、坏死和纤维化。HCV RNA阳性,持续ALT升高和进展性肝纤维化被认为是抗病毒治疗的指征[69,70]。多项研究显示,HCV基因2型或3型患儿经IFN-α+利巴韦林治疗后的持续病毒学应答率(SVR)可高达80%,优于基因1型(40%~54%)[71,72];而低病毒载量(<4~8×108 IU/L)的SVR通常优于高病毒载量者[69]。IFN-α+利巴韦林抗病毒治疗的疗程与患儿治疗期间的病毒学反应及HCV基因型相关[69]。
推荐方案 使用IFN-α1b治疗CHC,肌肉注射:1~2 μg/(kg·次),3次/周,基因1型或4型治疗48周,2型或3型治疗24周。对发生快速病毒学应答(治疗4周时HCV RNA小于检测低限)且低病毒载量的患儿,基因1型或4型治疗24周,2型或3型治疗12~16周;对发生完全早期病毒学反应(治疗12周时HCV RNA小于检测低限)的患儿,治疗48周;发生部分早期病毒学反应(治疗24周时HCV RNA小于检测低限)的患儿,治疗72周;如果治疗24周HCV RNA仍为阳性,则应考虑终止治疗(C级)。
RV是引起儿童秋冬季腹泻的最常见病原,病毒一般局限在小肠绒毛上皮细胞内复制,造成小肠消化吸收功能障碍,临床出现呕吐、腹泻等症状,常并发脱水及电解质紊乱[73]。近年发现,RV可透过胃肠屏障引起病毒血症,导致全身多系统病变,如心肌损害、肝功能异常及中枢神经系统症状等[74]。
RV能通过NSP1蛋白抑制内源性IFN的产生[17],逃避机体免疫攻击。IFN-α在限制RV感染过程中起重要作用,体内IFN-α水平高的患儿临床症状消失相对较快[75]。及时给予外源性IFN,有助于抑制病毒复制,减轻症状,限制RV引起的肠道及全身感染[76]。对于诺如病毒引起的儿童秋冬腹泻及全身性感染,IFN-α也有类似的抑制病毒的作用[77,78]。
有多项临床研究表明,在病毒感染的急性期采用IFN进行抗病毒治疗,有利于减轻症状,缩短病程,减少并发症的发生[79,80,81]。一项多中心、随机对照临床研究表明,肌肉注射IFN-α1b,能有效缩短RV腹泻患儿的发热及腹泻时间,缩短病程,提高治愈率和病毒转阴率[7]。对于中、重型腹泻患儿,IFN-α1b也可缓解临床症状,缩短排毒时间,降低感染周围人群的风险,并有助于肝功能恢复[80,81]。
推荐方案 IFN-α1b治疗病毒性肠炎,肌肉注射:1 μg/(kg·次),1次/d,3~5 d(A级)。
病毒性脑炎是常见的儿童中枢神经系统感染性疾病,发病较急,治疗不及时可危及生命或发生后遗症。引起病毒性脑炎的病毒有100多种,常见的有虫媒病毒、肠道病毒、流行性腮腺炎病毒、单纯疱疹病毒(HSV)等,目前尚无特效治疗药物[82]。常规治疗联合IFN-α1b有助于缩短热程,促进头痛、呕吐及精神意识恢复,促进患儿脑脊液细胞数及蛋白水平恢复正常,并减少住院天数[61,83,84,85],但病毒性脑炎继发性癫 患儿应禁用。
患儿应禁用。
推荐方案 IFN-α1b治疗病毒性脑炎,肌肉注射:1 μg/(kg·次),1次/d,疗程3~5 d(B级)。
小儿IM是一种单核-巨噬细胞系统的急性感染性疾病,主要由EBV引起。典型临床表现为发热和淋巴结及肝脾大,轻者可自愈,严重者可因并发症而死亡[86]。
EBV的LF2蛋白可通过抑制IRF7作用,降低体内IFN-α的表达,进一步削弱儿童的抗病毒免疫反应[18,86]。肌肉注射IFN-α1b单用或联合更昔洛韦静脉滴注能有效缩短IM患儿的热程,缓解肝脾和淋巴结大,促进咽峡炎的愈合,缩短住院时间,提高治疗的总有效率,且疗效优于利巴韦林[87]。雾化吸入IFN-α1b也有助于改善IM患儿的体征,促进异常淋巴细胞的消失[88]。
推荐方案 IFN-α1b注射液治疗IM,肌肉注射:1~2 μg/(kg·次),1次/d,5~7 d(B级);雾化吸入:2~4 μg/(kg·次),2次/d,5~7 d(C级)。
依据目前的循证医学证据,IFN-α1b已在治疗多种儿科病毒感染疾病中取得良好效果,值得临床推广,但在2月龄以下婴儿的临床应用尚少,需进一步进行疗效与安全性的观察。
参与审定专家(按姓氏笔画排序):王大斌(湖北省十堰市太和医院儿童医疗中心);王纪文(山东大学齐鲁医院儿科);王明月(山东中医药大学第二附属医院儿科);王莹(武汉市妇女儿童医疗保健中心呼吸内科);王家勤(新乡医学院第三附属医院儿科);邓继岿(深圳市儿童医院感染科);邓慧玲(西安市儿童医院感染科);付四毛(中山市博爱医院儿科);付红敏(昆明医科大学附属儿童医院综合内科);包军(上海交通大学医学院附属新华医院小儿内科);叶乐平(温州医科大学附属第二医院小儿呼吸内科);刘钢(首都医科大学附属北京儿童医院感染内科);刘小红(西安交通大学第一附属医院儿科);安淑华(河北省儿童医院呼吸心内科);成焕吉(吉林大学第一医院儿内一科);朱晓萍(贵阳医学院附属医院儿科);李利(云南省第一人民医院昆华医院儿科);李岚(江西省儿童医院呼吸内科);李宇宁(兰州大学第一附属医院儿科);李兵飞(赣州市妇女儿童医院儿科);余静(绵阳中心医院小儿内科);张融(扬州市第一人民医院儿科);何少茹(广东省人民医院儿科);何念海(第三军医大学西南医院儿科);吴谨准(厦门大学附属第一医院儿内科);吴澄清(昆明医科大学附属儿童医院呼吸内科);陈必全(安徽省儿童医院感染科);陈继昌(广西省柳州市妇幼保健院新生儿科);周薇(北京大学第三医院儿科);武怡(徐州医学院附属医院儿科);范联(佛山市中医院儿科);郑铠军(中山市人民医院儿科);赵琳(昆明医科大学第二附属医院儿科);钟礼立(湖南省人民医院小儿呼吸科);唐建新(江西省萍乡市第二人民医院儿科);徐保平(首都医科大学附属北京儿童医院呼吸科);殷勇(上海交通大学医学院附属上海儿童医学中心呼吸科);曹玲(首都儿科研究所附属儿童医院呼吸内科);黄英(重庆医科大学附属儿童医院呼吸科);傅大干(成都军区昆明总医院儿科);葛秋生(北京大学深圳医院儿科);董湘玉(兰州大学第二医院儿童医院小儿心血管科)。


























