
探讨重症法洛四联症(TOF)体肺分流术后行二期根治手术的临床效果,总结重症TOF分期手术治疗的经验。
收集2010年12月至2015年6月12例重症TOF体肺分流术后行二期根治手术患儿。男8例,女4例;体肺分流术前平均年龄12.09个月(6个月~3岁);平均体质量8.59(8~10)kg。二期根治手术术前平均年龄33.82个月(1岁8个月~6岁),平均体质量13.24(9~18)kg。12例均采用二期手术:第一期为体-肺分流手术,第二期为TOF根治手术。
全组一期手术无死亡,二期根治手术术后死亡1例。12例患儿2次手术间隔时间平均为21.7个月。体肺分流术前动脉血氧饱和度为(68.34±7.14)%;肺动脉指数:左右肺动脉面积/体表面积(NAKATA)为(123.00±4.77) mm2/m2,左右肺动脉直径与降主动脉直径的比值(McGoon指数)0.99~1.37(1.19±0.25),左心室舒张末容积指数(LVEDVI)18.5~51.0(26.15±4.42)mL/m2。根治术前动脉血氧饱和度为(82.56±4.24)%;NAKATA(155.00±6.82)mm2/m2,McGoon指数1.22~2.05(1.62±0.36),LVEDVI 28.0~67.2(47.27±3.82)mL/m2。术后定期随访1~48个月,心功能恢复良好。
重症TOF分期手术效果良好,体肺分流手术可促进肺血管发育和左心室发育,一期术后应根据个体情况适时行二期根治手术。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
法洛四联症(TOF)是临床上最常见的发绀型先天性心脏病(先心病),占发绀型先心病的50%~90%[1,2]。随着近年来围手术期综合水平的提高,大多数可行根治手术,但对于重症TOF,因左心室较小和/或肺动脉发育差,需行分期手术达到最终治疗,其风险大,技术要求高,仍是目前临床的难点。本研究回顾性分析2010年12月至2015年6月12例重症TOF体肺分流手术后行二期根治术的临床资料,评价体肺分流术在重症TOF手术治疗中的应用,总结二期根治术的经验。
本组12例重症TOF体肺分流术后行二期根治手术。男8例,女4例;体肺分流术前平均年龄12.09个月(6个月~3岁);平均体质量8.59(8~10)kg。体肺分流术前动脉血氧饱和度(SpO2)为(68.34±7.14)%;肺动脉指数左右肺动脉面积/体表面积(NAKATA)(123.00±4.77)mm2/m2,左右肺动脉直径与降主动脉直径的比值(McGoon指数)0.99~1.37(1.19±0.25),左心室舒张末容积指数(LVEDVI)18.5~51.0(26.15±4.42) mL/m2。二期根治手术术前平均年龄33.82个月(1岁8个月~6岁);平均体质量13.24(9~18) kg。根治术前SpO2(82.56±4.24)%;肺动脉指数:NAKATA(155.00±6.82) mm2/m2,McGoon指数1.22~2.05(1.62±0.36),LVEDVI 28.0~67.2(47.27±3.82) mL/m2。患儿术前均行X线胸片、心电图、心脏超声及64排CT造影检查。明确诊断为TOF,合并卵圆孔未闭(PFO)5例,动脉导管未闭(PDA)3例,房间隔缺损(ASD)2例,体肺侧支5例。患儿一期手术前均有严重发绀症状,8例伴缺氧发作,活动后症状明显加重。本研究经医院医学伦理委员会批准,患儿家长均签署知情同意书。
12例患儿均采用二期手术,采用气管插管和静脉复合麻醉,经胸骨正中切口手术。第一期手术为体-肺分流手术,术中根据两侧肺动脉发育情况选择改良B-T分流、Central术或改良Waterson术,即用人工血管分别在锁骨下动脉与肺动脉之间、主动脉与肺动脉之间行端侧吻合。本组12例患儿中,改良B-T分流术4例,主动脉主肺分流术3例,主动脉右肺分流术5例。术中根据患儿年龄、体质量及肺血管发育情况选择人工分流管道直径。其中7例采用4 mm管道,5例采用5 mm管道。术后给予阿司匹林抗凝治疗。12例患儿第一期分流术后1岁8个月~6岁(平均年龄33.82个月)行二期根治手术。2次手术间隔时间平均为21.7个月。根治术均经升主动脉插管建立体外循环,先分离人工血管,体外循环开始前结扎人工血管。主动脉根部灌注冷晶体心肌保护液,采取右心房切口及右心室流出道纵切口,探查心内畸形,以Dacron涤纶补片修补室间隔缺损,其中嵴内型9例(平均14 mm);干下3例(平均10 mm)。术中切除异常肌束及部分肥厚之隔、壁束,彻底疏通流出道,根据肺动脉瓣环、肺总动脉及其分支发育情况,决定是否延长切口跨瓣环扩大至肺总动脉或肺动脉分支远端。本组7例应用牛心包补片加宽右心室流出道至主肺动脉,4例应用自体心包补片跨肺动脉瓣环扩大至主肺动脉,1例应用带瓣心包补片加宽右心室流出道跨肺动脉瓣环至左右肺动脉分处,合并其他心脏畸形,如PDA、PFO、ASD,同期一并修补。
应用SPSS 18.0软件进行统计分析,数据以 ±s表示,手术前后比较采用配对t检验,P<0.01为差异有统计学意义。
±s表示,手术前后比较采用配对t检验,P<0.01为差异有统计学意义。
全组一期体肺分流手术无死亡,早期分流失效1例,为4 mm人工管道,原因为血栓导致管道闭塞,经再次手术后好转。所有患者术后行二次根治手术。早期死亡1例,术后第3天死于低心排综合征,1例出现胸腔积液,经胸腔穿刺引流后好转,1例出现灌注肺,经调整呼吸机、改善心肺功能治疗后好转。全组体外循环时间130.86 (107~157) min,主动脉阻断时间67.29(54~87) min。术后呼吸机辅助时间15.12 h。12例患儿2次手术间隔时间平均为21.7个月。二期术后随访1~48个月,恢复良好,心功能Ⅰ级9例,Ⅱ级2例。体肺分流术前与二期根治术前SpO2、NAKATA指数、McGoon指数、LVEDVI相比较,差异有统计学意义(P<0.01),见表1。
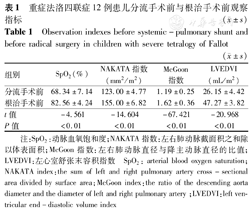
重症法洛四联症12例患儿分流手术前与根治手术前观察指标( ±s)
±s)
Observation indexes before systemic-pulmonary shunt and before radical surgery in children with severe tetralogy of Fallot( ±s)
±s)
重症法洛四联症12例患儿分流手术前与根治手术前观察指标( ±s)
±s)
Observation indexes before systemic-pulmonary shunt and before radical surgery in children with severe tetralogy of Fallot( ±s)
±s)
| 组别 | SpO2(%) | NAKATA指数(mm2/m2) | McGoon指数 | LVEDVI (mL/m2) |
|---|---|---|---|---|
| 分流手术前 | 68.34±7.14 | 123.00±4.77 | 1.19±0.25 | 26.15±4.42 |
| 根治手术前 | 82.56±4.24 | 155.00±6.82 | 1.62±0.36 | 47.27±3.82 |
| t值 | -4.561 | -14.604 | -67.421 | -20.968 |
| P值 | <0.01 | <0.01 | <0.01 | <0.01 |
注:SpO2:动脉血氧饱和度;NAKATA指数:左右肺动脉截面积之和除以体表面积;McGoon指数:左右肺动脉直径与降主动脉直径的比值;LVEDVI:左心室舒张末容积指数 SpO2: arterial blood oxygen saturation;NAKATA index:the sum of left and right pulmonary artery cross-sectional area divided by surface area;McGoon index:the ratio of the descending aorta diameter and the diameter of left and right pulmonary artery ;LVEDVI:left ventricular end-diastolic volume index
TOF由于肺动脉及其分支发育差(NAKATA<150 mm2/m2或McGoon指数<1.2)和/或左心室小(LVEDVI<30 mL/m2),无法进行一期根治手术,需先行分流手术,使其肺血流量增加,促进肺动脉和左心室发育,临床症状改善,为后期二次手术创造条件[3,4]。如何提高婴幼儿重症TOF围手术期的存活率,减少手术并发症,选择合适的二期根治手术的时机成为当前重症TOF外科治疗研究领域中的难题和紧迫任务。
体肺分流术是增加肺血流的姑息手术,主要应用于肺动脉发育不良的复杂先心病,促进肺动脉和左心室发育,临床症状得以改善,为后期二次根治手术创造条件。国内外研究发现体肺动脉分流术后早期严重并发症的发生率相对较高,基本维持在2.0%~14.1%[5,6,7]。分析原因有以下几个方面:(1)体肺动脉分流手术通过人工血管建立体循环和肺循环的连接,属于非生理型,从血流动力学考虑,相对不稳定的影响因素较多。(2)分流手术关胸后人工血管可能发生扭曲、移位,导致术后管道栓塞。(3)分流手术所采用的材料多为Gore-Tex人工血管,其质地偏硬,易产生溶血,且术后需恰当的抗凝治疗,防止分流管道发生栓塞。(4)体肺分流术的应用逐渐向危重化、复杂化、低龄化发展。本组12例重症TOF在常温下经胸骨正中切口手术,术中根据两侧肺动脉发育情况行体肺分流术,其中改良B-T分流术4例,主动脉主肺分流术3例,主动脉右肺分流术5例。术中为减少纵隔粘连及二次开胸风险,术毕均在心脏表面放置防粘连材料。手术顺利,术后无死亡。研究显示,体肺分流术可增加肺部血流灌注,增加氧合血量,促进肺动脉及左心室的进一步发育,为二期根治手术提供条件。术中心功能维护,分流血管是否通畅及分流量大小是影响手术效果的关键因素。SpO2是评估分流量大小的有用指标[8],手术的理想值为75%~85%。分流失效是体肺分流术后严重并发症,是影响术后早期死亡和中长期效果的重要因素。据国内外研究低龄、低体质量和肺动脉细小是影响术后早期分流管道栓塞的危险因素。而分流管道直径<4 mm、年龄小、术前高红细胞压积、采用体外循环手术和术后应用血小板是术后管道栓塞的危险因素[9,10,11]。本组早期分流失效1例,为4 mm人工管道,原因为血栓导致管道闭塞,经再次手术后好转。临床体会术后尤其应该注意SpO2变化,一旦发现SpO2明显下降,听诊右侧或左侧第2肋间连续性杂音消失,首先考虑人工血管闭塞或扭曲,需立即手术更换人工血管,同时术后合理抗凝治疗。
TOF二期根治手术的术前评估对选择手术方式至关重要。主要关注肺动脉及其分支的发育情况,左心室舒张末期容量指数和冠状动脉分布及走形。手术方法主要取决于肺动脉的发育、右心室漏斗部的病理变化,尤其是肺动脉瓣环的发育[12,13]。如何妥善解除右心室流出道阻塞,选择合适的跨瓣环右心室补片是减少手术死亡率和提高治疗效果的关键。对于TOF的手术策略一直是人们关注的重点,既往根治手术的适应证:LVEDVI≥30 mL/m2, McGoon比值>1.2,NAKATA>150 mm2/m2。随着技术水平的提高,LVEDVI<30 mL/m2不再是TOF根治手术禁忌。临床体会TOF患者只要肺动脉发育良好,左心室不太小也可以考虑根治术。此类TOF根治术应用左心室扩大技术,手术效果良好,但必须有足够的技术支持[14]。本组12例患者分流术后均行根治手术,其中LVEDVI<30 mL/m2有1例,为28 mL/m2,根治术后心功能恢复良好。其次值得注意的是对于TOF根治手术,采用何种分流手术与二期根治手术有密切关系。改良B-T术后血流在左右肺动脉分布不均,导致左右肺动脉发育不一致。中心分流术经常导致吻合困难,阻断时间长,易出血和形成血栓。因此术前明确诊断,术中根据患者肺血管发育情况选择合适的改良术式是手术成功的关键。本组7例应用牛心包补片加宽右心室流出道至主肺动脉,4例应用自体心包补片扩大至主肺动脉,1例应用带瓣心包补片加宽右心室流出道跨肺动脉瓣环至左右肺动脉分处,合并其他心脏畸形同期一并修补。另外,为减少纵隔粘连及二次开胸手术出血的风险,一期手术时均采用胸骨正中切口,尽量保留胸腺,同时放置防粘连材料;二次开胸时应尽量避免心脏及血管损伤,一旦出现大出血,应尽早肝素化并血液回收,同时行股动脉插管提高手术成功率。术后予以呼吸机辅助呼吸,适当给予肌松、镇静,根据情况给予多巴胺、肾上腺素、米力农等改善心功能,维持心率血压的稳定。本组术后死亡1例,死于低心排综合征,分析原因与心功能差有关。
理想的二期手术时机的选择是目前重症TOF体肺分流术后远期随访关注的重点。对于二期手术的时机选择,目前一直存在较大争论[15]。本组2次手术间隔时间平均为21.7个月。存活患者根治术后定期复查,恢复良好。一期分流手术后要加强随访,定期复查,以便更好地把握二期根治手术的时机。
综上所述,重症TOF行体肺分流姑息手术,操作简单、安全可靠,可促进肺动脉和/或左心室的发育,改善患者缺氧状态,为二期根治手术提供良好基础。同时体肺分流术后应加强随访,根据个体情况制定二期根治手术治疗方案。但由于本研究例数有限,时间又相对较短,仍需进一步观察。



























