
研究儿童非横纹肌软组织肉瘤(NRSTS)的临床特点、预后状况、生存影响因素及治疗策略。
北京大学肿瘤医院骨与软组织肿瘤科2007年7月至2015年3月共收治34例NRSTS患儿,回顾性研究患儿临床与病理资料、手术与放化疗综合治疗结果,并分析生存影响因素。
本组男21例,女13例;年龄7~18岁,中位年龄14岁。肿瘤最大径0.5~22.0 cm,平均值5.0 cm,中位值3.0 cm。由9种不同的组织学亚型组成,以滑膜肉瘤最多[29.4%(10/34例)]。部位以四肢最多[67.6%(23/34例)],其中下肢占50.0%(17/34例)。美国横纹肌肉瘤协作组(IRS)分组:Ⅰ组28例,Ⅱ、Ⅲ、Ⅳ组各2例;美国儿童肿瘤协作组(COG)危险分层:低危组23例,中危组7例,高危组4例。随访时间6~96个月,中位随访时间35个月。术后发生复发2例,远处转移1例,淋巴结与远处转移2例,复发与远处转移1例,死亡3例。34例患儿2年总生存率为89.2%,低危组为100.0%,中高危组为70.0%。其中28例无淋巴结及远处转移患儿,术后2年局部无复发生存率及无远处转移生存率分别为96.4%、87.6%。分析生存影响因素,发现IRS分组、COG危险分层、肿瘤大小与预后相关。能够完整手术切除(P=0.007)、低度危险(P=0.014)、≤5.0 cm(P=0.037)的肿瘤具有更好的生存预期。治疗:单纯手术14例,手术加化疗10例,手术加放化疗4例,手术加放疗2例,单纯放化疗2例,单纯化疗2例。化疗方案主要(17/18例)采用蒽环类药+异环磷酰胺方案(吡柔比星:40 mg/m2,异环磷酰胺:10 g/m2),每例总化疗2~12周期,平均4.6个周期。
NRSTS患儿在手术、放疗及基于葸环类药物+异环磷酰胺联合化疗的综合治疗后,可取得较好结果。本研究首次采用COG分层研究儿童NRSTS,并证实实肿瘤大小与COG危险度分层是重要的生存影响因素。应该依据NRSTS危险度评估预后,并设计综合治疗策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
儿童软组织肉瘤是儿童恶性间叶来源实体性肿瘤,占全部恶性肿瘤的8%[1],按美国NCI癌症监测网评估,20岁以下青少年每年发病率为11.0人/100万[2],按美国儿童肿瘤协作组(Children's Oncology Group,COG)评估,儿童每年新发病850~900例[3]。软组织肉瘤大体上分为横纹肌肉瘤(RMS)与非横纹肌肉瘤(NRSTS),二者约各占50%。相对于成人同样的组织学类型,儿童软组织肉瘤的恶性程度与预后优于成人,低危险组的5年生存率可达90%,而肿瘤转移人群经过综合治疗,5年生存率仍仅有15%,中高危人群仍是目前的治疗难点[3]。在过去数十年间,RMS的5年生存率有了极大改善[3]。随着近年综合治疗的强调与开展,NRSTS疗效有了进一步改善,但限于更为有限的样本与证据,评估与治疗方面尚有不少争议[2]。参照美国NRSTS发病数据[1,2,3]及中国儿童人口基数估算,我国每年新发患儿达1 500~2 000例,仍需要引起足够重视。本研究回顾单中心近期(8年内)的NRSTS病例,了解基于手术、放疗及美司钠+葸环类药物+异环磷酰胺(MAI)联合方案化疗的综合治疗结果及影响因素,与当前欧美主要研究系列进行比照,并率先引入最新的COG危险性分层系统,验证其在国内NRSTS预后评估中的有效性,指导综合治疗策略。
由北京大学肿瘤医院医学统计室通过查阅住院手术患者数据库,确定2007年7月至2015年3月在骨与软组织肿瘤科治疗的儿童软组织肉瘤患者(年龄18岁以下且随访时间>6个月的患者)及其中NRSTS患者(除去诊断RMS者)数量,并调阅相关病历资料,确定以下信息:患儿及家长联系方式、基本临床信息、术前病理及诊断(包括病理会诊)、术前全身评估结果、术前及术后放化疗情况(包括方式、用药与剂量)、手术情况、术后病理诊断及切缘情况、术后门诊检查结果。通过病历查阅(包括外院手术记录与检查报告的复印件)及补充询问既往病史,包括外院病理诊断、手术或放化疗的详细情况。淋巴结及远处转移的判断由临床特征、影像学改变及病理学证据综合决定。
重新复阅全部患儿的病理染色切片,确定软组织肉瘤及亚型诊断、切缘情况(R0/R1)、淋巴结转移情况、有丝分裂计数、COG组织学分级(高级别与低级别)。其中仅作过术前病理会诊者,重新借阅原单位切片。全过程由指定的一名软组织肉瘤病理专业主任医院负责,诊断均参照WHO 2013版软组织肉瘤分类标准的相关部分,组织学分级参照COG推荐的标准[4]。
IRS分组参照美国横纹肌肉瘤协作组标准[3]:Ⅰ 组是肿瘤局限、镜下切缘阴性,Ⅱ 组为镜下切缘阳性或有区域淋巴结转移但获得完整切除,Ⅲ 组为肿瘤局限无法完整切除或仅作活检,Ⅳ 组为有远处转移的肿瘤。NRSTS危险性分层参照美国COG指南推荐标准[3]:所有低级别肉瘤或≤5.0 cm的高级别肉瘤属低危险度,>5.0 cm的高级别肉瘤或未(肉眼)完整切除者属中危险度,确诊时发生区域淋巴结或远处转移者属高危险度。
根据IRS分组及COG危险性分层等预后评估,采用手术(肿瘤或瘤床扩大切除)、放疗和化疗综合治疗。放疗采用普通或适形调强外照射方式,剂量50~60 Gy,均为术后放疗。对于高度敏感、瘤体较大及切除困难的实体瘤,加用术前新辅助化疗,其余为术后辅助或姑息化疗。化疗以单纯使用MAI方案为主,少部分加达卡巴嗪或长春新碱,或与吉西他滨+多西他赛方案(GD方案)交替。吡柔比星用量40 mg/m2,异环磷酰胺用量10 g/m2,常规美司钠解毒。
采用门诊随访。根据术后时间不同,每3~6个月门诊(北京大学肿瘤医院或当地)复查1次,包括查体、术区超声或MRI、浅表淋巴结超声及肺部X线摄片或CT,必要时行全身骨扫描、头颅及腹盆腔CT。记录每例患者随访截止时间及之前有无事件(复发、转移或死亡)发生及时间。
应用SPSS 16.0软件进行统计分析,应用Kaplan-Meier生存曲线进行局部无复发生存率(LRFS)、无远处转移生存率(DRFS)和总生存率(OS)的生存分析,单因素分析应用 Log-rank 检验,比较不同组间差异。双侧检验,检验水准α=0.05。
2007年7月至2015年3月共收治软组织肉瘤687例。其中儿童软组织肉瘤46例,失访5例,41例中除去7例为RMS,共有NRSTS患儿34例。其中男21例,女13例;年龄7~18岁,中位年龄14岁。肿瘤最大径0.5~22.0 cm,平均值5.0 cm,中位值3.0 cm。发病部位为四肢23例(67.6%),其中下肢17例[50.0%(17/34例)],上肢6例[17.6%(6/34例)];躯干11例,其中胸腹壁7例,头颈2例,腹膜后1例,后纵隔1例。原发肉瘤24例,复发肉瘤10例;实体瘤17例,瘤床17例。
滑膜肉瘤10例(29.4%),隆突性皮肤纤维肉瘤8例,Ewing肉瘤/原始神经外胚层肿瘤(PNET) 6例,腺泡状软组织肉瘤4例,脂肪肉瘤2例,血管肉瘤、血管内皮细胞瘤、纤维肉瘤、纤维黏液肉瘤各1例。就诊时肿瘤局限30例,淋巴结转移2例,远处转移1例,淋巴结及远处转移1例。IRS分组:Ⅰ 组28例,Ⅱ、Ⅲ、Ⅳ组各2例;COG危险度分组:低危组23例,中危组7例,高危组4例。
手术共30例,其中16例瘤床补充扩切术,14例实体瘤扩切术(其中1例连同转移淋巴结扩切,1例连同转移淋巴结及肺转移灶扩切)。单纯手术14例,手术加化疗10例,手术加放化疗4例,手术加放疗2例,单纯放化疗2例,单纯化疗2例。18例化疗,除1例采用GD方案外,其余17例采用以MAI为主的方案,MAI方案总周期数每例2~12个,不低于4个周期者13例,平均4.6个周期。其中新辅助化疗加辅助化疗8例,辅助化疗5例,姑息化疗4例,新辅助化疗1例。
随访时间6~96个月,中位随访时间35个月,平均随访时间34.8个月。术后复发2例,远处转移1例,淋巴结转移合并远处转移2例,复发并远处转移1例,死亡3例。平均复发时间17.5个月,淋巴结转移时间18个月,远处转移时间13个月,死亡时间14.7个月。2年OS全组为89.2%,低危组为100.0%,中高危组为70.0%。其中28例无淋巴结或远处转移(NOMO)患者,术后2年LRFS及DRFS分别为96.4%、87.6%。
因总例数与生存事件数量较少,多因素分析的统计效力有较大偏差,故仅采用Log-rank检验行单因素分析。各预后因素影响结果显示,IRS分组、COG危险度分层、肿瘤大小与预后相关,完整手术切除(2年OS 0.96比0.50,P=0.007)、低度危险(2年OS 1.00比0.70,P=0.014)、≤5.0 cm(2年OS 1.00比0.75,P=0.037)的肿瘤具有更好生存预期,其他各个组间2年OS比较差异均无统计学意义,见表1及图1,图2,图3。
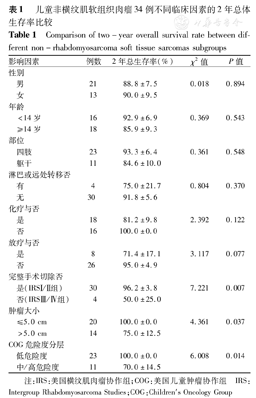
儿童非横纹肌软组织肉瘤34例不同临床因素的2年总体生存率比较
Comparison of two-year overall survival rate between different non-rhabdomyosarcoma soft tissue sarcomas subgroups
儿童非横纹肌软组织肉瘤34例不同临床因素的2年总体生存率比较
Comparison of two-year overall survival rate between different non-rhabdomyosarcoma soft tissue sarcomas subgroups
| 影响因素 | 例数 | 2年总生存率(%) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 男 | 21 | 88.8±7.5 | 0.018 | 0.894 | |
| 女 | 13 | 90.0±9.5 | |||
| 年龄 | |||||
| <14岁 | 16 | 92.9±6.9 | 0.369 | 0.543 | |
| ≥14岁 | 18 | 85.9±9.3 | |||
| 部位 | |||||
| 四肢 | 23 | 93.3±6.4 | 0.361 | 0.548 | |
| 躯干 | 11 | 84.6±10.0 | |||
| 淋巴或远处转移否 | |||||
| 有 | 4 | 75.0±21.7 | 0.804 | 0.370 | |
| 无 | 30 | 91.8±5.6 | |||
| 化疗与否 | |||||
| 是 | 18 | 81.2±9.8 | 2.392 | 0.122 | |
| 否 | 16 | 100.0±0.0 | |||
| 放疗与否 | |||||
| 是 | 8 | 71.4±17.1 | 3.117 | 0.077 | |
| 否 | 26 | 95.0±4.9 | |||
| 完整手术切除否 | |||||
| 是(IRSⅠ/Ⅱ组) | 30 | 96.2±3.8 | 7.221 | 0.007 | |
| 否(IRSⅢ/Ⅳ组) | 4 | 50.0±25.0 | |||
| 肿瘤大小 | |||||
| ≤5.0 cm | 20 | 100.0±0.0 | 4.361 | 0.037 | |
| >5.0 cm | 14 | 75.0±12.5 | |||
| COG危险度分层 | |||||
| 低危险度 | 23 | 100.0±0.0 | 6.008 | 0.014 | |
| 中/高危险度 | 11 | 70.0±14.5 | |||
注:IRS:美国横纹肌肉瘤协作组;COG:美国儿童肿瘤协作组 IRS:Intergroup Rhabdomyosarcoma Studies;COG:Children's Oncology Group
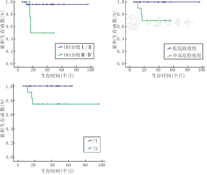

注:IRS:美国横纹肌肉瘤协作组IRS:Intergroup Rhabdomyosarcoma Study
儿童NRSTS总体发病率低,不像RMS相对集中在一些专业治疗中心,在国内综合医院往往分散在不同专科,难以引起足够的重视。即使在儿童医院或肿瘤医院中,也通常缺少专门的诊治单元。造成了有限病例的相对分散,加上诊治具有相当的难度,导致系统性研究与报道较稀少。除早年个别的小样本报道[5,6],仅见李璋琳等[7]的一组67例报道(研究涉及1989年至2002年间)。本组滑膜肉瘤10例,占29.4%,是最多的亚型,与其他文献[7,8,9,10,11]报道结果一致,其中Casanova等[8]报道达到36.2%。Hayes-Jordan[1]认为滑膜肉瘤占NRSTS的35%。
在儿童NRSTS的主要系列中,李璋琳等[7]的67例,中位随访时间49个月,2年OS为70.1%,其中IRS Ⅰ/Ⅱ组仅占58.2%(39/67例),显示未完整切除的病例较多。Casanova等[8]的143例四肢本病患者(排除9例PNET),中位随访时间118个月,5年OS为84.2%,5年LRFS及DRFS分别为85.7%、77.5%,其中IRSⅠ/Ⅱ组占81.8%(117/143)。Waxweiler等[9]报道的941例患儿,中位随访时间85.2个月,危险度明确者490例(均随访3年以上),COG低危险组占60.4%(296/490例),2年OS全组为84.5%(414/490例),低危组为96.3%(285/296例),中高危组为66.5%(129/194例)。而基于St.Jude儿童医院NRSTS经验,COG低危组所占比例与5年OS分别为60%、90%[3]。与以上主要系列比较,本组34例儿童NRSTS综合治疗结果较好,在国内首次报道OS、分层占比及生存率均接近当前欧美核心文献的数据。本组中位随访时间35个月,其中IRS Ⅰ/Ⅱ组占88.2%(30/34例),COG低危险组占67.6%(23/34例),2年OS全组为89.2%,低危组为100.0%,中高危组为70.0%。其中28例NOMO患者,术后2年LRFS及DRFS分别为96.4%、87.6%。
NRSTS的治疗基础是生存预后的危险性分层。目前可参考的传统外科病理分组[8],最早在研究儿童RMS时提出,也称IRS分组,主要是按照手术与病理所指示的切除范围来分组,因该系统不能反映肿瘤大小与分级因素的影响[2],在更多的病例分析基础上,美国COG提出最新的危险性分层方案[3]:作为完整切除的IRS Ⅰ/Ⅱ组中需要排除>5.0 cm的高级别肉瘤以及淋巴结转移的患者(分别划入中、高危险分层),作为低危险分层,其余为中度或高度危险性,分别包括>5.0 cm的高级别肉瘤或未(肉眼)完整切除的,以及确诊时发生区域淋巴结转移或远处转移者。传统的POG3级分级[12]也改良为2级,除特定亚型直接指定,其他肉瘤均按照每10个高倍镜视野是否>10个有丝分裂计数,分别划为高或低级别。按这一分层系统的研究,低、中、高危险组的比例分别是60%、30%、10%,其5年生存率分别是90%、50%、15%。Waxweiler等[9]基于美国NCI最近20年的大宗NRSTS数据,首次证实了这一分层系统的可靠性。
本研究证实IRS分组是总生存的预后影响因素,肿瘤是否完整切除(即IRS的Ⅰ/Ⅱ或Ⅲ/Ⅳ组)显著影响患儿2年OS(96.2% 比50.0%,P=0.007)。国内外一些NRSTS研究也采用了IRS分组研究,李璋琳等[7]报道肿瘤是否完整切除组2年OS差异显著,Casanova等[8,13]研究也显示类似的显著差异。以上结果均证实能否完整切除对于NRSTS的预后至关重要。为克服IRS分组的局限性,更细致准确地评估生存危险度,本研究首次在国内NRSTS系列中引入COG危险分层系统,将是否完整切除的界限做了新的调整后,依然能显示出界限两侧(即低危险组与中高危险组)的显著差别(2年OS 1.00比0.70,P=0.014),证明这一调整与分层设置的合理性,即组织学分级、大小及淋巴结转移的预后作用。但这一评估系统仍存缺陷:部分病例因为术前仅做了穿刺活检或外院病理会诊,而术后病理存在放化疗等新辅助治疗的影响,均无法准确计数有丝分裂,加之本组例数有限,使组织学分级难以确定。这导致>5.0 cm的肉瘤可能无法明确为低或中危险度。由于同类原因,Waxweiler等[9]的941例研究中,组织学无法分级的患者有449例(47.7%)。因此,可能需要研究更为简便的参考因子,以提高组织学分级的可操作性。
在多个学者的NRSTS回顾性研究中,虽然其他因素有所不同,但均显示肿瘤>5.0 cm是生存预后更差的影响因素[8,13,14,15]。本研究结果与国际主要报道一致,首次在国内儿童NRSTS中证实,肿瘤大小同样是重要的预后因素(2年OS 1.00比0.75,P=0.037)。由COG推荐的NRSTS危险性分层系统[3],基于大宗病例分析,也采取了类似AJCC成人肉瘤分期系统,将大小与分级相结合,可以更加准确评估预后。
有学者通过统计学手段构建了预测成年肉瘤患者具体预后的列线图[16],其有效性已被其他研究证实[17]。Ferrari等[18]首次尝试将此列线图用于112例儿童NRSTS, 发现10年实际病死率(29%)与预测死亡率(16%)存在较大差异,主要是由于肿瘤大小在儿童预后中权重的增加。研究发现这与儿童更小的体表面积相关[19],有作者提出,儿童NRSTS评估中的临界值5.0 cm,可能需要调低才更加合理[1]。
NRSTS的治疗策略应基于生存预后的危险性分层,这已经被大宗病例研究所证实[3,9]。按COG对NRSTS给出的治疗推荐[3],低危险组仅需根治性切除,仅高级别或切缘不足而无法再手术者,需要辅助放疗。中危险组,无论是否完整切除,均需要加辅助放疗及化疗。高危险组,以放疗及化疗为基本治疗,但伴淋巴结转移者应争取手术切除病灶,低度恶性伴转移灶,仅需彻底切除全部病灶。根治性切除需要至少包括1 cm正常组织的切缘。本组34例中17例先在外院局部切除,显示儿童NRSTS较高的误诊误治率,与Casanova等[8]的结果一致。本组17例中除1例腹膜后肉瘤,16例入院后做了瘤床补充扩大切除。目前学者普遍认为,对于非计划手术,首选治疗是再手术而非局部放疗,以保证阴性切缘[2,8,9]。与成人患者一样,放化疗对NRSTS的具体作用仍有待明确[2,9,20],目前推荐指征主要针对肉瘤再发及死亡风险,并可能使肿瘤由不可切除成为可切除,从而改善预后[14]。具体组织学类型也需要考虑。PNET对化疗高度敏感,无论危险性高低,(新)辅助化疗已经成为标准治疗。在中高危险组,滑膜肉瘤是目前除了PNET之外,唯一常规行(新)辅助化疗的疾病[1,21]。尽管腺泡状软组织肉瘤、透明细胞肉瘤等均属于高度危险,因为高度不敏感,故不推荐化疗。化疗的首选方案是MAI[2,3]。本组除去共10例PNET及腺泡状软组织肉瘤,低危组化疗率27.8%(5/18例),其中3例为滑膜肉瘤,中高危组化疗率100.0%(6/6例)。所有18例化疗,采用MAI方案占94.4%(17/18例)。其中,PNET 100.0%化疗(6/6例),滑膜肉瘤70.0 %(7/10例)化疗,腺泡状软组织肉瘤仅25.0%(1/4例)化疗。
综上,本研究发现儿童NRSTS在手术、放疗及基于MAI方案的联合化疗综合治疗后,可取得较好结果,与当前欧美主要文献报道的生存数据近似。本研究首次采用COG危险度分层研究国内儿童NRSTS,并证实肿瘤大小与COG危险度分层是重要的生存影响因素。今后应该依据NRSTS危险度评估预后,并设计综合治疗策略。



























