
探讨布地奈德联合猪肺磷脂注射液(肺泡表面活性物质,PS)预防早产儿支气管肺发育不良(BPD)的效果。
选取2013年10月至2015年2月于出生6 h内在西南医科大学附属医院新生儿科住院治疗的早产儿120例,胎龄≤32周,出生体质量≤1 500 g,分为4组,每组30例,分别为A组:对照组;B组:新生儿呼吸窘迫综合征(NRDS)组;C组:NRDS+PS组;D组:NRDS+PS+布地奈德组。A组除早产外无其他特殊疾病,且出生48 h内未吸氧;B组持续无创呼吸机辅助通气(吸氧持续时间≥48 h,吸氧体积分数≥400 mL/L);C组在B组基础上在出生6 h内予气管插管滴入PS 100 mg/kg;D组在C组基础上再滴入吸入用布地奈德混悬液0.25 mg/kg。观察用药前后血气分析中pH、动脉血氧分压[pa(O2)]、动脉血二氧化碳分压[pa(CO2)]情况,是否改为有创呼吸机辅助通气,高氧使用持续时间,总吸氧时间,再次使用PS率,BPD发生率及总住院天数。并观察各组不良反应:高血压、高血糖、坏死性小肠结肠炎及院内感染发生率。
C组与B组比较,用药后1、6 h pH,1、6、12 h pa(O2)及pa(CO2)值明显改善,差异均有统计学意义(P均<0.01);D组与B组比较,以上指标改善更明显,差异均有统计学意义(P均<0.01);与B组比较,其余3组高氧持续时间、总吸氧时间、改为有创呼吸率、再次使用PS率及BPD发生率均明显减少,差异均有统计学意义(P均<0.05);C、D组BPD发生率比较差异有统计学意义(10.00%比3.33%,χ2=4.00,P=0.046);各组间总住院天数及不良反应发生率比较差异均无统计学意义(P均>0.05)。
布地奈德联合猪肺磷脂注射液能够有效预防BPD的发生,且优于单纯使用猪肺磷脂注射液,不良反应发生率未见明显增加。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着医疗技术水平的不断提高,早产儿的存活率也明显增加,但与此同时,支气管肺发育不良(BPD)、视网膜病变、神经系统发育异常等疾病的发生率也逐渐增加[1,2,3]。国内外目前尚无系统的规范防治BPD的方法,现主要有氧疗、肺泡表面活性物质(PS)替代治疗、一氧化氮、糖皮质激素(GC)、咖啡因、维生素A、支气管扩张剂、利尿剂、抗生素等治疗[4,5,6]。其中通过使用PS预防和治疗新生儿呼吸窘迫综合征(NRDS)从而预防BPD是目前公认的最主要的方法之一。GC对BPD的预防作用也被许多临床实验证明是有效的,但早期全身应用GC不良反应多[7]。布地奈德是吸入性GC,学者认为同其他GC一样,同样具有预防BPD的作用[8]。目前国内外对于布地奈德联合PS预防BPD的疗效研究较少,Yeh等[9]提出反复多次气管插管内滴入布地奈德联合PS能够减少极低体质量儿BPD的发生,其所研究的患儿为体质量小于1 500 g,确诊有NRDS且吸入氧体积分数(FiO2)>600 mL/L的患儿。本研究结合西南医科大学附属医院患儿病情及经济情况,予早期一次性气管内滴入布地奈德联合猪肺磷脂注射液(一种天然PS),探讨其对BPD预防的有效性,观察其相关不良反应发生率,为BPD的防治提供新的靶点。
选取2013年10月至2015年2月于出生6 h内在西南医科大学附属医院新生儿科住院治疗的早产儿120例,男68例,女52例;胎龄27+2~32周[(30.0±2.3)周];出生体质量890~1 500 g[(1 352±125) g];出生10 min Apgar评分(8.21±1.46)分。分为4组,每组30例:A组:对照组;B组:NRDS组;C组:NRDS+PS组;D组:NRDS+PS+布地奈德组。其中诊断为NRDS的患儿均符合第4版《实用新生儿学》 NRDS诊断标准[10]。4组患儿之间性别、胎龄、出生体质量及出生10 min Apgar评分比较差异均无统计学意义(P均>0.05)。本研究通过西南医科大学附属第一医院医学伦理委员会的批准,所有患儿家长同意并签署知情同意书。
A组除早产外无其他特殊疾病,且出生48 h内未吸氧;B组持续无创呼吸机辅助通气,吸氧持续时间≥48 h,FiO2≥40%;在B组基础上,C组出生6 h内予气管插管滴入猪肺磷脂注射液(意大利凯西制药公司生产,规格1.5 mL:120 mg,产品批号1024296)100 mg/kg;D组在C组基础上再滴入吸入用布地奈德混悬液(AstraZeneca Pty Ltd生产,规格2 mL:1 mg,产品批号LOT315393) 0.25 mg/kg[9,11,12]。
观察用药前,用药后1、6、12、24及48 h的血气分析中pH、动脉血氧分压[pa(O2)]、动脉血二氧化碳分压[pa(CO2)]改变情况;是否改为有创呼吸机辅助通气;高氧使用持续时间;总吸氧时间;再次使用PS率;BPD发生率;患儿总住院时间。并且观察高血压、高血糖、坏死性小肠结肠炎(NEC)及院内感染发生率。
任何氧依赖(FiO2>210 mL/L)>28 d的新生儿可诊断为该病[13]。所有患儿随访至纠正胎龄36周。
采用SPSS 17.0软件进行统计分析。计量资料以 ±s表示,组间比较采用方差分析;计数资料用率表示,采用χ2检验,P<0.05为差异有统计学意义。
±s表示,组间比较采用方差分析;计数资料用率表示,采用χ2检验,P<0.05为差异有统计学意义。
C组及D组分别与B组(NRDS组)比较,在用药后1、6 h pH值均明显升高,且D组升高更早更明显,差异均有统计学意义(P均<0.01),见表1。
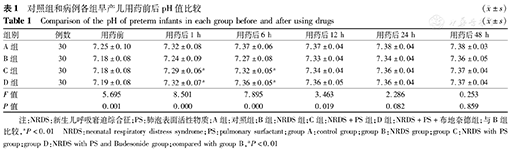
对照组和病例各组早产儿用药前后pH值比较( ±s)
±s)
Comparison of the pH of preterm infants in each group before and after using drugs( ±s)
±s)
对照组和病例各组早产儿用药前后pH值比较( ±s)
±s)
Comparison of the pH of preterm infants in each group before and after using drugs( ±s)
±s)
| 组别 | 例数 | 用药前 | 用药后1 h | 用药后6 h | 用药后12 h | 用药后24 h | 用药后48 h |
|---|---|---|---|---|---|---|---|
| A组 | 30 | 7.25±0.10 | 7.32±0.08 | 7.37±0.06 | 7.37±0.04 | 7.38±0.04 | 7.38±0.03 |
| B组 | 30 | 7.18±0.08 | 7.24±0.09 | 7.27±0.08 | 7.33±0.04 | 7.34±0.04 | 7.36±0.05 |
| C组 | 30 | 7.18±0.08 | 7.29±0.06a | 7.32±0.05a | 7.34±0.04 | 7.36±0.04 | 7.37±0.04 |
| D组 | 30 | 7.19±0.08 | 7.32±0.07a | 7.36±0.05a | 7.36±0.05 | 7.36±0.04 | 7.37±0.04 |
| F值 | 5.695 | 8.501 | 7.895 | 3.463 | 2.286 | 0.253 | |
| P值 | 0.001 | 0.000 | 0.000 | 0.019 | 0.082 | 0.859 |
注:NRDS:新生儿呼吸窘迫综合征;PS:肺泡表面活性物质;A组:对照组;B组:NRDS组;C组:NRDS+PS组;D组:NRDS+PS+布地奈德组;与B组比较,aP<0.01 NRDS:neonatal respiratory distress syndrome;PS:pulmonary surfactant;group A:control group;group B:NRDS group;group C:NRDS with PS group;group D:NRDS with PS and Budesonide group;compared with group B,aP<0.01
C组及D组分别与B组相比,在用药后1、6、12 h pa(O2)均明显升高,且D组升高更早更明显,差异均有统计学意义(P均<0.01),见表2。
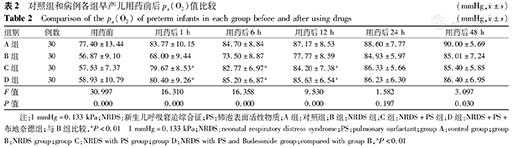
对照组和病例各组早产儿用药前后pa(O2)值比较(mmHg, ±s)
±s)
Comparison of the pa(O2) of preterm infants in each group before and after using drugs(mmHg, ±s)
±s)
对照组和病例各组早产儿用药前后pa(O2)值比较(mmHg, ±s)
±s)
Comparison of the pa(O2) of preterm infants in each group before and after using drugs(mmHg, ±s)
±s)
| 组别 | 例数 | 用药前 | 用药后1 h | 用药后6 h | 用药后12 h | 用药后24 h | 用药后48 h |
|---|---|---|---|---|---|---|---|
| A组 | 30 | 77.40±13.44 | 83.77±10.15 | 84.70±8.84 | 87.17±8.53 | 88.60±7.77 | 90.00±5.69 |
| B组 | 30 | 56.87±9.10 | 68.00±9.44 | 73.50±8.87 | 77.77±8.59 | 84.93±5.97 | 85.01±7.24 |
| C组 | 30 | 57.53±7.37 | 79.67±8.53a | 82.77±6.97a | 84.20±7.38a | 86.33±5.66 | 85.40±5.85 |
| D组 | 30 | 58.93±10.79 | 80.40±9.26a | 85.20±6.87a | 85.63±6.54a | 86.23±6.30 | 86.40±6.95 |
| F值 | 30.997 | 16.310 | 16.358 | 9.530 | 1.582 | 3.097 | |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.197 | 0.030 |
注:1 mmHg=0.133 kPa;NRDS:新生儿呼吸窘迫综合征;PS:肺泡表面活性物质;A组:对照组;B组:NRDS组;C组:NRDS+PS组;D组:NRDS+PS+布地奈德组;与B组比较,aP<0.01 1 mmHg=0.133 kPa;NRDS:neonatal respiratory distress syndrome;PS:pulmonary surfactant;group A:control group;group B:NRDS group;group C:NRDS with PS group;group D:NRDS with PS and Budesonide group;compared with group B,aP<0.01
C组及D组分别与B组相比,在用药后1、6、12 h pa(CO2)均明显升高,且D组升高更早更明显,差异有统计学意义(P均<0.01),见表3。
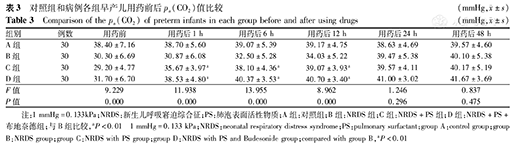
对照组和病例各组早产儿用药前后pa(CO2)值比较(mmHg, ±s)
±s)
Comparison of the pa(CO2) of preterm infants in each group before and after using drugs(mmHg, ±s)
±s)
对照组和病例各组早产儿用药前后pa(CO2)值比较(mmHg, ±s)
±s)
Comparison of the pa(CO2) of preterm infants in each group before and after using drugs(mmHg, ±s)
±s)
| 组别 | 例数 | 用药前 | 用药后1 h | 用药后6 h | 用药后12 h | 用药后24 h | 用药后48 h |
|---|---|---|---|---|---|---|---|
| A组 | 30 | 38.40±7.16 | 38.70±5.60 | 39.07±5.39 | 39.17±4.75 | 38.63±4.69 | 39.57±4.60 |
| B组 | 30 | 30.30±6.69 | 30.87±6.08 | 32.50±5.28 | 34.03±5.22 | 39.47±5.38 | 40.10±5.38 |
| C组 | 30 | 29.20±4.77 | 35.67±3.97a | 38.10±4.36a | 39.07±3.93a | 39.57±4.11 | 40.17±5.19 |
| D组 | 30 | 31.70±6.70 | 38.53±4.80a | 40.37±3.53a | 40.70±3.40a | 41.00±3.02 | 41.67±3.69 |
| F值 | 9.229 | 11.938 | 13.955 | 8.962 | 1.246 | 0.837 | |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.296 | 0.475 |
注:1 mmHg=0.133kPa;NRDS:新生儿呼吸窘迫综合征;PS:肺泡表面活性物质;A组:对照组;B组:NRDS组;C组:NRDS+PS组;D组:NRDS+PS+布地奈德组;与B组比较,aP<0.01 1 mmHg=0.133 kPa;NRDS:neonatal respiratory distress syndrome;PS:pulmonary surfactant;group A:control group;group B:NRDS group;group C:NRDS with PS group;group D:NRDS with PS and Budesonide group;compared with group B,aP<0.01
C组及D组分别与B组相比,高氧持续时间及总吸氧时间均明显减少,差异均有统计学意义(P均<0.01);但各组患儿总住院天数差异无统计学意义(P>0.05),见表4。

对照组和病例各组早产儿吸氧时间/住院天数比较(d, ±s)
±s)
Comparison of the oxygen using duration and the total hospitalization days of preterm infants in each group(d, ±s)
±s)
对照组和病例各组早产儿吸氧时间/住院天数比较(d, ±s)
±s)
Comparison of the oxygen using duration and the total hospitalization days of preterm infants in each group(d, ±s)
±s)
| 组别 | 例数 | 高氧持续时间 | 总吸氧时间 | 总住院天数 |
|---|---|---|---|---|
| A组 | 30 | 2.70±0.95a | 8.67±6.49a | 26.57±7.25 |
| B组 | 30 | 4.33±1.92 | 15.80±10.68 | 28.93±11.47 |
| C组 | 30 | 2.67±1.06a | 10.80±8.89a | 26.67±9.29 |
| D组 | 30 | 2.60±0.97a | 9.33±7.28a | 27.17±7.30 |
| F值 | 12.432 | 4.331 | 0.447 | |
| P值 | 0.000 | 0.006 | 0.720 |
注:NRDS:新生儿呼吸窘迫综合征;PS:肺泡表面活性物质;A组:对照组;B组:NRDS组;C组:NRDS+PS组;D组:NRDS+PS+布地奈德组;与B组比较,aP<0.05 NRDS:neonatal respiratory distress syndrome;PS:pulmonary surfactant;group A:control group;group B:NRDS group;group C:NRDS with PS group;group D:NRDS with PS and Budesonide group;compared with group B,aP<0.05
C组及D组分别与B组相比,改为有创呼吸机辅助通气的例数、再次使用PS的例数以及发生BPD的例数均明显减少,且D组减少更明显;D组发生BPD率与C组比较明显减少,差异均有统计学意义(P均<0.05),见表5。
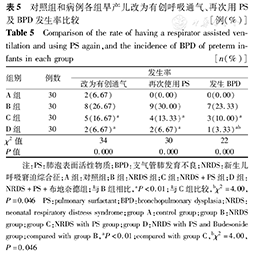
对照组和病例各组早产儿改为有创呼吸通气、再次用PS及BPD发生率比较[例(%)]
Comparison of the rate of having a respirator assisted ventilation and using PS again,and the incidence of BPD of preterm infants in each group[n(%)]
对照组和病例各组早产儿改为有创呼吸通气、再次用PS及BPD发生率比较[例(%)]
Comparison of the rate of having a respirator assisted ventilation and using PS again,and the incidence of BPD of preterm infants in each group[n(%)]
| 组别 | 例数 | 发生率 | ||
|---|---|---|---|---|
| 改为有创通气 | 再次使用PS | 发生BPD | ||
| A组 | 30 | 2(6.67) | 0(0.00) | 0(0.00) |
| B组 | 30 | 8(26.67) | 9(30.00) | 7(23.33) |
| C组 | 30 | 5(16.67)a | 4(13.33)a | 3(10.00)a |
| D组 | 30 | 2(6.67)a | 2(6.67)a | 1(3.33)ab |
| χ2值 | 34 | 30 | 22 | |
| P值 | 0.000 | 0.000 | 0.000 | |
注:PS:肺泡表面活性物质;BPD:支气管肺发育不良;NRDS:新生儿呼吸窘迫综合征;A组:对照组;B组:NRDS组;C组:NRDS+PS组;D组:NRDS+PS+布地奈德组;与B组相比,aP<0.01;与C组比较,bχ2=4.00,P=0.046 PS:pulmonary surfactant;BPD:bronchopulmonary dysplasia;NRDS:neonatal respiratory distress syndrome;group A:control group;group B:NRDS group;group C:NRDS with PS group;group D:NRDS with PS and Budesonide group;compared with group B,aP<0.01;compared with group C,bχ2=4.00,P=0.046
A、B、C、D组分别比较高血压、高血糖、消化道出血、NEC及院内感染发生率,差异均无统计学意义(P均>0.05),见表6。
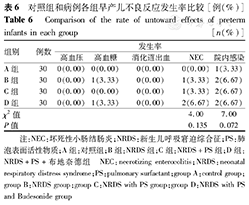
对照组和病例各组早产儿不良反应发生率比较[例(%)]
Comparison of the rate of untoward effects of preterm infants in each group[n(%)]
对照组和病例各组早产儿不良反应发生率比较[例(%)]
Comparison of the rate of untoward effects of preterm infants in each group[n(%)]
| 组别 | 例数 | 发生率 | ||||
|---|---|---|---|---|---|---|
| 高血压 | 高血糖 | 消化道出血 | NEC | 院内感染 | ||
| A组 | 30 | 0(0.00) | 0(0.00) | 0(0.00) | 0(0.00) | 1(3.33) |
| B组 | 30 | 0(0.00) | 1(3.33) | 0(0.00) | 1(3.33) | 2(6.67) |
| C组 | 30 | 0(0.00) | 0(0.00) | 0(0.00) | 1(3.33) | 2(6.67) |
| D组 | 30 | 0(0.00) | 1(3.33) | 0(0.00) | 2(6.67) | 2(6.67) |
| χ2值 | 4.00 | 7.00 | ||||
| P值 | 0.135 | 0.072 | ||||
注:NEC:坏死性小肠结肠炎;NRDS:新生儿呼吸窘迫综合征;PS:肺泡表面活性物质;A组:对照组;B组:NRDS组;C组:NRDS+PS组;D组:NRDS+PS+布地奈德组 NEC:necrotizing enterocolitis;NRDS:neonatal respiratory distress syndrome;PS:pulmonary surfactant;group A:control group;group B:NRDS group;group C:NRDS with PS group;group D:NRDS with PS and Budesonide group
BPD常继发于NRDS,发病机制极其复杂,肺发育不成熟、急性肺损伤、损伤后异常修复是引起BPD的3个关键环节[14]。早产儿特别是NRDS患儿往往需要高氧辅助呼吸,但高氧导致体内形成大量活性氧,而早产儿抗氧化活性能力低,不能及时清除肺内产生的活性氧,引起严重的氧化应激反应,导致肺损伤,最终导致BPD的发生[15,16,17]。BPD的患儿用氧及住院时间长,病死率高,遗留后遗症可能性大[18],家庭及社会负担重,故对于该病的防治已成为新生儿科最为棘手的问题之一。
猪肺磷脂注射液为外源性PS,现在临床上已广泛用于NRDS的预防及治疗。但有研究指出对于极低出生体质量儿,PS完全缺乏,通气血流比例失调,如果仅滴入PS只能短时间使肺泡表面张力下降,不能持续改善肺功能[19]。因为炎性损伤是发生BPD的关键环节,GC具有抑制炎性反应,减轻支气管及肺水肿,促进肺抗氧化酶及PS的生成,迅速改善肺功能,缩短呼吸机辅助治疗时间,降低BPD发生率的作用,而被广泛用于BPD的临床防治[20]。但由于早产儿肺组织处于萎陷状态,肺内含气量少而含血量多,使单纯从气管内滴入激素难以到达肺组织毛细血管末端和肺泡内,不能有效阻止肺内炎性反应[12]。本研究通过以PS为载体滴入激素不仅增加药物利用率而且更有效地抑制炎性反应。此外,大量的临床试验表明,全身使用GC可能引起感染、高血压、高血糖、肥厚性心肌病、胃肠道穿孔、NEC、脑发育及神经运动发育异常等不良反应[21]。吸入用布地奈德混悬液为新合成GC,其亲脂性较全身激素强,在肺内沉积率高,有利于促进肺泡Ⅱ型细胞成熟,从而促进合成和释放表面活性物质。本研究证明通过早期、一次性、小剂量气管内滴入的方式,不仅能够减少全身应用GC所造成的不良反应,而且能增加相对于雾化吸入而言的有效量。也有报道提出目前气管内滴入含有布地奈德的PS制剂正在开发中,或有助于降低BPD的发生率[22]。
本研究表明气管内滴入猪肺磷脂注射液能够在用药后12 h内较快的纠正血pH、pa(O2)及pa(CO2),使其尽早撤机,同时减少BPD的发生。布地奈德联合猪肺磷脂注射液相对于单纯滴入猪肺磷脂注射液而言,能更有效地预防BPD的发生,且高血压、高血糖、消化道出血、NEC以及院内感染发生率未见明显增加。但各组总住院时间无明显差别,考虑与极早产儿各脏器发育不成熟有关。此外,本研究各组中高血压、高血糖、消化道出血、NEC以及院内感染发生率差异无统计学意义,但本研究样本量少,且为单中心研究,仍需随访患儿神经系统及生长发育情况,并增加样本量进行多中心研究以进一步验证。总之,布地奈德联合猪肺磷脂注射液对于预防BPD有确切的作用,且优于单纯使用猪肺磷脂注射液。在以后的临床工作中,可以制备合成PS制剂,或通过此用药途径预防BPD的发生,从而提高早产儿的生存概率及生活质量。



























