
探讨儿童长QT间期综合征(LQTS)伴晕厥的临床特征及治疗方法。
选择2009年1月至2014年7月在湖南省儿童医院住院的LQTS伴晕厥儿童11例,对其临床特点及治疗方法进行分析,并获长期随访。
11例LQTS儿童年龄4.0~14.5(9.16±2.71)岁,男8例,女3例。晕厥发作均在1次以上,矫正QT间期(QTc) 460~521(483.72±22.90) ms。其中获得性LQTS 3例,先天性LQTS 8例。获得性LQTS患儿中1例为甲状旁腺功能减低引起低钙血症,1例为心肌炎合并Ⅲ度房室传导阻滞,1例为先天性心脏病术后心房扑动应用胺碘酮后出现,予去除诱因,治疗原发病后治愈出院;8例先天性LQTS患儿,3例完成LQTS基因检测(1例为KCNQ1基因突变,2例为KCNH2基因突变),1例住院期间频繁发作尖端扭转型室性心动过速(Tdp)及心室颤动后死亡,其余7例患儿予以口服普萘洛尔及氯化钾缓释片后出院,随访时间8~75个月,平均(45.73±24.42)个月。1例随访25个月后在家中猝死。其余6例先天性LQTS患儿未发作晕厥,可耐受一般活动,4例复查体表心电图QTc正常,2例体表心电图QTc较前无明显变化;3例获得性LQTS患儿在随访中复查心电图QTc恢复正常。
儿童先天性LQTS应早期进行基因筛查及分型,合理选用药物治疗;对于猝死风险较高的患儿,可考虑药物治疗联合植入型心律转复除颤器治疗。获得性LQTS应积极去除诱因、治疗原发病。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
长QT间期综合征(LQTS)亦称QT间期延长综合征,是一种心室复极时程延长、不均一性增大的离子通道疾病,可导致尖端扭转型室性心动过速(Tdp)等恶性心律失常的发生[1],临床表现以晕厥、搐搦或猝死为特征的临床综合征。该病是引起儿童心源性晕厥重要原因之一,且易漏诊及误诊。本研究选取湖南省儿童医院2009年1月至2014年7月收治的儿童LQTS伴晕厥11例,总结其临床特征、治疗及随访情况,为临床治疗及研究提供参考。
11例LQTS患儿,男8例,女3例;年龄4.0~14.5(9.16±2.71)岁;均晕厥发作1次以上,其中2例获得晕厥发作时Tdp形态心电图。矫正QT间期(QTc) 460~521(483.72±22.90) ms。其中获得性LQTS 3例,先天性LQTS 8例(表1),死亡2例。患儿均行12导联同步心电图、心脏X线片、动态心电图、超声心动图、血清电解质、心肌酶、血肌肌钙蛋白等检查,5例行脑电图及头部磁共振检查,3例行LQTS相关基因NGS测序(委托长沙金域检验所完成)。所有患儿因病情未行直立倾斜试验排除自主神经介导的反射性晕厥。患儿家长均已签署知情同意书,本研究经医院医学伦理委员会审批。
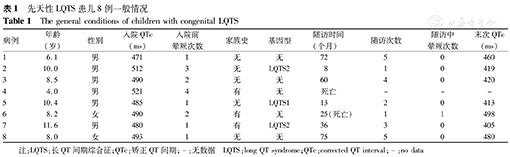
先天性LQTS患儿8例一般情况
The general conditions of children with congenital LQTS
先天性LQTS患儿8例一般情况
The general conditions of children with congenital LQTS
| 病例 | 年龄(岁) | 性别 | 入院QTc(ms) | 入院前晕厥次数 | 家族史 | 基因型 | 随访时间(个月) | 随访次数 | 随访中晕厥次数 | 末次QTc(ms) |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 6.1 | 男 | 471 | 1 | 无 | 无 | 72 | 5 | 0 | 460 |
| 2 | 10.0 | 男 | 512 | 3 | 无 | LQTS2 | 8 | 1 | 0 | 419 |
| 3 | 8.5 | 男 | 490 | 2 | 无 | 无 | 60 | 4 | 0 | 420 |
| 4 | 4.0 | 男 | 521 | 4 | 有 | 无 | 死亡 | - | - | - |
| 5 | 10.4 | 男 | 485 | 1 | 无 | LQTS1 | 13 | 2 | 0 | 413 |
| 6 | 8.2 | 女 | 490 | 2 | 有 | 无 | 25(死亡) | 1 | 1 | 498 |
| 7 | 11.6 | 男 | 480 | 1 | 有 | LQTS2 | 36 | 3 | 0 | 405 |
| 8 | 8.0 | 女 | 493 | 1 | 无 | 无 | 75 | 5 | 0 | 480 |
注:LQTS:长QT间期综合征;QTc:矫正QT间期;-:无数据 LQTS:long QT syndrome;QTc:corrected QT interval;-:no data
所有患儿入院后完善病史采集及12导联同步心电图描记,Schwartz评分[2]均≥3分。综合患儿既往史、家族史及所有实验室检查结果,诊断获得性LQTS 3例,其中1例为甲状旁腺功能减低引起低钙血症,1例为心肌炎合并Ⅲ度房室传导阻滞,1例为室间隔缺损合并房间隔缺损外科修补术后1个月心房扑动应用胺碘酮后出现。诊断先天性LQTS 8例,其中3例有家族晕厥史,3例有运动后诱发晕厥史,1例情绪激动后诱发晕厥,其余患儿未询及晕厥明显诱因。
3例完成LQTS基因检测,1例为KCNQ1基因突变(LQTS 1型),突变位点为G917T,其亲属未同意行基因检测;2例为KCNH2基因突变(LQTS 2型),其中1例突变位点为C1702T,受检者母亲C1702位点未见异常,无家族史,其余家属未同意行基因检测,1例突变位点为G1810A,受检者母亲该位点未见异常,其余家属未同意行基因检测。以上基因突变位点均为已知突变位点。
患儿均予绝对卧床休息,心电监护及吸氧。晕厥急性发作者予胸外心脏按压及按压人中,2例监测到晕厥发作及Tdp后予同步电复律,1例发作心室颤动患儿予电除颤。患儿均予静脉输注硫酸镁,首剂量为3~12 mg/kg,随后维持速度为0.5~1.0 mg/(kg·h)。提高血清钾浓度维持在4.5~5.0 mmol/L。
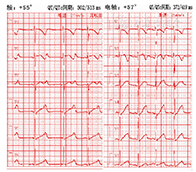
8例先天性LQTS患儿均予普萘洛尔口服,起始剂量1 mg/(kg·d),每3~5 d增加剂量至目标剂量2~3 mg/(kg·d),监测患儿的心率及血压,如出现明显窦性心动过缓或胸闷不适,则减少普萘洛尔维持剂量。予口服氯化钾缓释片0.5 mg/d,维持血钾4~5 mmol/L。1例患儿在住院期间频繁发作Tdp(图1)及室颤,抢救无效后死亡。1例患儿在随访25个月后在家中猝死。

The torsade de pointes electrocardiogram of children with long QT syndrome hospitalization

The torsade de pointes electrocardiogram of children with long QT syndrome hospitalization
获得性LQTS的治疗原则为去除诱因,积极治疗原发病。甲状旁腺功能减低引起低钙血症并晕厥的患儿予静脉补钙及口服骨化三醇,血钙正常后未发作晕厥,QTc恢复正常;心肌炎合并Ⅲ度房室传导阻滞患儿予放置临时起搏器,丙种球蛋白1 g/kg静脉滴注2 d,甲泼尼龙10 mg/(kg·d)静脉滴注3 d,及磷酸肌酸护心治疗后,患儿5 d后显示心脏传导阻滞消失,QTc恢复正常;先天性心脏病术后心房扑动患儿停用胺碘酮后,QTc逐渐恢复正常。
1例先天性LQTS患儿在住院期间死亡,其余10例患儿均完成随访,随访时间8~75个月,平均(45.73±24.42)个月。随访项目包括体表心电图及动态心电图,血电解质,是否发作晕厥,活动耐力是否降低。7例先天性LQTS患儿中,1例在随访中有晕厥发作1次,25个月后在家中猝死(未至医院就诊,具体死因不明)。其余6例未发作晕厥,可耐受一般活动,4例复查体表心电图QTc正常(图2),2例体表心电图QTc较前无明显变化(表1)。3例获得性LQTS患儿在随访中复查体表心电图QTc均恢复正常,未出现晕厥及其他不适。
Comparison of the electrocardiogram of patient diagnosed with long QT syndrom type 2 before and after treatment

注:A:治疗前QTc 512 ms;B:治疗后2个月后复查QTc 421 ms A:the corrected QT interval before treatment was 512 ms;B:after 2 months of treatment,the corrected QT interval was 421 ms
Comparison of the electrocardiogram of patient diagnosed with long QT syndrom type 2 before and after treatment
LQTS是指在心电图上表现QT间期延长,易产生恶性心律失常(如Tdp、心室颤动),导致晕厥、癫痫样抽搐发作和心脏骤停、心源性猝死的一组综合征[3]。按病因可分为先天性和获得性。先天性LQTS是特定的遗传基因突变使心肌除极复极异常的遗传性疾病,其发病机制是在分子水平上表现为编码离子通道的15个不同的易感基因的突变,导致除极及复极异常[2]。目前针对LQTS患者危险因素的临床研究指出,QTc>500 ms、晕厥发作的次数是猝死发生的独立危险因素[4,5]。本研究中2例死亡病例,晕厥发作次数均2次以上,1例QTc明显大于500 ms,且晕厥次数最多,1例QTc治疗后无明显好转,与国外的报道[4,5]一致。
β受体阻滞剂已经作为先天性LQTS的一线药物治疗,广泛用于临床。普萘洛尔是到目前为止使用经验最多、研究也最广泛的β受体阻滞刺,其抗心律失常效应的机制为降低或防止强烈交感刺激时发生的心脏跨壁复极离散度的增加[6]。尽管许多研究均证明有症状的LQTS患者使用β受体阻滞剂有效,但仍有20%~30%的患者在服用β受体阻滞剂期间仍然发生心脏事件[7]。这其中的原因部分是因为其中的一些患者没有按医嘱坚持每日服药或用药量不足,也可能是不同基因型对β受体阻滞剂的治疗效果有所区别。有研究指出β受体阻滞剂对LQTS1和LQTS2均有较好的保护效果[8];但对于LQTS3,由于其发作主要与休息及心率慢有关,故不十分主张β受体阻滞剂[9]。本研究中1例为LQTS 1型,2例为LQTS 2型,以普萘洛尔联合口服补钾治疗后,QTc均恢复正常,且未发作晕厥等不良心血管事件,说明基因分型有利于指导临床治疗及对预后的估计。维持血钾的稳定对预防LQTS恶性心律失常发生也十分重要[10]。细胞外血清钾水平保持在4~5 mmol/L可以增加钾离子外流,加快复极,与镁剂联合静滴在短期内纠正Tdp疗效显著。
获得性LQTS是指由药物、心脏疾病(心力衰竭、心肌缺血、心动过缓等)或者代谢异常等因素引起的可逆性QT间期延长伴Tdp发作的临床综合征[11]。去除诱因是最为重要的治疗手段,可以同时加用β受体阻滞剂及补充镁、钾离子等。继发于心动过缓者应予以起搏治疗[12]。本研究3例获得性LQTS中,1例为甲状旁腺功能减低引起低钙血症,1例为心肌炎合并Ⅲ度房室传导阻滞,1例为先天性心脏病术后心房扑动应用胺碘酮后出现。均予积极对症处理,补充镁、钾离子,QTc均恢复正常,且在随访过程中未出现不良事件发生。
本研究中2例患儿死亡,1例在住院期间频繁发作Tdp及心室颤动后死亡,1例患儿在随访25个月后在家中猝死,分析其死亡原因,考虑药物治疗效果不佳。对于β受体阻滞剂治疗后仍发生晕厥,且治疗后QTc仍大于500 ms的患儿,考虑猝死风险较高,需考虑植入型心律转复除颤器(ICD)植入预防猝死发生[13,14]。由于儿童ICD植入难度及费用较高,目前国内只有少数心脏中心开展[15]。故提高儿科心血管医师对ICD植入的认识也十分重要。
总之,儿童LQTS应首先积极寻找病因,对于获得性LQTS应积极去除诱因、治疗原发病。对于先天性LQTS,应早期进行基因筛查及分型,合理选用药物治疗,预防室性心律失常的发生。对于QTc>500 ms并晕厥发作较多,猝死风险较高的患儿,可考虑选择药物治疗联合ICD治疗。本单中心研究纳入病例数较少,随访时间不长,大部分病例未获得晕厥发作时心电图,为该临床研究的局限。在未来的研究中,需要采用多中心合作的大样本研究,进行国内LQTS合并晕厥的患儿的危险因素分析并基因分型,为临床治疗提供更坚实的依据。



























