
探讨青春前期特发性矮小症(ISS)患儿重组人生长激素(rhGH)治疗前后血清骨形成指标Ⅰ型前胶原氨基端前肽(PINP)及骨吸收指标Ⅰ型胶原交联羧基末端肽(β-CTX)水平变化及其在早期治疗随访体系中的临床意义。
ISS组患儿40例(男18例,女22例),健康对照组儿童50例,ISS组患儿予rhGH 0.15 IU/(kg·d),每晚皮下注射,治疗前、治疗3个月及6个月后分别采用电化学发光法测定其血清PINP、β-CTX、胰岛素样因子-1(IGF-1)及胰岛素样生长因子结合蛋白-3(IGFBP3)水平,并记录身高、体质量、体质量指数、身高标准差积分(HtSDS)、骨龄、生长速度。
1.青春前期ISS组血清PINP水平[(479.51±134.61)μg/L]均低于健康对照组PINP[(651.31±212.41)μg/L],β-CTX水平[(0.84±0.33)μg/L]高于健康对照组[(0.50±0.15)μg/L],差异均有统计学意义(t=2.276、-2.709,P均<0.05)。2.ISS男童(18例)及女童(22例)GH治疗前后血清PINP及β-CTX差异无统计学意义(P>0.05);40例ISS患儿GH治疗后3个月,血清PINP水平[(736.15±156.59)μg/L]及β-CTX水平[(1.08±0.27)μg/L]较治疗前均有升高,差异有统计学意义(t=4.736、2.497,P均<0.05),其中PINP尤为显著,HtSDS(-2.95±0.43)与治疗前HtSDS(-2.69±0.58)比较差异有统计学意义(t=2.714,P<0.05);治疗6个月与3个月比较,PINP水平(860.90±254.59) μg/L及β-CTX水平(0.94±0.32) μg/L增加缓慢(t=1.366、-0.831,P均>0.05),HtSDS(-2.51±0.54)与治疗后3个月比较差异无统计学意义(t=1.609,P>0.05)。3.血清PINP与IGF-1、IGFBP3呈正相关性(r=0.636、0.673,P均<0.05),与β-CTX无相关性(r=0.336,P>0.05),PINP、β-CTX与HtSDS呈正相关(r=0.655、0.782,P均<0.05)。
骨转换指标PINP及β-CTX可作为早期判断ISS GH疗效的辅助指标之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
特发性矮小症(idiopathic short stature,ISS)是指身高低于同种族、同年龄、同性别人群的平均身高-2 SD以下或第3百分位以下,且排除器质性、慢性系统性、先天性、遗传性、代谢性、染色体疾病及营养心理等已知病因导致的生长障碍[1]。ISS在非生长激素(GH)缺乏性矮小中最为常见,治疗仍首选重组人生长激素(rhGH),但疗效存在差异[2,3]。因此,选择早期敏感的骨转换指标评估骨骼生长发育状况及监测生长激素疗效显得尤为重要。血清Ⅰ型前胶原氨基端前肽(procollagen type Ⅰ amino-terminal propeptides,PINP)是骨形成标志物,反映了新合成Ⅰ型胶原蛋白的变化。Ⅰ型胶原交联羧基末端肽(β-C-telopeptides of type Ⅰ collagen,β-CTX)是骨重吸收标志物,是由Ⅰ型胶原蛋白羧基端降解生成[4,5]。本研究以40例青春期前ISS儿童为研究对象,探讨ISS患儿rhGH治疗前后血清骨转换指标PINP及β-CTX的变化及其对疗效判断的临床意义。
选择2013年1月至2014年12月在上海市儿童医院内分泌科诊断为ISS的40例儿童作为ISS组。年龄(8.03±1.86)岁;身高(113.50±9.37) cm;男18例,女22例;发育均为青春前期。入选ISS的诊断标准[1]:(1)出生时身长、体质量正常,身材匀称;(2)身高低于同年龄、同性别、同地区健康儿童身高均在2个标准差以下(以2005年中国9市城、郊区儿童体格发育调查资料参考值作为评价儿童生长发育的参数标准[6]);(3)生长速率小于5 cm/年;(4)骨龄正常或延迟;(5)GH激发试验:GH峰值>10 μg/L;(6)甲状腺功能、肝功能、肾功能、乙肝标志物、空腹血糖、血尿常规均无异常;(7)染色体核型分析正常;(8)无明显、严重的心理、情感障碍,摄食正常,并排除其他先天性代谢性疾病。健康对照组儿童50例来自于上海市儿童医院儿童保健科健康查体青春前期儿童。男25例,女25例;年龄(8.23±1.53)岁。身高和体质量均在同年龄、同性别正常均值1个标准差以内。
所有儿童均在同一测量器上由同一测量人员测定其身高、体质量。计算出身高标准差积分(height standard deviation scores,HtSDS)=(实测身高值-同龄儿童身高的均值)/同龄儿童身高的标准差。入选儿童均采集清晨空腹静脉血2~4 mL,3 000 r/min(离心半径为8 cm)离心5 min,分别留取血清,置-80 ℃冰箱保存待测。采用电化学发光发法测定血清PINP、β-CTX水平,试剂盒来源于罗氏诊断公司,由罗氏电化学发光仪cobase 601进行检测;胰岛素样因子-1(insulin-like growth factor 1,IGF-1)、胰岛素样生长因子结合蛋白-3(insulin-like growth factor binding protein 3,IGFBP3)由西门子Immulite 2000化学发光分析仪检测。IGF-1及IGFBP3试剂盒购于西门子诊断公司。治疗方法为每晚皮下注射重组人生长激素赛增水剂(长春金赛药业有限责任公司生产),剂量0.15 IU/(kg·d),即每周0.35 mg/kg,观察治疗前、治疗3个月及治疗6个月身高、HtSDS、IGF-1、IGFBP3、PINP、β-CTX变化。本研究已通过医院医学伦理委员会批准,患儿家长均知情同意,并签署知情同意书。
应用SPSS 21.0统计软件进行统计学分析,计量资料以 ±s表示。2组间比较采用独立样本t检验,两变量之间相关性采用Spearman相关分析。P<0.05为差异有统计学意义。
±s表示。2组间比较采用独立样本t检验,两变量之间相关性采用Spearman相关分析。P<0.05为差异有统计学意义。
ISS组与健康对照组在年龄、性别分布上差异无统计学意义(P均>0.05),具有可比性。青春前期ISS组血清PINP、IGF-1、IGFBP3均低于健康对照组,差异均有统计学意义(P均<0.05);β-CTX则高于健康对照组,差异有统计学意义(P<0.05),见表1。
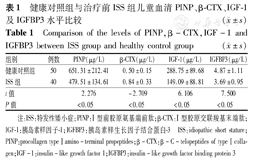
健康对照组与治疗前ISS组儿童血清PINP、β-CTX、IGF-1及IGFBP3水平比较( ±s)
±s)
Comparison of the levels of PINP,β-CTX,IGF-1 and IGFBP3 between ISS group and healthy control group( ±s)
±s)
健康对照组与治疗前ISS组儿童血清PINP、β-CTX、IGF-1及IGFBP3水平比较( ±s)
±s)
Comparison of the levels of PINP,β-CTX,IGF-1 and IGFBP3 between ISS group and healthy control group( ±s)
±s)
| 组别 | 例数 | PINP(μg/L) | β-CTX(μg/L) | IGF-1(μg/L) | IGFBP3(μg/L) |
|---|---|---|---|---|---|
| 健康对照组 | 50 | 651.31±212.41 | 0.50±0.15 | 288.75±89.68 | 4.87±1.11 |
| ISS组 | 40 | 479.51±134.61 | 0.84±0.33 | 149.09±88.81 | 3.69±0.95 |
| t值 | 2.276 | -2.709 | 6.106 | 7.500 | |
| P值 | <0.05 | <0.05 | <0.05 | <0.05 |
注:ISS:特发性矮小症;PINP:Ⅰ型前胶原氨基端前肽;β-CTX:Ⅰ型胶原交联羧基末端肽;IGF-1:胰岛素样因子-1;IGFBP3:胰岛素样生长因子结合蛋白-3
ISS:idiopathic short stature;PINP:procollagen type Ⅰ amino-terminal propeptides;β-CTX:β-C-telopeptides of type Ⅰ collagen;IGF-1:insulin-like growth factor 1;IGFBP3:insulin-like growth factor binding protein 3
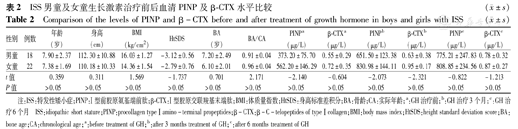
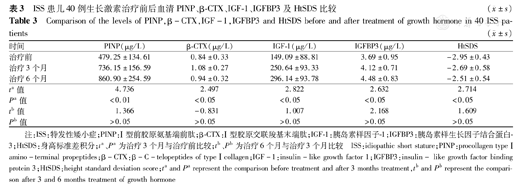
ISS组GH治疗前男童与女童在年龄、身高、HtSDS、体质量指数(BMI)、血清PINP、β-CTX水平上差异均无统计学意义(P均>0.05),治疗3个月及6个月血清PINP、β-CTX差异均无统计学意义(P均>0.05),见表2。ISS患儿40例接受GH治疗3个月与治疗前比较,PINP、β-CTX、IGF-1、IGFBP3水平均升高(表3,图1),PINP升高显著,其次是IGF-1、IGFBP3及β-CTX(P均<0.05)。GH治疗3个月后身高生长速率(growth velocity,GV)为(9.35±3.01) cm/年,HtSDS为-2.95±0.43,与治疗前GV[(3.01±0.80) cm/年]、HtSDS(-2.69±0.58)比较,差异均有统计学意义(P均<0.05)。GH治疗后6个月与治疗后3个月PINP、β-CTX、IGF-1、IGFBP3比较,差异均无统计学意义(P均>0.05)(表3、图1)。GH治疗6个月后GV为(9.02±4.61) cm/年,HtSDS为-2.51±0.54,与治疗后3个月比较差异无统计学意义(P均>0.05)。
ISS男童及女童生长激素治疗前后血清PINP及β-CTX水平比较( ±s)
±s)
Comparison of the levels of PINP and β-CTX before and after treatment of growth hormone in boys and girls with ISS( ±s)
±s)
ISS男童及女童生长激素治疗前后血清PINP及β-CTX水平比较( ±s)
±s)
Comparison of the levels of PINP and β-CTX before and after treatment of growth hormone in boys and girls with ISS( ±s)
±s)
| 性别 | 例数 | 年龄(岁) | 身高(cm) | BMI(kg/cm2) | HtSDS | BA(岁) | BA/CA | PINPa(μg/L) | β-CTXa(μg/L) | PINPb(μg/L) | β-CTXb(μg/L) | PINPc(μg/L) | β-CTXc(μg/L) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 男童 | 18 | 7.90±2.37 | 112.30±10.88 | 16.03±1.27 | -3.12±0.56 | 7.20±2.49 | 0.91±0.04 | 373.20±75.70 | 0.55±0.29 | 651.50±123.38 | 0.63±0.38 | 775.21±247.83 | 0.78±0.32 |
| 女童 | 22 | 7.38±1.69 | 110.18±10.33 | 14.36±1.54 | -2.79±0.76 | 6.10±2.01 | 0.96±0.04 | 562.20±146.29 | 0.72±0.35 | 830.98±144.11 | 0.95±0.17 | 808.85±234.56 | 0.87±0.27 |
| t值 | 0.359 | 0.311 | 1.569 | -1.737 | 0.701 | 2.171 | -2.140 | -0.604 | -2.073 | -2.321 | -0.822 | -1.213 | |
| P值 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 |
注:ISS:特发性矮小症;PINP:Ⅰ型前胶原氨基端前肽;β-CTX:Ⅰ型胶原交联羧基末端肽;BMI:体质量指数;HtSDS:身高标准差积分;BA:骨龄;CA:实际年龄;a:GH治疗前;b:GH治疗3个月;c:GH治疗6个月
ISS:idiopathic short stature;PINP:procollagen type Ⅰ amino-terminal propeptides;β-CTX:β-C-telopeptides of type Ⅰ collagen;BMI:body mass index;HtSDS:height standard deviation score;BA:bone age;CA:chronological age;a:before treatment of GH;b:after 3 months treatment of GH;c:after 6 months treatment of GH
ISS患儿40例生长激素治疗前后血清PINP、β-CTX、IGF-1、IGFBP3及HtSDS比较( ±s)
±s)
Comparison of the levels of PINP,β-CTX,IGF-1,IGFBP3 and HtSDS before and after treatment of growth hormone in 40 ISS patients( ±s)
±s)
ISS患儿40例生长激素治疗前后血清PINP、β-CTX、IGF-1、IGFBP3及HtSDS比较( ±s)
±s)
Comparison of the levels of PINP,β-CTX,IGF-1,IGFBP3 and HtSDS before and after treatment of growth hormone in 40 ISS patients( ±s)
±s)
| 时间 | PINP(μg/L) | β-CTX(μg/L) | IGF-1(μg/L) | IGFBP3(μg/L) | HtSDS |
|---|---|---|---|---|---|
| 治疗前 | 479.25±134.61 | 0.84±0.33 | 149.09±88.81 | 3.69±0.95 | -2.95±0.43 |
| 治疗3个月 | 736.15±156.59 | 1.08±0.27 | 250.64±93.33 | 4.12±0.71 | -2.69±0.58 |
| 治疗6个月 | 860.90±254.59 | 0.94±0.32 | 296.14±93.78 | 4.48±0.83 | -2.51±0.54 |
| ta值 | 4.736 | 2.497 | 2.822 | 2.632 | 2.714 |
| Pa值 | <0.01 | <0.05 | <0.05 | <0.05 | <0.05 |
| tb值 | 1.366 | -0.831 | 1.007 | 2.168 | 1.609 |
| Pb值 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 |
注:ISS:特发性矮小症;PINP:Ⅰ型前胶原氨基端前肽;β-CTX:Ⅰ型胶原交联羧基末端肽;IGF-1:胰岛素样因子-1;IGFBP3:胰岛素样生长因子结合蛋白-3;HtSDS:身高标准差积分;ta、Pa为治疗3个月与治疗前比较;tb、Pb为治疗6个月与治疗3个月比较
ISS:idiopathic short stature;PINP:procollagen type Ⅰ amino-terminal propeptides;β-CTX:β-C-telopeptides of type Ⅰ collagen;IGF-1:insulin-like growth factor 1;IGFBP3:insulin- like growth factor binding protein 3;HtSDS:height standard deviation score;ta and Pa represent the comparison before treatment and after 3 months treatment,tb and Pb represent the comparison after 3 and 6 months treatment of growth hormone
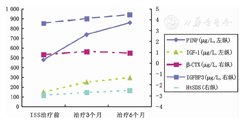

注:ISS:特发性矮小症;PINP:Ⅰ型前胶原氨基端前肽;β-CTX:Ⅰ型胶原交联羧基末端肽;IGF-1:胰岛素样因子-1;IGFBP3:胰岛素样生长因子结合蛋白-3;HtSDS:身高标准差积分;PINP、IGF-1为主坐标(左纵),β-CTX、IGFBP3、HtSDS为次坐标(右纵)
ISS:idiopathic short stature;PINP:procollagen type Ⅰ amino-terminal propeptides;β-CTX:β-C-telopeptides of type Ⅰ collagen;IGF-1:insulin-like growth factor 1;IGFBP3:insulin- like growth factor binding protein 3;HtSDS:height standard deviation score;the levels of PINP and IGF-1 were primary axis(left),β-CTX,IGFBP3,HtSDS were secondary axis(right)
Spearman相关分析,结果显示PINP与IGF-1、IGFBP3相关系数分别为r=0.636、0.673(P均<0.05),与β-CTX相关系数r=0.336(P>0.05);PINP与HtSDS相关系数r=0.655(P<0.05),β-CTX与HtSDS相关系数r=0.782(P<0.01),故可认为血清PINP与IGF-1、IGFBP3,PINP、β-CTX与HtSDS均存在正相关关系,见表4。
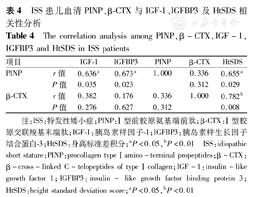
ISS患儿血清PINP、β-CTX与IGF-1、IGFBP3及HtSDS相关性分析
The correlation analysis among PINP,β-CTX,IGF-1,IGFBP3 and HtSDS in ISS patients
ISS患儿血清PINP、β-CTX与IGF-1、IGFBP3及HtSDS相关性分析
The correlation analysis among PINP,β-CTX,IGF-1,IGFBP3 and HtSDS in ISS patients
| 项目 | IGF-1 | IGFBP3 | PINP | β-CTX | HtSDS | |
|---|---|---|---|---|---|---|
| PINP | r值 | 0.636a | 0.673a | 1.000 | 0.336 | 0.655a |
| P值 | 0.035 | 0.023 | 0.312 | 0.029 | ||
| β-CTX | r值 | 0.382 | 0.176 | 0.336 | 1.000 | 0.782b |
| P值 | 0.276 | 0.627 | 0.312 | 0.008 |
注:ISS:特发性矮小症;PINP:Ⅰ型前胶原氨基端前肽;β-CTX:Ⅰ型胶原交联羧基末端肽;IGF-1:胰岛素样因子-1;IGFBP3:胰岛素样生长因子结合蛋白-3;HtSDS:身高标准差积分;aP<0.05,bP<0.01
ISS:idiopathic short stature;PINP:procollagen type Ⅰ amino-terminal propeptides;β-CTX:β-cross-linked C-telopeptides of type Ⅰ collagen;IGF-1:insulin-like growth factor 1;IGFBP3:insulin- like growth factor binding protein 3;HtSDS:height standard deviation score;aP<0.05,bP<0.01
儿童骨骼纵向生长过程中,骨组织不断进行骨形成和骨吸收,二者处于动态变化之中,完成骨塑造和骨再造。目前GH/IGF-1轴对骨骼生长调节作用机制[7]:(1) GH直接作用于长骨干骺端生长板静息区的前软骨细胞和成骨干细胞产生IGF-1,促进增殖区软骨细胞克隆扩增,骨骼呈线性增长,身高生长加快;(2)垂体前叶分泌GH后作用于肝脏,与受体结合促进IGF-1合成及分泌,血清IGF-1调节骨干径向生长,促进骨膜骨质沉积、成骨细胞生成和Ⅰ型胶原分泌;(3) IGF-1通过自分泌和旁分泌相互作用方式[7,8,9],促进骨形成、骨吸收及骨矿化。这就从骨微观学上解释了GH/IGF-1、骨代谢与身高增长之间的关系。儿童生长以骨形成为主,成骨细胞是骨形成过程的主体,需经历成骨细胞增殖、细胞外基质成熟、细胞外基质矿化和成骨细胞凋亡4个阶段。Ⅰ型胶原是第1阶段的主要产物,由Ⅰ型前胶原裂解形成,产物片段PINP被视为骨形成标志物,可准确地反映胶原合成及成骨细胞的活性[5]。血清PINP水平与年龄、青春期状态有关,出生第1年水平最高,女童Tanner 2~3期及男童G3期达到峰值[10,11]。此外,Ⅰ型胶原降解过程中C端肽的α-天冬氨酸转变成β-CTX,被视为骨吸收指标[5]。目前血清PINP及β-CTX在成人骨质疏松症、肿瘤等治疗中已成为早期敏感的骨代谢指标[12,13]。近来Andersson等[11]研究指出PINP可反映青春前期矮小症患儿GH治疗第1年的疗效。因此,本研究选择青春期前40例ISS患儿为研究对象,通过检测血清PINP、β-CTX及IGF-1、IGFBP3水平,探讨ISS骨代谢状况及GH/IGF-1轴内分泌激素变化,尝试了解ISS身高生长缓慢的原因;并寻找对GH治疗敏感的骨代谢标志物,预测GH治疗反应性。
本组研究中男童与女童治疗前年龄、身高、HtSDS、BMI、BA/CA差异无统计学意义,治疗前、治疗后3个月及6个月骨转换指标PINP及β-CTX差异无统计学意义,这可能与所有病例均处于青春前期有关。40例ISS患儿GH治疗前血清PINP、IGF-1及IGFBP3水平均明显低于健康对照组,β-CTX则高于健康对照组,差异均有统计学意义(P均<0.05),且血清PINP、β-CTX水平与HtSDS呈正相关(P均<0.05),表明血清PINP及β-CTX可以作为骨转换特异指标来反映儿童骨骼生长状况,ISS患儿骨形成降低,骨吸收增加,骨吸收大于骨形成,反映在骨组织形态学的改变是长骨的线性增长及骨量低于健康同年龄同性别儿童。这与国内外相关ISS骨代谢研究报道相符[14,15]。此外,本研究发现ISS患儿血清PINP与IGF-1、IGFBP3水平呈正相关(P均<0.05)。血清IGF-1及IGFBP3水平降低是由于ISS基因突变及多态性所致促生长激素释放激素-GH-IGF轴功能异常的结果[16],IGF-1降低可能导致成骨细胞生成减慢,Ⅰ型胶原合成减少,从而表现为血清PINP水平降低,骨骼及身高生长迟缓。由此提示血清PINP可以反映骨骼的生长动力。
目前,已有研究表明儿童生长激素缺乏症GH治疗显著增加骨形成和骨吸收水平,建议GH治疗前3个月检测骨形成及骨吸收指标可判断GH治疗反应性[17]。Schönau等[18]根据骨龄、血清IGF-1水平、尿骨吸收指标及身高生长速率等建立了预测儿童GH缺乏症GH治疗反应性的模型。而有关ISS GH与骨代谢之间的研究甚少,曾有报道指出ISS患儿GH治疗前血清PINP水平越低预示GH治疗第1年身高生长疗效越好[15]。本研究选择骨形成指标PINP及骨吸收β-CTX作为监测儿童接受GH治疗后生长疗效的指标,40例ISS患儿均接受6个月rhGH治疗,治疗前、治疗3个月及6个月检测血清PINP、β-CTX、IGF-1及IGFBP3水平,并进行GV及HtSDS随访,发现治疗后3个月血清PINP、β-CTX、IGF-1及IGFBP3水平较治疗前均有所升高,尤其是PINP治疗前后差异有统计学意义(t=4.736,P<0.01),较IGF-1水平增加(t=2.822,P<0.05)更为明显,GV及HtSDS较治疗前均有提高,提示血清PINP能早期敏感地反映GH疗效。其机制可能涉及GH直接刺激成骨细胞生成,使Ⅰ型胶原合成增加,导致血清PINP水平升高。此外血清β-CTX水平较治疗前增加(t=2.497,P<0.05),但PINP与β-CTX水平无相关性(r=0.336,P>0.05)。由此表明ISS患儿GH治疗前3个月对骨代谢影响较大,骨形成及骨吸收均加快,呈高转换状态,但骨形成大于骨吸收,骨量累积,表现为身高GV加快,HtSDS增加,GH疗效最佳。ISS患儿经GH治疗6个月后,血清PINP、IGF-1及IGFBP3水平较治疗后3个月仍有增高,β-CTX则相对减低,但差异无统计学意义,身高GV无明显变化,HtSDS增加不显著,表明GH治疗6个月后骨形成及骨吸收增加减慢。国内外文献普遍认为短期内GH治疗可加快生长速度,但对最终身高的改善仍存在争议[19],因此,骨转换指标在早期评估ISS儿童生长潜力尤为关键,除了积极开展基因突变及多态性研究,血清PINP及β-CTX骨转换指标的检测有助于早期评估GH治疗疗效及衡量成本-效益,有利于建立预测GH治疗反应性的模型。
综上,骨转换指标PINP及β-CTX的检测可用来观察儿童骨代谢状况,探讨GH/IGF-1轴参与骨骼生长调控的机制,在监测ISS GH治疗疗效方面具有早期预警作用,可以作为早期判断GH疗效的辅助指标之一。但本研究仍存在不足,需要扩大研究例数,长期监测骨转换指标以指导临床治疗。今后可尝试建立国内健康儿童的PINP正常参考范围,以便于儿童骨骼成长发育的评估及矮小患儿GH治疗疗效监测。



























