
了解重庆酉阳地区呼吸道感染患儿鼻咽部卡他莫拉菌的携带情况及抗生素耐药性特征,供临床用药参考。
采集2015年1月至12月重庆医科大学附属第一医院酉阳医院儿科住院呼吸道感染患儿鼻咽拭子标本,分离培养卡他莫拉菌,采用E-test法和纸片扩散法检测分离株的抗生素敏感性,结合欧洲抗菌药物敏感性判定(EUCAST)标准、美国临床实验室国家标准委员会(CLSI)2014年标准和英国抗微生物化疗学会(BSAC)标准3种判读标准解读检测结果。用头孢硝噻吩纸片法检测分离株是否产β-内酰胺酶。
共采集1 054例1个月~12岁患儿鼻咽拭子标本,分离出卡他莫拉菌101株,总携带率为9.6%。≤3岁患儿分离阳性率较高,为10.5%(90/860例)。夏季分离率低(4.0%,8/200例),冬季分离率高(13.8%,52/378例)。99.0%(100/101例)的菌株产β-内酰胺酶。所有菌株对阿莫西林-克拉维酸敏感;根据EUCAST和CLSI 2014年标准,分离株对头孢菌素均较为敏感;CLSI 2014年标准下,分离株对红霉素的耐药率仅为15.8%(16/101例);根据BSAC标准判读时,氨苄西林耐药率为68.3%(69/101例),头孢呋辛的中介率和耐药率分别达45.5%(46/101例)和49.5%(50/101例)。
重庆酉阳地区呼吸道感染住院患儿中≤3岁儿童鼻咽部携带卡他莫拉菌较其他年龄段更为常见,冬季多见;几乎所有分离株产β-内酰胺酶对阿莫西林-克拉维酸普遍敏感。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
卡他莫拉菌(Moraxella catarrhalis)只感染人类,通常定植于上呼吸道。以往认为该菌是鼻咽部的非致病共生菌,直到最近才确认其致病作用[1]。在免疫功能正常人群,卡他莫拉菌可以引起黏膜感染,是儿童中耳炎和成人慢性阻塞性肺疾病急性发作的重要病原[2]。近年来研究发现该菌β-内酰胺酶阳性率升高,超过90%的分离株产β-内酰胺酶[3],提示该菌抗生素耐药状况严重。但国内对卡他莫拉菌在儿童中流行状况和耐药性关注不多,来自于基层的研究更少。本研究对重庆医科大学附属第一医院酉阳医院儿科住院的呼吸道感染患儿鼻咽部卡他莫拉菌的携带情况及耐药性进行研究,了解卡他莫拉菌的耐药性状况,为临床用药提供参考。
采集2015年1月至12月在重庆医科大学附属第一医院酉阳医院儿科病房住院呼吸道感染1 054例患儿的鼻咽拭子标本。其中男679例,女375例;年龄1个月~12岁。本研究获得医院医学伦理委员会批准,经患儿监护人同意后采集鼻咽拭子标本。
标本立即放入脱脂奶粉-胰蛋白胨-葡萄糖-甘油(STGG)转运培养基中。2 h内将标本转运至实验室,置35 ℃、50 mL/L二氧化碳(CO2)孵箱中孵育2 h后置-80 ℃冰箱冻存。每0.5年将冻存标本转运至北京儿童医院微生物研究室进行细菌分离和培养。
冻存标本解冻后震荡混匀,取20 μL接种到含50 mL/L脱纤维羊血胰蛋白胨-大豆-琼脂(Oxoid,英国)平板上,于35 ℃、50 mL/L CO2孵箱中孵育。分别在培养24 h及48 h检查平板,检查可疑卡他莫拉菌菌落:中等大小、灰白色、光滑菌落,可用接种环在平板表面推移。可疑菌落镜检为革兰阴性双球菌,氧化酶试验、触酶试验、DNA酶试验及硝酸盐还原试验均阳性者为卡他莫拉菌。
采用头孢硝噻吩纸片法检测β-内酰胺酶。采用E-test法检测菌株对氨苄西林、阿莫西林-克拉维酸(AMC)、头孢呋辛、头孢他啶、头孢吡肟、环丙沙星、红霉素和美罗培南的最低抑菌浓度(MIC)值,采用纸片扩散法检测菌株对磺胺甲 唑-甲氧苄啶(SMZ-TMP)、氯霉素和四环素的敏感性。药敏培养基为Mueller-Hinton(英国Oxoid公司)加50 mL/L脱纤维羊血,25 mL/90 mm平皿。药敏检测质控菌株为肺炎链球菌ATCC49619。
唑-甲氧苄啶(SMZ-TMP)、氯霉素和四环素的敏感性。药敏培养基为Mueller-Hinton(英国Oxoid公司)加50 mL/L脱纤维羊血,25 mL/90 mm平皿。药敏检测质控菌株为肺炎链球菌ATCC49619。
目前还没有统一的卡他莫拉菌药物敏感判定标准,本研究中同时采用欧洲抗菌药物敏感性判定标准(EUCAST,http://www.eucast.org/clinical_breakpoints/)、美国临床实验室国家标准委员会(CLSI)2014年标准[4]和英国抗微生物化疗学会(BSAC)标准[5]解释药敏检测结果。3种判读标准见表1。
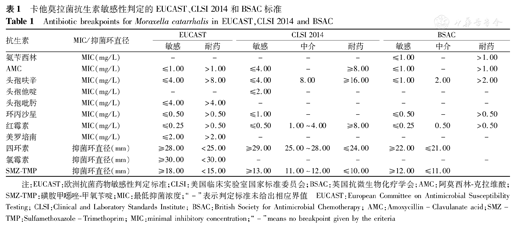
卡他莫拉菌抗生素敏感性判定的EUCAST、CLSI 2014和BSAC标准
Antibiotic breakpoints for Moraxella catarrhalis in EUCAST,CLSI 2014 and BSAC
卡他莫拉菌抗生素敏感性判定的EUCAST、CLSI 2014和BSAC标准
Antibiotic breakpoints for Moraxella catarrhalis in EUCAST,CLSI 2014 and BSAC
| 抗生素 | MIC/抑菌环直径 | EUCAST | CLSI 2014 | BSAC | |||||
|---|---|---|---|---|---|---|---|---|---|
| 敏感 | 耐药 | 敏感 | 中介 | 耐药 | 敏感 | 中介 | 耐药 | ||
| 氨苄西林 | MIC(mg/L) | - | - | - | - | - | ≤1.00 | - | >1.00 |
| AMC | MIC(mg/L) | ≤1.00 | >1.00 | ≤4.00 | - | ≥8.00 | ≤1.00 | - | >1.00 |
| 头孢呋辛 | MIC(mg/L) | ≤4.00 | >8.00 | ≤4.00 | 8.00 | ≥16.00 | ≤1.00 | 2.00 | >2.00 |
| 头孢他啶 | MIC(mg/L) | - | - | ≤2.00 | - | - | - | - | - |
| 头孢吡肟 | MIC(mg/L) | ≤4.00 | >4.00 | - | - | - | - | - | - |
| 环丙沙星 | MIC(mg/L) | ≤0.50 | >0.50 | ≤1.00 | - | - | ≤0.50 | - | >0.50 |
| 红霉素 | MIC(mg/L) | ≤0.25 | >0.50 | ≤0.50 | 1.00~4.00 | ≥8.00 | ≤0.25 | 0.50 | >0.50 |
| 美罗培南 | MIC(mg/L) | ≤2.00 | >2.00 | - | - | - | - | - | - |
| 四环素 | 抑菌环直径(mm) | ≥28.00 | <25.00 | ≥29.00 | 25.00~28.00 | ≤24.00 | ≥22.00 | ≤21.00 | |
| 氯霉素 | 抑菌环直径(mm) | ≥30.00 | <30.00 | - | - | - | - | - | - |
| SMZ-TMP | 抑菌环直径(mm) | ≥18.00 | <15.00 | ≥13.00 | 11.00~12.00 | ≤10.00 | ≥12.00 | ≤11.00 | |
注:EUCAST:欧洲抗菌药物敏感性判定标准;CLSI:美国临床实验室国家标准委员会;BSAC:英国抗微生物化疗学会;AMC:阿莫西林-克拉维酸;SMZ-TMP:磺胺甲 唑-甲氧苄啶;MIC:最低抑菌浓度;"-"表示判定标准未给出相应界值
唑-甲氧苄啶;MIC:最低抑菌浓度;"-"表示判定标准未给出相应界值
EUCAST:European Committee on Antimicrobial Susceptibility Testing; CLSI:Clinical and Laboratory Standards Institute; BSAC:British Society for Antimicrobial Chemotherapy; AMC:Amoxycillin-Clavulanate acid;SMZ-TMP:Sulfamethoxazole-Trimethoprim; MIC:minimal inhibitory concentration;"-" means no breakpoint given by the criteria
采用WHONET 5.6软件录入药物敏感检测数据,并进行药物敏感性分析。采用SPSS 16.0统计软件进行统计学分析。计数资料采用百分率(%)表示,组间比较采用χ2检验或Fisher′s精确概率法。P<0.05为差异有统计学意义。
研究期间共收集1 054份鼻咽拭子,分离出卡他莫拉菌101株,总携带率为9.6%。1-12月份各个月份的分离阳性率依次分别为7.9%(10/126例)、15.0%(12/80例)、10.5%(9/86例)、14.7%(5/34例)、11.4%(13/114例)、12.8%(5/39例)、2.7%(3/110例)、0(0/51例)、1.4%(1/70例)、7.3%(8/110例)、8.1%(5/62例)和17.4%(30/172例)。12月份分离率最高,5-7月份阳性率较低,8月份的51份标本中未分离到卡他莫拉菌。
不同年龄呼吸道感染儿童鼻咽部卡他莫拉菌携带状况亦有所不同:≤1岁、>1~2岁、>2~3岁、>3~4岁、>4~5岁、>5~6岁、>6~7岁儿童卡他莫拉菌的携带率分别为10.4%(64/618例)、10.8%(16/148例)、10.6%(10/94例)、8.5%(6/71例)、3.2%(1/31例)、6.9%(2/29例)、5.3%(1/19例),>7~8岁(9例)和>8~9岁(10例)患儿中均未分离出卡他莫拉菌,≥10岁儿童的阳性率为4.0%(1/25例)。≤3岁儿童阳性率为10.5%(90/860例),学龄前(4~6岁)儿童阳性率为6.9%(9/131例),≥7岁儿童阳性率为3.2%(2/63例),3个年龄段携带率差异无统计学意义(χ2=4.87,P>0.05)。101例携带卡他莫拉菌患儿的年龄构成:≤3岁患儿占89.1%(90/101例),4~6岁占8.9%(9/101例),≥7岁占2.0%(2/101例)。
男童和女童卡他莫拉菌分离阳性率分别为9.0%(61/679例)和10.7%(40/375例),差异无统计学意义(χ2=0.79,P>0.05)。
101株卡他菌株中,100株(99.0%)β-内酰胺酶阳性。分离株对11种常见抗菌药物的敏感性检测结果见表2。所有菌株对AMC敏感,无耐药株。根据EUCAST和CLSI 2014标准,分离株对头孢菌素均较为敏感;但根据BSAC标准判读时,氨苄西林耐药率为68.3%,头孢呋辛的中介率和耐药率分别达到45.5%和49.5%。CLSI 2014判定标准下,分离株对红霉素的耐药率明显较低,仅为15.8%。EUCAST标准下,菌株对SMZ-TMP不敏感更为多见(40.6%)。分离株对环丙沙星、美罗培南和氯霉素不敏感或耐药很少见(<5.0%)。
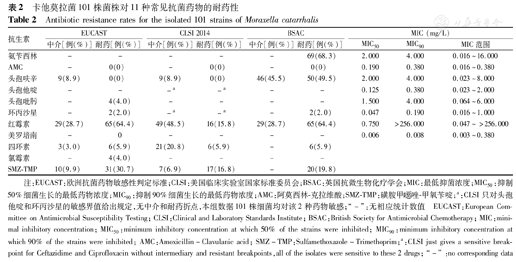
卡他莫拉菌101株菌株对11种常见抗菌药物的耐药性
Antibiotic resistance rates for the isolated 101 strains of Moraxella catarrhalis
卡他莫拉菌101株菌株对11种常见抗菌药物的耐药性
Antibiotic resistance rates for the isolated 101 strains of Moraxella catarrhalis
| 抗生素 | EUCAST | CLSI 2014 | BSAC | MIC (mg/L) | |||||
|---|---|---|---|---|---|---|---|---|---|
| 中介[例(%)] | 耐药[例(%)] | 中介[例(%)] | 耐药[例(%)] | 中介[例(%)] | 耐药[例(%)] | MIC50 | MIC90 | MIC范围 | |
| 氨苄西林 | - | - | - | - | - | 69(68.3) | 2.000 | 4.000 | 0.016~16.000 |
| AMC | - | 0(0) | - | 0(0) | - | 0(0) | 0.190 | 0.380 | 0.016~0.380 |
| 头孢呋辛 | 9(8.9) | 0(0) | 9(8.9) | 0(0) | 46(45.5) | 50(49.5) | 2.000 | 4.000 | 0.023~8.000 |
| 头孢他啶 | - | - | -a | -a | - | - | 0.125 | 0.380 | 0.023~2.000 |
| 头孢吡肟 | - | 4(4.0) | - | - | - | - | 1.500 | 4.000 | 0.064~6.000 |
| 环丙沙星 | - | 2(2.0) | -a | -a | - | 2(2.0) | 0.047 | 0.190 | 0.016~1.000 |
| 红霉素 | 29(28.7) | 65(64.4) | 49(48.5) | 16(15.8) | 29(28.7) | 65(64.4) | 0.750 | >256.000 | 0.047~>256.000 |
| 美罗培南 | - | 0 | - | - | - | - | 0.006 | 0.008 | 0.003~0.380 |
| 四环素 | 3(3.0) | 6(5.9) | 21(20.8) | 6(5.9) | - | 6(5.9) | |||
| 氯霉素 | - | 4(4.0) | - | - | - | - | |||
| SMZ-TMP | 10(9.9) | 31(30.7) | 7(6.9) | 17(16.8) | - | 20(19.8) | |||
注:EUCAST:欧洲抗菌药物敏感性判定标准;CLSI:美国临床实验室国家标准委员会;BSAC:英国抗微生物化疗学会;MIC:最低抑菌浓度;MIC50:抑制50%细菌生长的最低药物浓度;MIC90:抑制90%细菌生长的最低药物浓度;AMC:阿莫西林-克拉维酸;SMZ-TMP:磺胺甲 唑-甲氧苄啶;a:CLSI只对头孢他啶和环丙沙星的敏感界值给出规定,无中介和耐药折点,本组数据101株细菌均对该2种药物敏感;"-" :无相应统计数值
唑-甲氧苄啶;a:CLSI只对头孢他啶和环丙沙星的敏感界值给出规定,无中介和耐药折点,本组数据101株细菌均对该2种药物敏感;"-" :无相应统计数值
EUCAST:European Committee on Antimicrobial Susceptibility Testing; CLSI:Clinical and Laboratory Standards Institute; BSAC:British Society for Antimicrobial Chemotherapy; MIC:minimal inhibitory concentration; MIC50:minimum inhibitory concentration at which 50% of the strains were inhibited; MIC90:minimum inhibitory concentration at which 90% of the strains were inhibited; AMC:Amoxicillin-Clavulanic acid; SMZ-TMP:Sulfamethoxazole-Trimethoprim;a:CLSI just gives a sensitive breakpoint for Ceftazidime and Ciprofloxacin without intermediary and resistant breakpoints,all of the isolates were sensitive to these 2 drugs; "-" :no corresponding data
本研究显示,酉阳地区住院呼吸道感染儿童1 054份鼻咽拭子标本中分离出卡他莫拉菌101株,携带率为9.6%。稍低于湖北[6]、河北[7]、宁夏银川[8]的报道(分别为11.13%、11.0%和11.6%),可能与标本采集后仅在转运培养基中短暂孵育,然后冻存一段时间之后才进行细菌分离培养有关。但Kaijalainen和Palmu[9]研究表明,鼻咽拭子标本采用STGG培养基长期(>11年)低温冻存(低于-70 ℃)后,仍可分离出肺炎链球菌和卡他莫拉菌,阳性率下降不明显。因此,本研究携带率稍低于先前已有报告,可能更多地与患儿年龄组成和标本采集季节等不同有关。本研究结果显示,3岁及3岁以下儿童卡他莫拉菌携带率较高(10.5%),差异无统计学意义;而学龄前儿童和学龄儿童携带率低(分别为6.9%和3.2%)差异无统计学意义;卡他莫拉菌阳性患儿中,89.1%为≤3岁儿童。这与先前报道的年龄分布特点一致[6,7,10]。推测可能与3岁以下婴幼儿呼吸系统免疫功能发育不全、呼吸道黏膜屏障易受外界侵袭有关。本研究结果同时表明不同季节卡他莫拉菌的分离率也存在很大差异,分离高峰出现在冬季,夏季分离阳性率低,与文献[11,12]报道基本符合。
本研究中,99.0%的分离株产β-内酰胺酶,与近年来报道的卡他莫拉菌产酶率一致[13]。EUCAST标准认为卡他莫拉菌β-内酰胺酶检测阳性即可判定为氨苄西林耐药,未制定该菌对氨苄西林的敏感性判定界值。本研究参照BSAC判定标准,菌株对氨苄西林的耐药率仅为68.3%,表明产酶率和BSAC氨苄西林MIC判断的耐药率之间存在较大差异。参考BSAC标准时,巴基斯坦采用琼脂稀释法检测出97株卡他莫拉菌株对氨苄西林的耐药率为84.5%[14];王艳等[15]采用纸片扩散法检测出79株卡他莫拉菌对氨苄西林的耐药率为89.2%。提示卡他莫拉菌对氨苄西林的耐药较常见。
常用卡他莫拉菌抗生素敏感性判定标准有3种:EUCAST、CLSI和BSAC。国内临床细菌抗生素药敏检测时常参照CLSI标准。以CLSI 2014标准判断,本研究101株卡他莫拉菌对AMC和头孢菌素类抗生素的敏感率高,超过90.0%,没有发现对环丙沙星不敏感的菌株,提示这些抗生素仍可经验性选择。但不同标准下,头孢呋辛、红霉素、SMZ-TMP等敏感性分布有明显不同,可能会对临床选药造成困难。因为判定标准的差异,也使得不同研究结果之间难于比较。但综合分析几家医院报道的卡他莫拉菌对几种常见抗生素的药敏监测结果发现,分离株对头孢菌素2代、3代及4代多有很高的敏感性[10,16],对阿莫西林-克拉维酸的敏感率达100%[16]。
由于受客观条件的限制,本研究中收集的标本没有实时接种培养,可能使得卡他莫拉菌的总分离率偏低,但因为收集标本数量足够多,最终分离阳性率也达到9.6%,因此结果中揭示的不同年龄段和不同月份的分离率差异仍然是客观和可信的。
综上,重庆酉阳地区呼吸道感染住院患儿≤3岁儿童鼻咽部携带卡他莫拉菌较其他年龄段更为常见,冬季多见;99.0%的分离株产β-内酰胺酶,但对阿莫西林-克拉维酸全部敏感。当前卡他莫拉菌抗生素敏感性检测结果的解释采用的判断标准存在较大差异,结果解释和监测报告中应予以说明,提示对于该菌抗生素敏感性判定标准还需要进一步研究。



























