
EB病毒(EBV)除引起传染性单核细胞增多症外,还与多种恶性肿瘤相关。EBV的实验室检测方法不断提高,并被用于EBV相关疾病的诊断、治疗和预后评估以及预防。针对不同的疾病,如何选择适当的临床样本和实验室检测方法,对于EBV相关疾病的诊断和治疗十分重要。现对EBV的实验室检测方法以及几种主要儿童EBV相关疾病的实验室诊断作一介绍。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
EB病毒(Epstein-Barr virus,EBV)首次于1964年从非洲Burkitt′s淋巴瘤患者中分离获得,其一旦感染,终生潜伏,除可以引起传染性单核细胞增多症(infectious mononucleosis, IM)外,还与多种恶性肿瘤发生相关。针对不同的EBV感染相关疾病,如何选择适当的临床样本和实验室检测方法,对于EBV相关疾病的诊断和治疗十分重要。现对EBV的实验室检测方法以及几种主要儿童EBV相关疾病的实验室诊断作一介绍。
EBV又称人类疱疹病毒4型,人类是其唯一宿主。EBV是双链DNA病毒,基因组长172 kb,在病毒颗粒中呈线性分子,感染细胞后,其DNA发生环化并能自我复制。淋巴细胞中潜伏感染的EBV可表达2种基因(EBV编码2种早期RNA,即EBV-encoded Epstein-Barr virus early RNA,包括EBER1和EBER2),6种核抗原(EBNA1、EBNA2、EBNA3A、EBNA3B、EBNA3C和LP),3种潜伏膜蛋白(latent membrane protein,LMP),包括LMP1、LMP2A、LMP2B。超过90%的个体在20岁之前感染过EBV,多数人表现为无症状的感染或自限性的IM,但少数人可引起慢性活动性EBV感染(chronic active EBV,CAEBV)和EBV相关噬血淋巴组织细胞增生症(EBV-associated hemophagocytic lymphohistiocytosis,EBV-HLH)等非肿瘤性重症EBV相关疾病。EBV还与许多恶性肿瘤的发生相关,如霍奇金淋巴瘤(Hodgkin lymphoma,HL)、非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)、鼻咽癌(nasopharyn-geal carcinoma,NPC)、胃癌、移植后淋巴细胞增殖症(post-transplant lymphoproliferative disorder,PTLD)等。
EBV原发感染后会建立终身潜伏感染。EBV潜伏感染可被大致分为4种类型。在健康的EBV既往感染个体,EBV在记忆性B淋巴细胞中潜伏感染,只表达EBV编码的小RNA(EBERs),称为EBV潜伏0型。在EBV感染相关疾病中,EBV有3种潜伏类型。潜伏Ⅰ型,除EBERs外,EBV只表达EBNA1和BamHI A右侧片段(BARTs),如Burkitt′s淋巴瘤;潜伏Ⅱ型,EBV表达EBNA1、LMP1、LMP2、BARTs和EBERs,如鼻咽癌、霍奇金淋巴瘤;潜伏Ⅲ型,EBV表达所有的潜伏基因,如免疫抑制患者的淋巴组织增生性疾病(表1)[1]。

EBV感染类型与EBV相关疾病
Patterns of EBV infection and EBV-associated diseases
EBV感染类型与EBV相关疾病
Patterns of EBV infection and EBV-associated diseases
| 潜伏类型 | EBV相关基因 | 疾病名 | ||||||
|---|---|---|---|---|---|---|---|---|
| EBNA1 | EBNA2 | EBNA3S | LMP1 | LMP2 | BARTs | EBERs | ||
| 潜伏0型 | - | - | - | - | - | ± | + | 健康携带者 |
| 潜伏Ⅰ型 | + | - | - | - | - | + | + | Burkitt′s淋巴瘤 |
| 潜伏Ⅱ型 | + | - | - | + | + | + | + | 霍奇金淋巴瘤 |
| 鼻NK细胞淋巴瘤 | ||||||||
| 慢性活动性EBV感染 | ||||||||
| 鼻咽癌 | ||||||||
| 潜伏Ⅲ型 | + | + | + | + | + | + | + | 传染性单核细胞增多症 |
| 移植后淋巴细胞增殖症 | ||||||||
注:EBV:EB病毒;EBNA:EB病毒核抗原;LMP:潜伏膜蛋白;BARTs:BamHI A右侧片段;EBERs:EBV编码的小RNA;NK细胞:自然杀伤细胞
EBV:Epstein-Barr virus;EBNA:EBV nuclear antigen;LMP:latent membrane protein;BARTs:BamHI A rightward transcripts;EBERs:EBV encoded small RNAs;NK:natural killer
国外也称"Monospot"试验。该抗体是一种IgM抗体,可以凝集马或绵羊的红细胞,该抗体水平在病程2~5周达到高峰,随后迅速下降,但是少数患者可以持续6~12个月。在成人和青少年,85%~90%的EBV感染者会出现嗜异凝集抗体;但是约50%的2~5岁儿童EBV感染后此抗体为阳性,而<2岁儿童EBV感染后此抗体阳性率仅10%~30%[2]。因此,该抗体在低年龄儿童原发性EBV感染所致IM的诊断价值不大。
EBV编码多种结构抗原,包括衣壳抗原(capsid antigen,CA)、早期抗原(early angtigen,EA)、膜抗原(membrane antigen,MA)、核抗原(nuclear antigen,NA)等。
机体感染EBV后针对不同的抗原产生相应的抗体(图1)[3]。原发性EBV感染过程中首先产生针对病毒衣壳抗原(VCA)的IgG和IgM(抗VCA-IgG/IgM);在急性感染晚期,抗EA复合物抗体出现;在恢复期晚期,抗EBV核抗原(EBNA)复合抗体产生。抗VCA-IgG和抗EBNA-IgG可持续终身。EBV特异性抗体检测方法包括免疫荧光法、酶联免疫法、化学发光法等。
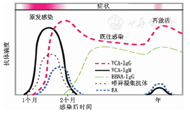
Serological titers distinguish Epstein-Barr virus primary infection from remote infection

注:VCA:病毒衣壳抗原;EBNA:EB病毒核抗原;EA:早期抗原
VCA:viral capsid antigen;EBNA:Epstein-Barr virus nuclear antigen;EA:early antigen
Serological titers distinguish Epstein-Barr virus primary infection from remote infection
血清特异性抗体检测通常用来判断EBV感染状态。对于免疫功能正常的患者,一般情况下VCA-IgM、VCA-IgG、EBNA-IgG 3个抗体的检测结果可以区分EBV原发感染和既往感染:VCA-IgG、VCA-IgM抗体阳性而EBNA-IgG阴性提示EBV原发感染,VCA-IgM阴性而VCA-IgG和EBNA-IgG阳性则是典型的EBV既往感染抗体类型(表2)[2]。但有的病例VCA-IgM产生延迟,有的持续缺失或长时间存在,并且EBV再激活时也可能出现VCA-IgM,VCA-IgM有时也会出现假阳性(如人巨细胞病毒感染时);约5%的健康携带者缺失EBNA-IgG抗体,另外免疫抑制患者EBNA-IgG抗体也可能丢失或水平很低;有的既往感染过EBV的患者VCA-IgG可能为阴性[4,5]。因此,EBV感染后血清学反应复杂多样,有时给抗体结果解释,尤其是单份血清的抗体结果解释带来困难。
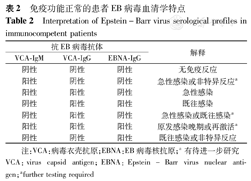
免疫功能正常的患者EB病毒血清学特点
Interpretation of Epstein-Barr virus serological profiles in immunocompetent patients
免疫功能正常的患者EB病毒血清学特点
Interpretation of Epstein-Barr virus serological profiles in immunocompetent patients
| 抗EB病毒抗体 | 解释 | ||
|---|---|---|---|
| VCA-IgM | VCA-IgG | EBNA-IgG | |
| 阴性 | 阴性 | 阴性 | 无免疫反应 |
| 阳性 | 阴性 | 阴性 | 急性感染或非特异反应a |
| 阳性 | 阳性 | 阴性 | 急性感染 |
| 阴性 | 阳性 | 阳性 | 既往感染 |
| 阴性 | 阳性 | 阴性 | 急性感染或既往感染a |
| 阳性 | 阳性 | 阳性 | 原发感染晚期或再激活a |
| 阴性 | 阴性 | 阳性 | 既往感染或非特异反应 |
注:VCA:病毒衣壳抗原;EBNA:EB病毒核抗原;a有待进一步研究
VCA:virus capsid antigen;EBNA:Epstein-Barr virus nuclear antigen;afurther testing required
机体在初次接触病原体时产生特异性IgG抗体的亲和力随着免疫反应的成熟会逐渐升高,EBV特异性IgG抗体亲和力的检测也可帮助鉴别原发感染和既往感染。有研究报道,原发性急性EBV感染患者在刚刚出现临床症状时,抗VCA-IgG抗体均为低亲和力;在出现临床症状10 d内,90%以上的患者可检测到抗VCA-IgG低亲合力抗体;在病程20~30 d后,50%患者的抗VCA-IgG抗体仍为低亲合力抗体;既往感染病例血清中抗VCA-IgG抗体则均为高亲和力抗体[6]。因此,低亲合力抗体的检出提示原发性急性感染。联合抗EBNA-IgG阴性和低亲合力抗VCA-IgG抗体,其诊断原发性EBV感染的敏感性和特异性可达到100%[7]。因此,根据EBV感染过程中抗体产生的不同动力学特点,同时检测患者血清中4种抗EBV抗体(抗VCA-IgG/IgM、抗EA- IgG、抗EBNA-IgG)和抗VCA-IgG亲合力可以提高诊断原发性EBV感染的敏感性和特异性[8]。抗体亲和力检测也存在局限性:对于不同个体,抗体成熟率不同;新生儿及小婴儿由于母传抗体的存在也不适用抗体亲和力检测。
EBV核酸载量测定(最常用的标本是外周血)已经被广泛应用于EBV相关疾病的预防、诊断、监测和评估治疗效果,判断预后等。
1999年Kimura等[9]首次报道采用实时荧光定量PCR(RT-PCR)检测EBV,是目前最主要的检测EBV核酸载量的方法,具有快速、操作简便、准确性好、实验室污染风险小的优点。虽然EBV-DNA和EBV-RNA均可被用来进行EBV核酸载量检测,但是最常用于检测的是EBV-DNA。但也有报道,BARF-1 mRNA的检测在鼻咽癌患者的无创诊断中可能有其应用价值,BARF-1 mRNA仅在肿瘤上皮细胞中表达,比血浆EBV-DNA检测的诊断敏感性更高[10]。
到目前为止,已经有超过25种不同的RT-PCR方法用于EBV核酸载量检测,并且市场上也已有多种商品化EBV核酸载量RT-PCR检测试剂盒[11]。EBV核酸载量检测的不同方法使用的标准品也有所不同,如Namalwa细胞(Burkitt′s淋巴瘤二倍体细胞系,每个细胞含2个完整EBV基因组)、质粒、其他细胞(如Raji细胞)或电镜计数的病毒颗粒等。由于缺乏标准化,使用不同标准品的不同检测方法得到的EBV核酸载量有很大差别。2011年10月,第1个EBV的WHO国际标准品面市(NIBSC code:09/260),可用于不同EBV核酸载量检测方法中二级标准品的校准,该标准品为B95-8株EBV制备的冻干品[12]。
此外,不同的EBV核酸载量检测方法所检测的靶基因也不同,最常检测的EBV靶基因包括BALF-5基因(编码胸苷激酶)、BamHI-W基因、EBNA-1基因或EBER1基因。但是,因为不同EBV病毒株BamHI-W存在6~20次重复序列,针对该基因的EBV核酸载量检测可能过高,所以一般不建议使用该基因序列进行EBV核酸载量检测。为了更为准确地检测EBV核酸载量,推荐使用单拷贝并且高度保守的基因区域,如EBNA-1或BALF-5基因。采用针对不同基因的EBV核酸载量检测方法,得到的EBV拷贝数可能存在很大差别[13]。因此,尽管已经有了第1个EBV国际标准品,EBV核酸载量的测定仍然面临问题,尚需进一步进行标准化,从而使不同实验室得到的EBV载量结果具有可比性。
EBV核酸载量检测采用的标本主要是外周血,包括全血、血浆或血清、外周血单个核细胞(PBMC),此外有些疾病可以对脑脊液标本进行检测。对于不同EBV相关疾病进行核酸载量检测所采用的最适合的标本类型有所不同(表3)[14]。

不同EBV相关疾病中适于检测EBV载量的标本
Best blood compartment for EBV-load measurement in different EBV-associated diseases
不同EBV相关疾病中适于检测EBV载量的标本
Best blood compartment for EBV-load measurement in different EBV-associated diseases
| 项目 | 全血 | 血浆/血清 | PBMC | 脑脊液 | 应用 | |
|---|---|---|---|---|---|---|
| 原发感染 | ||||||
| 传染性单核细胞增多症 | -- | ++ | -- | 原发感染,对诊断并非必要与疾病严重程度相关 | ||
| EBV-HLH | ++ | 诊断和判断治疗反应 | ||||
| 慢性活动性EBV感染 | ++ | ++ | 诊断(PBMC) | |||
| 疾病严重程度和预后 | ||||||
| 免疫正常患者 | ||||||
| 鼻咽癌 | ++ | 治疗反应 | ||||
| 预后因素/总体生存率 | ||||||
| 鼻T/NK细胞淋巴瘤 | ++ | -- | 分期和预后 | |||
| 监测治疗反应和复发 | ||||||
| 霍奇金淋巴瘤 | ++ | 治疗反应和预后 | ||||
| B-非霍奇金淋巴瘤 | + | + | + | 诊断,预后和随访 | ||
| 免疫缺陷患者 | ||||||
| 移植患者和PTLD | ++ | +/- | + | 免疫抑制治疗的指导 | ||
| 预测/提示PTLD | ||||||
| PTLD对治疗的反应 | ||||||
| 监测EBV再激活 | ||||||
| 预防移植物抗宿主病 | ||||||
| 预防移植排异 | ||||||
| 艾滋病相关淋巴瘤 | +/- | +/- | EBV载量检测的作用还不清楚 | |||
| 可能用于治疗反应和预后 | ||||||
| 全身B-淋巴瘤的预后 | ||||||
| 艾滋病相关原发中枢神经 | ||||||
| 系统淋巴瘤 | -- | -- | ++ | 诊断 | ||
| X-连锁淋巴增殖症 | ++ | ++ | 至少每6个月1次监测EBV原发感染,HLH或PTLD | |||
注:EBV:EB病毒;PBMC:外周血单个核细胞;HLH:噬血淋巴组织细胞增生症;NK细胞:自然杀伤细胞;PTLD:移植后淋巴细胞增殖症;--:无数据支持;++:推荐;+:有数据支持应用;+/-:有争议
EBV:Epstein-Barr virus;PBMC:peripheral blood mononuclear cell;HLH:hemophagocytic lymphohistiocytosis;NK:natural killer;PTLD:post-transplant lymphoproliferative disease;--:no data that support recommendation; ++:recommended;+:data that support application; +/-:controversial
EBERs(EBER1/EBER2)是EBV编码的小分子RNA,并不编码蛋白质。EBERs大量存在于EBV潜伏感染的细胞中,每个细胞可达106~107拷贝,是EBV潜伏感染的最好标志物,其主要功能是抑制干扰素介导的抗病毒效应和凋亡。因此,原位杂交检测EBERs能够定位肿瘤细胞存在EBV,是明确肿瘤与EBV相关的金标准。不同EBV相关疾病中EBERs原位杂交的检出情况见表4[3]。

EB病毒相关疾病
Epstein-Barr virus-associated diseases
EB病毒相关疾病
Epstein-Barr virus-associated diseases
| 疾病名称 | EB病毒相关病例(%) | |
|---|---|---|
| 癌症和软组织肉瘤 | ||
| 鼻咽癌(亚洲) | >95 | |
| 鼻咽癌(美国) | 75 | |
| 胃腺癌 | 7 | |
| 艾滋病/移植患者平滑肌肿瘤 | >95 | |
| 霍奇金淋巴瘤 | 40 | |
| 混合细胞型 | 70 | |
| 结节硬化型 | 20 | |
| 淋巴细胞为主型 | <5 | |
| 淋巴细胞削减型 | 50 | |
| 艾滋病相关霍奇金淋巴瘤 | >95 | |
| 非霍奇金淋巴瘤及相关肿瘤 | 5 | |
| 弥散大B淋巴细胞型 | 15 | |
| Richter综合征(转移淋巴瘤) | 15 | |
| 艾滋病相关非霍奇金淋巴瘤 | 40 | |
| 移植后淋巴增殖症 | 95 | |
| 结外自然杀伤/T细胞淋巴瘤(鼻型) | >95 | |
| Burkitt′s淋巴瘤(非洲) | >95 | |
| Burkitt′s淋巴瘤(北美) | 20 | |
| 艾滋病相关Burkitt′s淋巴瘤 | 30 | |
| 艾滋病相关脑淋巴瘤 | 95 | |
| 免疫正常个体脑淋巴瘤 | 5 | |
IM是原发性EBV感染引起的急性自限性疾病,其典型临床表现为发热、咽峡炎和颈淋巴结大三联征,外周血淋巴细胞显著增多,并出现异常淋巴细胞,可合并肝脾大。多数预后良好,少数可出现严重并发症,如噬血淋巴组织细胞增生症(HLH)。
12岁以下IM患儿,只有25%~50%此抗体呈阳性。国内儿童IM的发病高峰年龄为4~6岁,因此该抗体检测在国内儿童IM的诊断中价值不大[15]。并且此抗体检测缺乏特异性,其他急性感染、自身免疫性疾病或肿瘤等也可能呈阳性反应[16,17]。
对于免疫功能正常的患者,EBV特异性抗体检测仍然是诊断IM的金标准。但是,如前所述,EBV感染后的血清学反应复杂多样,根据EBV感染过程中产生抗体的不同动力学特点,同时检测患者血清中4种EBV特异性抗体(抗VCA-IgG/IgM、抗EA-IgG、抗NA-IgG),并可结合抗VCA-IgG亲合力检测,从而提高原发性EBV感染诊断的敏感性。全国儿童EBV感染协作组提出的关于IM的诊断标准[15]中,EBV特异性抗体检测指标包括(1)抗VCA-IgM和抗VCA-IgG阳性,且抗EBNA-IgG阴性;或(2)抗VCA-IgM阴性,但抗VCA-IgG阳性,且为低亲和力抗体;或(3)双份血清抗VCA-IgG抗体滴度4倍以上升高。
Bauer等[18]的研究结果显示,出现临床症状12 d内IM患者血清中可检测到EBV核酸,病程22 d后,IM患者血清中均检测不到EBV核酸,EBV核酸载量与病程呈负相关。因此,EBV核酸载量检测对诊断IM的阴性预测值很低,不必常规进行检测,仅对EBV抗体检测结果难以解释的病例可能有所帮助[14]。
没有必要进行此项检查。
CAEBV是一种严重的EBV感染疾病,其临床表现是IM样症状持续或反复发作,并逐渐出现各种器官的慢性损害,如持续性肝功能损害、多发性淋巴结病、肝脾大、噬血细胞综合征、视网膜炎、间质性肺炎、牛痘样水疱及蚊虫过敏等。该病预后不良,少数患者最后发生恶性淋巴增殖性疾病。
异常的EBV抗体水平是CAEBV的诊断标准之一。1988年Straus[19]提出的CAEBV诊断标准中,抗VCA-IgG≥1∶5 120,抗EA-IgG≥1∶640或EBNA-IgG<1∶2(阴性)。由于随后的研究显示,许多CAEBV病例血清EBV抗体检测结果不能达到上述诊断标准。2005年Okano等[20]提出的CAEBV感染诊断指南中对EBV抗体滴度进行了修订:抗VCA-IgG≥1∶640和抗EA-IgG≥1∶160;抗VCA-IgA和/或EA-IgA通常也为阳性。上述EBV抗体滴度的检测方法均为免疫荧光方法,临床中可操作性差,EBV核酸载量检测在CAEBV诊断中的价值越来越大。
CAEBV患者外周血中EBV载量较健康携带者明显升高。Kimura等[21]对30例CAEBV患者的研究发现,CAEBV患者PBMC中EBV-DNA均为阳性,且高于102.5拷贝/μg DNA,尽管多数CAEBV患者PBMC中的EBV-DNA与血浆中EBV-DNA有较好的相关性,但是有6例患者血浆中EBV-DNA检测为阴性。外周血PBMC和血浆/血清均可被用来检测EBV核酸载量,但PMBC中EBV-DNA水平有助于CAEBV的诊断。CAEBV患者血浆/血清中EBV-DNA水平与病情严重程度和预后有关[22]。
CAEBV患者受累器官和外周血中EBV感染的B/T/NK等细胞中EBERs阳性。根据EBV感染的细胞类型,有助于CAEBV分型。
EBV-HLH是淋巴细胞、巨噬细胞异常增生和活化,免疫反应过度伴随吞噬血细胞现象的一类综合征,临床特征为持续性发热,肝、脾、淋巴结大,肝功能异常,水肿,胸腔积液及腹水,血细胞减少,凝血障碍,高三酰甘油血症,血清铁蛋白升高,自然杀伤细胞(NK细胞)细胞无活性或活性降低等。
EBV原发感染和再激活均可引起EBV-HLH,因此EBV-HLH患者血清特异性EBV抗体反应呈多种反应类型。Imashuku[23]报道94例EBV-HLH患者中,60例患者血清EBV抗体呈VCA-IgM阴性的EBV既往感染,34例患者为VCA-IgM/EADR-IgG阳性的原发感染和EBV既往感染再激活。
EBV-HLH患者外周血PBMC和血清中均含有很高的EBV核酸载量,而且EBV核酸载量与治疗反应具有很好的相关性,因此监测血清中EBV-DNA载量有助于评估治疗效果[1]。在HLH患者,EBV可以感染T淋巴细胞或NK细胞,因此有条件的实验室可以检测不同淋巴细胞如B/T/NK细胞中的EBV核酸载量帮助诊断。
EBV-HLH患者受累器官和外周血中EBV感染的B/T/NK等细胞中EBERs阳性。
PTLD是实体器官移植或骨髓移植、造血干细胞移植后发生的一种严重并发症,是移植后持续免疫缺陷下发生的一种由增生性到肿瘤性的淋巴系统增殖。实体器官移植后患者PTLD的发生率为1%~30%,造血干细胞移植后患者PTLD的发生率为1%~22%,其病死率很高。约90%的PTLD与EBV有关[14]。
移植患者由于接受免疫抑制治疗,体液免疫反应不足,并且由于可能接受输血或者输注免疫球蛋白的治疗也会干扰血清抗体的检测结果,因此移植患者发生原发EBV感染时,血清特异性抗体检测的价值有限[2]。
绝大多数PTLD患者全血或血浆/血清中存在高水平的EBV核酸载量。EBV核酸载量检测已经成为移植后患者尤其是存在PTLD高危因素(接受移植时EBV血清阴性,接受强力免疫抑制治疗等)患者的常规监测项目[24]。EBV核酸载量检测对于诊断移植患者原发EBV感染十分重要。第2届欧洲白血病感染会议上提出的指南中,造血干细胞移植患者术后即应开始常规EBV核酸载量监测,每周1次,至少3个月,甚至更长时间[25]。尽管EBV核酸载量检测并不是PTLD确诊的标准,但是EBV核酸载量可以作为PTLD监测指标,甚至是在出现PTLD症状和体征前,高水平EBV核酸载量可能提示即将发生PTLD,可开始优先干预治疗(如降低免疫抑制治疗的强度、进行抗病毒治疗和输注抗CD20抗体等),从而避免PTLD的发生或防止其进展。Ruf等[26]比较了心脏移植和造血干细胞移植术后患者的全血、PBMC以及血浆中EBV核酸载量监测的结果,全血和PBMC中EBV核酸载量的结果具有较好的相关性,而血浆标本的检测结果与全血和PBMC的相关性较差,认为全血标本是移植后患者PTLD的监测的最佳标本,具有更好的敏感性,但是其阳性预测值较低,特异性较差。结合全血和血浆标本的EBV核酸载量检测结果,可以提高诊断PTLD的敏感性和特异性。EBV载量检测全血标本≥20 000 000拷贝/L联合血浆标本≥1 000 000拷贝/L,其敏感性为100%,特异性为94%(阳性预测值=50%,阴性预测值=100%)。对于何时应开始(EBV核酸载量阈值)优先治疗目前也尚无统一的标准。相对于某一次的核酸载量结果,EBV核酸载量动态变化(如核酸载量迅速增高>1 log/周)可能也是很重要的[22]。血浆中EBV核酸载量监测有助于评估PTLD治疗效果[24]。
组织活检病理是PTLD诊断的金标准,EBERs原位杂交是唯一能够定位肿瘤细胞中存在EBV的实验室方法,从而明确PTLD是EBV相关。
了解EBV的生物学特性及细胞免疫和体液免疫特点,熟悉不同EBV感染实验室诊断方法的优缺点,根据不同疾病和病程合理选择和运用EBV感染的实验室诊断方法,这对儿童EBV感染相关疾病的诊治极为重要。



























