
n-3多不饱和脂肪酸(n-3 PUFAs)作为膳食必需脂肪酸,具有广泛的生物学功能;现代人膳食n-3 PUFAs摄入处于相对或绝对缺乏状态。生命早期足量n-3 PUFAs的摄入,不仅对于保证胎儿及婴幼儿的正常生长发育至关重要,还有助于预防儿童青少年期注意力缺陷多动障碍、哮喘及过敏性疾病、高脂血症、非酒精性脂肪肝等慢性非感染性疾病的发生。人体利用前体亚麻酸(LNA)合成极长链的二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的能力有限,必须摄取现成的EPA和DHA以满足机体的需求。对于孕妇以及婴幼儿来说,补充DHA和EPA的比例宜保持在5∶1以上。临床上,EPA和DHA已被用于上述这些慢性非感染性疾病的辅助治疗,可有效改善临床表现。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
n-3(Ω-3)多不饱和脂肪酸(n-3 polyunsaturated fatty acids,n-3 PUFAs)作为人体必需脂肪酸,自从20世纪60、70年代被发现有助于降低心血管系统疾病发病率和病死率以来,人们对n-3 PUFAs进行了大量的研究,发现其具有广泛的生物学功能,不仅在调节脂代谢、免疫、炎性反应等方面起重要作用,而且对脑发育及其功能也至关重要[1,2]。现代人n-3 PUFAs摄入减少或与n-6 PUFAs比例失调,是当今社会心血管系统疾病、糖尿病、肥胖、癌症、免疫性疾病及神经退行性疾病等多种慢性非传染性疾病发生的高危因素之一[3]。生命早期特别是胎儿期和婴幼儿期是n-3 PUFAs在体内聚集的关键时期,保证n-3 PUFAs充足摄入,不仅可以促进视网膜、脑、免疫等各器官系统的良好发育,还可以预防注意力缺陷多动障碍(ADHD)、哮喘及过敏性疾病、高脂血症、非酒精性脂肪肝等儿童期慢性病的发生[4]。
人体必需脂肪酸包括n-3和n-6两大系列,n-3 PUFAs主要包括极长链的二十碳五烯酸(EPA)(C20:5n-3)、二十二碳六烯酸(DHA)(22:6n-3)及其前体亚麻酸(LNA)(C18:3n-3);n-6 PUFAs主要包括花生四烯酸(AA)(20:4n-6)及其前体亚油酸(LA)(C18:2n-6)等。这2类脂肪酸的食物来源和含量分布不同,n-6 PUFAs广泛存在于各类食物中,以大豆、玉米、葵花籽等植物油中含量最为丰富;而n-3 PUFAs的食物分布较局限,仅存在于鱼类等海产品、母乳及亚麻油、大豆油等少数植物油中。需要注意的是鱼类等海产品富含EPA和DHA(二者比例为3∶2),而植物油富含的是LNA。这2类脂肪酸在机体各组织中的含量存在差异,DHA在脑、精子、视神经和视网膜中含量最为丰富,AA则富含于大多数组织中;EPA、LNA和LA由于发挥代谢分解、氧化供能等作用而在各组织中的含量均很低。研究表明,机体(主要是肝脏)可以利用LA和LNA为前体,在Δ6、Δ5等去饱和酶和链延长酶的作用下分别合成AA、EPA和DHA,但EPA和DHA的合成能力有限(为1%~5%以下),远低于AA,特别是在胎儿、婴幼儿和儿童期。因此,机体仍需外源性直接获取EPA和DHA,以满足脑发育和机体其他生命活动的需要。然而,要使EPA和DHA在血浆和组织中达到饱和,所需要的补充量及时间存在差异,如成人摄入2 g/d,血浆达到饱和的时间为1个月,组织达到饱和的时间为3~6个月,而乳汁达到饱和的时间只需1周[1,3,5]。可见,哺乳期母亲补充n-3 PUFAs,很快就能使乳汁饱和,以满足婴儿的需求。
脑是富含脂质的组织器官之一,脂质含量仅次于脂肪组织,其在脑组织中的含量占脑干重的50%~60%。从脂肪酸组成看,AA和DHA含量占脂肪酸总量的25%~30%(二者比例为2∶3)。哺乳动物脑中高含量的DHA主要来源于膳食摄入与肝脏合成,尽管脑自身(胶质细胞和内皮细胞)可有少量合成[5]。胎儿期和婴幼儿期是脑聚集DHA的关键时期,其中孕后期到出生后6个月内是聚集的高峰时期,这与脑重量快速增加和发育的关键时期相一致。孕后期胎儿聚集DHA的速度可达到50~60 mg/d,出生后前6个月脑DHA聚集的速度约为10 mg/d,整个机体DHA聚集速度约为20 mg/d。健康足月新生儿脂肪组织储存有大约1 g DHA,在无外源性DHA摄入的情况下,仅能支持身体2个月生长发育所需。早产或低体质量儿因储积的DHA较少,如不及时补充,则会影响脑等组织器官的发育和功能[6]。
n-3 PUFAs的生物学功能涉及氧化供能、参与生物膜构建、调节炎症、免疫反应、脂代谢、脑发育和功能维持等多个方面,在许多慢性疾病的发生发展过程中起积极作用。n-6 PUFAs中的AA在环氧化酶等作用下生成2-系列前列腺和血栓素(TXA2、PGE2、PGI2)及4-系列白三烯(LTB4、LTC4、LTE4),具有较强的致炎作用;而n-3 PUFAs中的EPA则在同样酶的作用下生成3-系列前列腺素和血栓素及5-系列白三烯(LTB5、LTC5、LTE5),致炎作用很弱,这就意味着n-3 PUFAs可在一定程度上拮抗n-6 PUFAs的致炎作用。此外,EPA和DHA还可分别衍生为脂类活性分子,如E-resolvins(RvEs)、D-resolvins(RvDs)、protectin D1(PD1)等,发挥较强的抗炎作用[1]。现代西方膳食中n-6 PUFAs摄入较多,而n-3 PUFAs摄入较少,被称之为"致炎"膳食模式,是导致肥胖、心血管疾病、糖尿病等慢性疾病发生的高危因素之一[3]。
EPA和DHA还可通过作用于氧化物酶体增殖因子活化受体(PPARs)、甾醇应答元件结合蛋白(SREBPs)、CCAAT增强子结合蛋白(C/EBPs)、肝脏X受体(LXR)、核转录因子-KappaB(NF-κB)等转录因子以及影响表观遗传修饰过程,发挥对多种基因的表达调控,从而抑制IL-1β和IL-6、肿瘤坏死因子(TNF)、C反应蛋白等炎性因子的释放,增加胰岛素敏感性、抑制脂质合成、脂肪细胞增殖等。此外,EPA和DHA还可直接与G蛋白偶联受体120(GPR 120)结合,调节M2型单核巨噬细胞的抗炎性反应及脂肪细胞胰岛素的敏感性[3]。
在脑中,n-3 PUFAs除了主要作为神经细胞膜磷脂的组成成分以外,还具有调控神经递质和皮质激素释放激素合成与释放、抑制蛋白激酶、通过迷走神经途径调节心率、促进脑血循环和氧供应、抑制神经元凋亡、影响能量交换、促进髓鞘发育和神经细胞增殖分化、抗炎等多种功能。比如n-3 PUFAs可调控多巴胺、血清素等单胺类神经递质生成,影响其受体功能及其介导的细胞信号转导过程,同时还可以降低神经系统炎性反应发生的程度等[7]。
膳食脂肪酸摄入随着人类的进化发展而发生变化。自工业化以来,人们膳食饱和脂肪酸、n-6 PUFAs及反式脂肪酸急剧增加,而n-3 PUFAs摄入减少,n-6/n-3 PUFAs比值明显升高,达15∶1~25∶1,远高于远古时期人类膳食中的比例1∶1~2∶1。鉴于n-3 PUFAs的食物分布局限性及人体合成EPA、DHA的能力有限,因而人们膳食n-3 PUFAs摄入容易发生绝对或相对不足,特别是对于现代西方膳食模式。整个人群膳食EPA和DHA的摄入量存在地区差异,北美地区最低(140 mg/d),北欧和日本最高(600~900 mg/d)。就孕期妇女极长链n-3 PUFAs摄入量来看,即使在海产品摄入较多的山东日照地区,DHA+EPA的摄入量也只有150 mg/d(推荐摄入量的一半),而日本孕妇的摄入量高达500 mg/d,这也决定了母乳中DHA和EPA的含量差异。我国江苏句容(河湖地区)、山东日照(沿海地区)和河北徐水(内陆地区)三地成熟乳DHA含量分别为0.41%、0.47%和0.24%,处于全球平均0.31%的水平;而日本则高达1.1%,北美地区最低为0.1%[8,9,10]。
已证实母孕期n-3 PUFAs缺乏可导致胎儿宫内发育迟缓,与低出生体质量密切相关[11]。母孕期补充EPA和DHA可降低胎儿病死率及早产发生的风险,但对胎儿生长发育的影响报道尚不一致。多数认为母孕期补充鱼油n-3 PUFAs可以抑制胎儿的体质量增加,这可能在于鱼油中EPA成分的作用,这就是为什么在孕期不宜摄入过多EPA、婴儿配方奶粉中不加EPA的原因之一。通常认为,孕期和哺乳期及婴幼儿期摄入DHA和EPA的比例宜保持在5∶1以上。另外,还有研究表明,足量n-3 PUFAs补充可促进身体快速发育期(婴幼儿、青少年期)骨的形成,减少骨流失[12]。动物实验还指出n-3 PUFAs可减少脂肪的形成,减轻体质量[13]。n-3 PUFAs与婴幼儿生长发育的临床试验结果尚存在分歧,原因可能在于样本量较小、观察时间较短、生长发育测量标准不统一等。因此,n-3 PUFAs补充对儿童生长发育的影响研究仍需要大样本、长期的随访观察。
有关n-3 PUFAs与视觉及认知系统发育的研究,起初人们发现婴幼儿缺乏DHA、AA等脂肪酸,容易出现生长发育迟缓、视觉功能障碍及神经系统发育异常。随后动物实验发现,n-3 PUFAs摄入缺乏可导致脑中多个区域(如小脑、髓质、下丘脑、纹状体、海马、皮质、中脑等)及视网膜中DHA水平明显降低,下降程度可达39%~63%;并且水迷宫试验表现出潜逃时间延长、空间学习、记忆和认知功能的下降[14,15]。随着研究的深入,人们发现生命任何阶段DHA缺乏均可影响脑功能,尤以生命早期特别是胎儿期及婴幼儿期的缺乏影响最为严重;同时生命早期n-3 PUFAs缺乏还会对视觉及认知功能产生长远的不良影响,后期即使给予补充,也不能使之提升至正常水平[16]。从人类进化的角度看,狩猎时代后期大量摄入鱼类等水产食物中丰富的EPA和DHA,在古猿到当今人类脑进化的过程中起了非常重要的作用[2]。
人群流行病学和临床试验研究显示,n-3 PUFAs缺乏及补充的时期越早,对脑发育和功能的影响也越大。目前,孕期和哺乳期母亲补充DHA以及婴幼儿期补充DHA能有效地提升婴幼儿认知及视觉发育,已有一致的报道;同时还可以降低母亲产后抑郁症的发生风险[17]。Helland等[18]研究显示,给予17~19周妊娠期的妇女补DHA 1 183 mg/d直至出生3个月,能明显提升其孩子4岁时的智能发育。美国Avon父母儿童队列研究(ALSPAC)也发现,母孕期海产品摄入>350 g/周时可明显提升儿童总智商以及语言、精细动作、社会交往方面的能力[19]。并且最新的研究指出,母体脐带血中高含量的DHA对婴儿出生后神经系统的发育会产生较长远的良好影响[20]。婴幼儿期DHA/AA添加配方奶粉喂养对视觉、认知、记忆及辨别性学习能力等有重要的提升作用;对于早产儿,需要使用更高DHA含量的配方奶粉喂养,才能发挥明显的作用[21]。然而,儿童期和成年期补充DHA对脑认知功能的影响,尚存在分歧;尽管如此,对于预防认知功能下降,会产生积极作用[14,15,17]。分歧产生的原因除了研究人群对象、遗传背景、机体n-3 PUFAs基础水平、干预时程长短、DHA添加剂量及n-6/n-3 PUAFs的比例平衡、海产品重金属污染等因素有关。
随着对n-3 PUFAs研究的深入,人们发现儿童注意力缺陷多动障碍(ADHD)、抑郁症、自闭症及孤独症谱系障碍等神经、精神类疾病的发生与n-3 PUFAs缺乏密切相关,同时n-3 PUFAs摄入量及其红细胞膜中含量与疾病的严重程度呈负相关。目前,大多数研究显示,应用EPA和DHA治疗能明显缓解ADHD、抑郁、精神分裂症患儿的症状,但对于自闭症、焦虑症、强迫症、进食障碍等其他精神性疾病,尚不能给予肯定的结论[22]。不管怎样,临床上已将n-3 PUFAs作为治疗精神类疾病的佐剂,可以减少相应药物的剂量,以降低其不良反应;对于不愿使用药物治疗的轻症患儿,可选择使用EPA和DHA治疗。通常,用于治疗儿童神经、精神类疾病的EPA和DHA剂量较大,为2~5 g/d。另有报道,n-3 PUFAs与适量维生素D联合使用,同时保持n-6/n-3 PUFAs的适宜比例,对于儿童精神类疾病的治疗更有效果[23]。动物实验还表明,补充EPA和DHA可减少缺氧缺血性脑损伤导致的脑梗死面积;在创伤性脑损伤前或后给予EPA和DHA补充,均可有效降低神经轴损伤及细胞死亡,改善损伤后脑的认知及空间记忆功能,机制主要与抑制炎性反应和氧化应激、参与损伤细胞修复等有关[24,25]。这对于推动n-3鱼油脂肪乳剂的临床研究及应用提供了依据。
婴幼儿早期变应性疾病的发生与异常的免疫系统发育密切相关。胎儿期Th1和Th2增殖分化的失衡,对儿童期及成年期的炎性疾病产生长远影响[17]。胎儿期及出生后未成熟的免疫系统对所处的免疫调控环境尤为敏感,母体饮食可影响胎儿免疫系统的发育。母体高水平的n-3 PUFAs可降低新生儿氧化应激,减少炎性因子LTB4生成及调控T淋巴细胞功能。自妊娠期18~22周起每天摄入400 mg n-3 PUFAs,可以降低婴儿干扰素(IFN)γ及IL-13表达,调控B淋巴细胞IgE合成及T淋巴细胞中Th2分化,抑制IgE介导的过敏反应和免疫应答,减轻过敏性疾病的症状。妊娠期补充n-3 PUFAs还可改变过敏反应建立前新生儿免疫系统的发育,尤其可以改变IgE抗体生成的基因易感性。妊娠期食用鱼类或补充EPA和DHA可降低婴幼儿湿疹、哮喘、食物及药物过敏的发生风险[26,27,28]。另外,n-3 PUFAs的足量摄入在预防和减轻日晒、皮肤灼伤、光敏性皮炎、皮肤衰老、皮肤癌及痤疮的发生、发展也具有一定的积极作用。
对于已经发生过敏和炎性疾病的患儿,临床上已有使用n-3 PUFAs治疗的报道。EPA和DHA可减少哮喘儿童肺部致炎因子的聚集,增加肺组织中脂质活性产物PD1和RvE1,减少呼吸道炎性反应,提升肺功能。给予风湿性关节炎患儿补充EPA和DHA,可明显降低体内的炎性细胞因子、前列腺素和白三烯水平,减轻关节疼痛、晨僵等症状,并可减少非固醇类抗炎药物的使用剂量和不良反应。对于炎性肠病,补充EPA和DHA可改善临床症状、肠道黏膜病理,降低复发率、减少糖皮质激素的用量。通常,用于治疗这些疾病的EPA和DHA剂量均很大,为1~7 g/d(平均3.5 g/d)[29]。
n-3 PUFAs通过调节胰岛素抵抗和糖代谢(增加胰岛素的敏感性)、调节脂质代谢,改善高脂血症、皮细胞功能、机体炎症状态和组织细胞抗氧化系统功能,在代谢综合征发生发展过程中起着积极的作用。n-3 PUFAs对血脂特别是三酰甘油代谢的调节作用,主要通过抑制肝脏内源性三酰甘油合成、增加脂蛋白脂酶的活性并加快乳糜微粒和极低密度脂蛋白的清除而实现的[25,30]。近年来,EPA和DHA已被用于高脂血症的治疗,对于轻中度的高三酰甘油血症患儿,首先进行生活方式(运动、饮食等)矫正和使用n-3 PUFAs治疗3~6个月。通常,补充EPA和DHA 2~4 g/d,可使血浆三酰甘油水平下降20%~30%[31]。
非酒精性脂肪肝(NAFLD)已成为发达国家儿童及青少年的常见慢性肝病,也是临床静脉营养支持治疗过程中的严重并发症。n-6 PUFAs摄入过量和n-3 PUFAs摄入不足在其发生发展过程中可能起重要作用[32]。近年来,有关利用n-3 PUFAs治疗儿童NAFLD的研究报道越来越多。大多数研究表明,EPA和DHA可缓解儿童NAFLD症状,如提升谷氨酸氨基转移酶(ALT)及天冬氨酸氨基转移酶(AST)活性、改善肝细胞异常的炎性反应及减轻肝脂肪沉积;如持续补充12个月(EPA和DHA 1 g/d),可以明显降低肝细胞的脂肪变性[33]。其作用机制在于,n-3 PUFAs通过结合或调控转录因子(SREBP-1c、PPARs及ChREBP)促进其活性或表达,从而改善脂代谢及胰岛素敏感性、增加肝脏β氧化、降低内源性脂质合成、减少炎性因子(TNF-α及IL-6)及活性氧自由基生成等,发挥其在NAFLD治疗中的积极作用。研究还表明,联合运动、益生菌及维生素E等其他治疗措施,更能提升n-3 PUFAs对儿童NAFLD的疗效[34]。
中国居民膳食n-3 PUFAs参考摄入量见表1[35],婴幼儿保证DHA 100 mg/d、孕妇和乳母保证EPA和DHA 250 mg/d(其中DHA 200 mg)摄入,以利于婴幼儿生长发育的需求。虽然未给出4~18岁儿童EPA和DHA的推荐摄入量,但根据世界卫生组织(WHO)/联合国粮农组织(FAO)的标准,推荐摄入量从4岁时的150 mg到10岁时的250 mg,再逐渐增加至成人水平[35]。婴儿配方奶粉中DHA和AA量(占总脂肪酸百分比)标准在各国家和地区的要求不一,DHA范围为0.2%~0.5%,AA为0.2%~0.7%,二者比值维持在1∶1~1∶2;对于早产儿来说,母乳及配方奶中DHA含量推荐最高可到1.5%[36]。
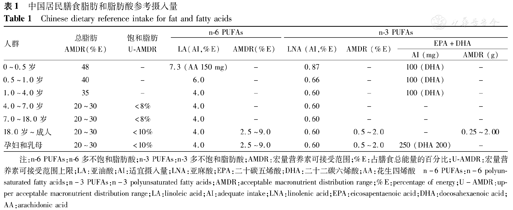
中国居民膳食脂肪和脂肪酸参考摄入量
Chinese dietary reference intake for fat and fatty acids
中国居民膳食脂肪和脂肪酸参考摄入量
Chinese dietary reference intake for fat and fatty acids
| 人群 | 总脂肪AMDR(%E) | 饱和脂肪U-AMDR | n-6 PUFAs | n-3 PUFAs | ||||
|---|---|---|---|---|---|---|---|---|
| LA(AI,%E) | AMDR(%E) | LNA (AI,%E) | AMDR (%E) | EPA+DHA | ||||
| AI (mg) | AMDR (g) | |||||||
| 0~0.5岁 | 48 | - | 7.3 (AA 150 mg) | - | 0.87 | - | 100 (DHA) | - |
| 0.5~1.0岁 | 40 | - | 6.0 | - | 0.66 | - | 100 (DHA) | - |
| 1.0~4.0岁 | 35 | - | 4.0 | - | 0.60 | - | 100 (DHA) | - |
| 4.0~7.0岁 | 20~30 | <8% | 4.0 | - | 0.60 | - | - | - |
| 7.0~18.0岁 | 20~30 | <8% | 4.0 | - | 0.60 | - | - | - |
| 18.0岁~成人 | 20~30 | <10% | 4.0 | 2.5~9.0 | 0.60 | 0.5~2.0 | - | 0.25~2.00 |
| 孕妇和乳母 | 20~30 | <10% | 4.0 | 2.5~9.0 | 0.60 | 0.5~2.0 | 250 (DHA 200) | - |
注:n-6 PUFAs:n-6多不饱和脂肪酸;n-3 PUFAs:n-3多不饱和脂肪酸;AMDR:宏量营养素可接受范围;%E:占膳食总能量的百分比;U-AMDR:宏量营养素可接受范围上限;LA:亚油酸;AI:适宜摄入量;LNA:亚麻酸;EPA:二十碳五烯酸;DHA:二十二碳六烯酸;AA:花生四烯酸
n-6 PUFAs:n-6 polyunsaturated fatty acids;n-3 PUFAs:n-3 polyunsaturated fatty acids;AMDR:acceptable macronutrient distribution range;%E:percentage of energy;U-AMDR:upper acceptable macronutrient distribution range;LA:linoleic acid;AI:adequate intake;LNA:linolenic acid;EPA:eicosapentaenoic acid;DHA:docosahexaenoic acid;AA:arachidonic acid



























