
再生障碍性贫血(AA)是一类以骨髓造血功能衰竭和全血细胞减少为特征的严重血液病。目前对缺乏全相合同胞供者的AA患者,多采用抗胸腺细胞球蛋白(ATG)联合环孢素的免疫抑制治疗(IST),约1/3的患者IST无效,且IST存在一定临床风险,严重不良反应可致ATG治疗相关死亡。因此,有必要开展有关IST的疗效预测研究,为临床提供较为明确的疗效预测指标,使IST病例选择更为合理,从而进一步提高远期疗效。现就近年来国内外IST疗效预测的相关研究进行综述,以期为临床IST提供参考,并为后续相关研究提供依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
再生障碍性贫血(AA)是一类以骨髓造血功能衰竭和全血细胞减少为特征的严重血液病。目前对缺乏全相合同胞供者的AA患者推荐使用抗胸腺细胞球蛋白(ATG)联合环孢素(CSA)为主的免疫抑制治疗(IST),约1/3的患者IST无效,需行造血干细胞移植或二次IST[1]。良好的疗效预测指标既可使IST病例选择更为合理,也有助于早期识别IST后无效患者,尽快进行补救治疗。现就近年IST治疗AA疗效预测相关文献作一综述,以期对临床IST提供参考,并为后续相关研究提供依据。
AA发病是由于自身反应性T淋巴细胞克隆活化,造血负调控因子增多,造血干细胞凋亡[2]。IST治疗AA在于清除活化的T淋巴细胞,使残存的骨髓造血得以恢复。从近年来国内外相关报道可见,IST疗效预测指标主要涉及患者的遗传学和免疫学指标(表1)及患者的一般情况、治疗前骨髓残存造血、治疗方案和治疗后近期反应等临床指标(表2)。
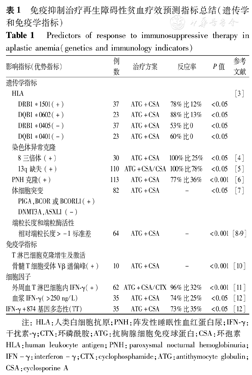
免疫抑制治疗再生障碍性贫血疗效预测指标总结(遗传学和免疫学指标)
Predictors of response to immunosuppressive therapy in aplastic anemia(genetics and immunology indicators)
免疫抑制治疗再生障碍性贫血疗效预测指标总结(遗传学和免疫学指标)
Predictors of response to immunosuppressive therapy in aplastic anemia(genetics and immunology indicators)
| 影响指标(优势指标) | 例数 | 治疗方案 | 反应率 | P值 | 参考文献 | |||
|---|---|---|---|---|---|---|---|---|
| 遗传学指标 | ||||||||
| HLA | [3] | |||||||
| DRB1*1501(+) | 37 | ATG+CSA | 78%比12% | <0.05 | ||||
| DQB1*0602(+) | 23 | ATG+CSA | 88%比13% | <0.05 | ||||
| DRB1*0405(-) | 37 | ATG+CSA | 53%比0 | <0.05 | ||||
| DQB1*0401(-) | 23 | ATG+CSA | 60%比0 | <0.05 | ||||
| 染色体异常克隆 | ||||||||
| 8三倍体(+) | 30 | ATG+CSA | 100%比25% | <0.05 | [4] | |||
| 13q缺失(+) | 110 | ATG+CSA/CSA | 100%比78% | <0.05 | [5] | |||
| PNH克隆(+) | 113 | ATG+CSA | 77%比36% | <0.001 | [6] | |||
| 体细胞突变 | 82 | ATG+CSA | - | <0.05 | [7] | |||
| PIGA,BCOR或BCORL1(+) | ||||||||
| DNMT3A,ASXL1 (-) | ||||||||
| 端粒长度和端粒酶活性 | ||||||||
| 相对端粒长度>-1标准差 | 64 | ATG+CSA | - | <0.001 | [8, 9] | |||
| 免疫学指标 | ||||||||
| T淋巴细胞克隆增生及激活 | ||||||||
| 骨髓T细胞受体Vβ谱偏峰(+) | 10 | ATG+CSA | - | <0.001 | [10] | |||
| 细胞因子 | ||||||||
| 外周血T淋巴细胞内IFN-γ(+) | 62 | ATG+CSA/CTX | 96%比32% | <0.001 | [11] | |||
| 血浆IFN-γ(>250 ng/L) | 35 | ATG+CSA | 74%比25% | <0.05 | [12] | |||
| IFN-γ+874基因多态性(TT) | 35 | ATG+CSA | 73%比35% | <0.05 | [12] | |||
注:HLA:人类白细胞抗原;PNH:阵发性睡眠性血红蛋白尿;IFN-γ:干扰素-γ;CTX:环磷酰胺;ATG:抗胸腺细胞免疫球蛋白;CSA:环孢素
HLA:human leukocyte antigen;PNH:paroxysmal nocturnal hemoglobinuria;IFN-γ:interferon-γ;CTX:cyclophosphamide;ATG:antithymocyte globulin;CSA:cyclosporine A
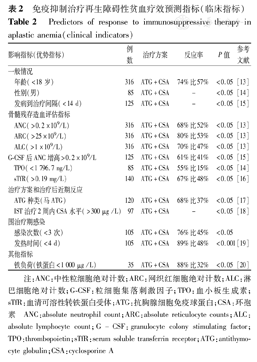
免疫抑制治疗再生障碍性贫血疗效预测指标(临床指标)
Predictors of response to immunosuppressive therapy in aplastic anemia(clinical indicators)
免疫抑制治疗再生障碍性贫血疗效预测指标(临床指标)
Predictors of response to immunosuppressive therapy in aplastic anemia(clinical indicators)
| 影响指标(优势指标) | 例数 | 治疗方案 | 反应率 | P值 | 参考文献 | |
|---|---|---|---|---|---|---|
| 一般情况 | ||||||
| 年龄(<18岁) | 316 | ATG+CSA | 74%比57% | <0.05 | [13] | |
| 性别(男) | 85 | ATG+CSA | - | <0.05 | [14] | |
| 发病到治疗间隔(<14 d) | 125 | ATG+CSA | - | <0.05 | [15] | |
| 骨髓残存造血评估指标 | ||||||
| ANC(>0.2×109/L) | 316 | ATG+CSA | 68%比52% | <0.05 | [13] | |
| ARC(>25×109/L) | 316 | ATG+CSA | 80%比53% | <0.05 | [13] | |
| ALC(>1×109/L) | 316 | ATG+CSA | 70%比47% | <0.05 | [13] | |
| G-CSF后ANC增高>0.2×109/L | 125 | ATG+CSA | 61%比41% | <0.05 | [15] | |
| TPO(<1 796.7 ng/L) | 85 | ATG+CSA | 55%比15% | <0.05 | [14] | |
| sTfR(>0.19 mg/L) | 140 | ATG+CSA | 67%比48% | <0.05 | [16] | |
| 治疗方案和治疗后近期反应 | ||||||
| ATG种类(马ATG) | 120 | ATG+CSA | 68%比37% | <0.05 | [17] | |
| IST治疗2周内CSA水平(>300 μg /L) | 97 | ATG+CSA | - | <0.05 | [18] | |
| 围治疗期感染 | ||||||
| 感染次数(<3次) | 105 | ATG+CSA | 76%比45% | <0.05 | ||
| 发热时间(<4 d) | 105 | ATG+CSA | 89%比48% | <0.001 | [19] | |
| 其他指标 | ||||||
| 铁负荷(铁蛋白<1 000 μg /L) | 35 | ATG+CSA | 88%比32% | <0.05 | [20] | |
注:ANC:中性粒细胞绝对计数;ARC:网织红细胞绝对计数;ALC:淋巴细胞绝对计数;G-CSF:粒细胞集落刺激因子;TPO:血小板生成素;sTfR:血清可溶性转铁蛋白受体;ATG:抗胸腺细胞免疫球蛋白;CSA:环孢素
ANC:absolute neutrophil count;ARC:absolute reticulocyte counts;ALC:absolute lymphocyte count;G-CSF:granulocyte colony stimulating factor;TPO:thrombopoietin;sTfR:serum soluble transferrin receptor;ATG:antithymocyte globulin;CSA:cyclosporine A
HLA在抗原递呈中起重要作用,可能影响AA的T淋巴细胞激活。Song等[3]研究发现在韩国AA人群中不同HLA表型对IST反应不同;中国AA人群也有类似报道[21]。但不同地区人群遗传背景不同,尚需进一步研究以探索HLA和IST反应的关系。
多数AA患者有不同程度的PNH克隆,有文献报道存在PNH克隆的AA患者IST反应良好[24,25],但也有学者认为PNH克隆存在不能预示IST反应[26]。分析发现结果的异质性在于对PNH克隆的定义不同,建立规范的PNH克隆检测方法和定义可能有助于疗效预测。
AA患者存在不同程度的体细胞突变,Yoshizato等[7]通过二代测序发现不同的体细胞突变预示不同的IST反应和生存率。
目前发现有AA患者端粒酶相关基因突变,端粒酶活性降低,端粒长度缩短,干细胞更新修复功能受损,可能影响IST疗效。
Schuster等[10]研究发现存在T淋巴细胞受体Vβ谱偏峰分布的患者通常提示潜在T淋巴细胞克隆增生,IST反应良好。
文献报道自明确诊断到治疗的间隔时间长短,是影响IST疗效和长期生存率的重要指标[15]。
多数研究认为外周血常规在一定程度上反映骨髓造血功能,可作为IST疗效的预测指标[13,14]。Scheinberg等[13]的一项大样本回顾性分析显示外周血常规可用于预测IST疗效;国内也有类似研究[29]。但界值的选取目前仍存在争议。
集落刺激因子治疗后中性粒细胞反应在一定程度上反映骨髓残存造血。文献报道可以通过集落刺激因子治疗后中性粒细胞反应预测IST疗效[15]。
不同的ATG制剂和剂量也可能影响IST疗效。欧美报道马ATG疗效优于兔ATG[17],而亚洲报道兔二者疗效相当[31],ATG的种类和剂量都可能是影响IST疗效的因素。
CSA是IST的重要药物,文献报道IST治疗期CSA水平和IST反应和复发密切相关[18]。
围治疗期感染可打击残存造血,在一定程度上反映疾病严重程度。有文献报道IST围治疗期发生感染通常预示反应不良[19]。
AA患者通常需要长期输血,高铁负荷通常抑制红系造血祖细胞。Pawelec等[20]发现铁蛋白高的AA患者IST反应不良,AA患者祛铁治疗可能有助于IST疗效。
AA属于T淋巴细胞介导的自身免疫性疾病。目前临床上沿用的Camitta分型,一定程度上反映了疾病严重程度,但不能用于判断是否需要IST,良好的IST疗效预测指标可能有助于临床选择,并避免临床风险。近年来,国内外对IST疗效预测指标有不同程度的探索,相关指南对上述指标也有不同程度推荐,但由于AA的发病率较低,有关IST疗效预测研究的样本量均较小,且多为回顾性研究,在上述指标体系中,除染色体异常克隆及骨髓残存造血外,其他指标特异性尚存争议。因此,仍需通过大样本、前瞻性的研究确立IST疗效预测指标,协助临床分型及治疗。



























