
对41例髓母细胞瘤患儿给予HIT-2000方案治疗,分析其5年无病生存率和放化疗的不良反应,探讨适合国内儿童髓母细胞瘤的治疗方法。
2010年1月至2013年1月住院治疗的髓母细胞瘤患儿共41例,年龄1.3~15.5岁。所有患儿均为手术切除肿瘤后到首都医科大学附属北京世纪坛医院儿科采用HIT-2000方案治疗。综合分析患儿的放化疗不良反应,采用Kaplan-Meier法计算生存率、无事件生存(EFS)率和总体生存(OS)率。
截至2016年1月,随访时间1.1~6.1年,中位随访时间4.4年,其中肿瘤完全消失26例(63.4%),进展7例(17.1%),复发4例(9.7%),稳定1例(2.4%),骨髓转移2例(4.8%),继发第二肿瘤1例(2.4%)。3年、5年OS率分别为(78.0±6.5)%、(68.0±8.9)%;EFS率分别为(56.1±7.8)%和(53.7±7.8)%。3岁以上患儿生存分析结果显示:5年OS率为(75.6±7.7)%,EFS率为(60.06±8.3)%,较OS率偏高。随访期内所有患儿均未出现放射性脑坏死及放射性脊髓炎。放疗期间12例出现不同程度的恶心、呕吐、腹痛等胃肠道反应,34例出现血常规下降。化疗最常见不良反应为胃肠道反应和血细胞减少,15例由于粒细胞缺乏合并感染,其中10例为肺部感染,5例为肠道感染,其中金黄色葡萄球菌感染1例,大肠杆菌感染3例,经积极抗感染及对症治疗均痊愈。
HIT-2000方案适合国内髓母细胞瘤患儿手术后序贯治疗,且疗效显著,患儿可耐受。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
髓母细胞瘤是儿童最常见的高度恶性的胚胎性肿瘤,约占儿童颅内恶性肿瘤的20%[1],多起源于小脑蚓部,极易通过脑脊液循环通路播散[2],且好发于10岁以下儿童,尤以3~4岁和8~10岁为发病高峰[3]。目前治疗髓母细胞瘤最有效的方法仍然是肿瘤病灶手术切除后辅助放疗和化疗,其5年无病生存(DFS)率已由20世纪70年代的20%提高到现在的80%以上[1,4,5]。德国儿童肿瘤协作组HIT-2000方案对治疗儿童颅内恶性肿瘤具有显著疗效[5,6],本研究回顾性分析2010年1月至2013年1月在北京世纪坛医院采用德国HIT-2000方案治疗的41例髓母细胞瘤患儿的病例资料,随访观察患儿的不良反应及生存分析,探讨国内儿童髓母细胞瘤的治疗方法。
本研究队列为观察队列,采用回顾性分析,临床诊断和治疗在北京世纪坛医院儿科完成。所有临床数据在临床常规治疗过程中收集获得,获医院医学伦理委员会批准研究方案,患儿监护人均签署知情同意书。
2010年1月至2013年1月在北京世纪坛医院接受HIT-2000方案治疗的髓母细胞瘤患儿共41例。其中男31例,女10例;年龄1.3~15.5岁,中位年龄6.9岁。患儿均经CT、磁共振成像(MRI)和病理明确诊断,手术切除肿瘤后采用HIT-2000方案治疗。化疗前行MRI及脑脊液检查评估病情,分为标危组(28例)和高危组(13例)。其中经典型18例,促纤维增生/结节型12例,广泛结节型6例,间变型4例,大细胞型1例;手术完全切除肿瘤26例,部分残余15例,播散转移8例,见表1。
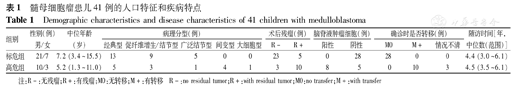
髓母细胞瘤患儿41例的人口特征和疾病特点
Demographic characteristics and disease characteristics of 41 children with medulloblastoma
髓母细胞瘤患儿41例的人口特征和疾病特点
Demographic characteristics and disease characteristics of 41 children with medulloblastoma
| 组别 | 性别(例)男/女 | 中位年龄(岁) | 病理分型(例) | 术后残瘤(例) | 脑脊液肿瘤细胞(例) | 确诊时是否转移(例) | 随访时间[年,中位数(范围)] | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 经典型 | 促纤维增生/结节型 | 广泛结节型 | 间变型 | 大细胞型 | R- | R+ | 阳性 | 阴性 | M0 | M+ | 情况不清 | ||||
| 标危组 | 21/7 | 7.2 (3.4~15.5) | 13 | 9 | 5 | 0 | 0 | 23 | 5 | 0 | 28 | 28 | 0 | 0 | 4.4 (3.0~6.1) |
| 高危组 | 10/3 | 5.2 (1.3~11.0) | 5 | 3 | 1 | 4 | 1 | 3 | 10 | 8 | 5 | 0 | 10 | 3 | 4.5 (3.5~6.1) |
注:R-:无残瘤;R+:有残瘤;M0:无转移;M+:有转移
R-:no residual tumor;R+:with residual tumor;M0:no transfer;M+:with transfer
根据HIT-2000治疗方案,就诊时出现肿瘤转移或脑脊液播散的患儿(共10例),先行如下方案化疗[5,6]:(1)环磷酰胺(CTX)800 mg/m2,第1-3天+长春新碱(VCR)1.5 mg/m2,第1天;(2)卡铂200 mg/m2,第1-3天+依托泊苷150 mg/m2,第1-3天交替化疗2个周期,随后接受全中枢放疗23.4~36.0 Gy,瘤床局部放疗54~56 Gy。放疗后继续进行6个周期的放疗后维持治疗:顺铂70 mg/m2,第1天,洛莫司汀75 mg/m2,第1天,VCR 1.5 mg/(m2·d),第1天、第8天、第15天,每6周重复。
根据HIT-2000治疗方案,就诊时无肿瘤转移和脑脊液播散的患儿(共23例),先行全中枢放疗23.4~36.0 Gy,瘤床局部放疗54~56 Gy。放疗后继续6~8个周期的维持治疗(顺铂+洛莫司汀+VCR),每6周重复。
放疗后维持治疗前复查全脑、全脊柱MRI,肺部CT,脑脊液检查;维持治疗期间每化疗2周期复查MRI和脑脊液;治疗期间出现症状考虑可能进展时行MRI检查。根据MRI或脑脊液检查结果,MRI疑似播散或复发者、脑脊液肿瘤细胞阳性者在维持治疗的基础上给予定期强化(共8例):(1)CTX 800 mg/m2,第1-3天+VCR 1.5 mg/m2,第1天;(2)卡铂200 mg/m2,第1-3天+依托泊苷150 mg/m2,第1-3天化疗2、3周期。
治疗结束时复查脑脊液除外肿瘤细胞,以后第1-2年每3个月复查头颅MRI,每6个月复查脊柱MRI,第3-5年每6个月复查头颅和脊柱MRI,5年后每年复查1次头颅和脊柱MRI[5]。评价方法按照WHO标准分为(1)完全缓解(CR):肿瘤灶完全消失,脑脊液肿瘤细胞阴性;(2)部分缓解(PR):肿瘤灶减少≥50%,脑脊液肿瘤细胞阴性;(3)改善(IMP):肿瘤灶减少25%~50%,和/或脑脊液肿瘤细胞阴性;(4)稳定(SD):瘤灶减少或增加<25%;(5)进展(PD):瘤灶增加≥25%,和/或脑脊液肿瘤细胞阴性[6]。对于复发患儿继续强化治疗,治疗方案参照文献[7, 8, 9, 10]。
放射性不良反应按美国放射治疗肿瘤协作组(RTOG)早期和晚期毒性分级标准评定。化疗不良反应按照美国国立癌症研究所(NCI)的毒性指标及分级标准评定。
采用SPSS 20.0统计学软件进行分析,采用Kaplan-Meier法计算生存率、无事件生存(EFS)率和总体生存(OS)率。
41例患儿中肿瘤完全切除(R0)者26例,有肿瘤残余(R+)15例,其中8例就诊时出现脑脊液肿瘤细胞播散,给予2~4周期化疗后再行放疗。截至2016年1月,随访时间1.1~6.1年,中位随访时间4.4年,其中CR 26例(63.4%),SD 1例(2.4%),复发4例(9.7%),PD 7例(17.1%),骨髓转移2例(4.8%),继发第二肿瘤1例(2.4%)。41例患儿3年、5年OS率分别为(78.0±6.5)%、(68.0±8.9)%;3年、5年EFS率分别为(56.1±7.8)%、(53.7±7.8)%,中位OS率为47个月,中位EFS率为42个月,见图1。3岁以上患儿生存分析结果显示:5年OS率为(75.6±7.7)%,EFS率为(60.06±8.3)%,较总体生存率偏高,见图2。
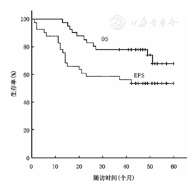

注:OS:总体生存;EFS:无事件生存
OS:overall survival;EFS:event-free survival
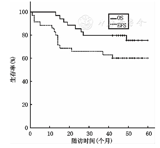

注:OS:总体生存;EFS:无事件生存
OS:overall survival;EFS:event-free survival
放化疗所致不良反应见表2。

采用HIF-2000方案治疗的髓母细胞瘤患儿放化疗的不良反应
Side-effect of radiotherapy and chemotherapy of children with medulloblastoma according to HIT-2000 protocol
采用HIF-2000方案治疗的髓母细胞瘤患儿放化疗的不良反应
Side-effect of radiotherapy and chemotherapy of children with medulloblastoma according to HIT-2000 protocol
| 放化疗所致不良反应 | 例(%) | |||
|---|---|---|---|---|
| 放疗不良反应 | ||||
| 脑损伤 | 0(0) | |||
| 肺损伤 | 0(0) | |||
| 脊髓损伤 | 0(0) | |||
| 胃肠道毒性 | 12(29.3) | |||
| 血液毒性 | 34(82.9) | |||
| 皮疹 | 6(14.6) | |||
| 化疗不良反应 | ||||
| 胃肠道毒性 | 30(73.2) | |||
| 恶心 | 28(68.3) | |||
| 呕吐 | 12(29.3) | |||
| 腹痛 | 20(48.8) | |||
| 腹泻 | 3(7.3) | |||
| 口腔溃疡 | 5(12.2) | |||
| 血液系统毒性 | 40(97.6) | |||
| 粒细胞减少 | 23(56.1) | |||
| 血小板减少 | 40(97.6) | |||
| 贫血 | 39(95.1) | |||
| 感染 | 15(36.6) | |||
| 肺炎 | 10(24.4) | |||
| 肠道细菌感染 | 5(12.2) | |||
41例患儿在随访期内均未出现放射性脑坏死及放射性脊髓炎。全中枢放疗期间12例出现恶心、呕吐、腹痛等胃肠道反应,其中Ⅲ度恶心、呕吐2例;34例患儿出现白细胞、血小板下降,其中Ⅱ度粒细胞减少20例,Ⅲ度粒细胞减少3例,Ⅱ度血小板减少26例,Ⅲ度血小板减少5例,Ⅰ度血红蛋白下降10例。
化疗期间不良反应主要表现为胃肠道反应和血液学毒性。其中30例患儿出现Ⅰ、Ⅱ度胃肠道反应,包括恶心、呕吐、腹痛、腹泻、口腔溃疡等。血液学毒性发生率较高,达97.6%(40/41例),其中Ⅱ度粒细胞减少36例,Ⅲ度粒细胞减少10例;Ⅱ度血小板减少30例,Ⅲ度血小板减少5例,Ⅳ度血小板减少5例;Ⅰ度血红蛋白下降10例,Ⅱ度血红蛋白下降28例,Ⅲ度血红蛋白下降2例。15例由于粒细胞缺乏合并感染,其中10例为肺炎,5例为肠道细菌感染;其中金黄色葡萄球菌感染1例,大肠杆菌感染3例,经积极抗感染及对症治疗均痊愈。
41例患儿治疗后缓解时间为1~60个月,中位EFS为42个月,其中7例出现颅内和脊髓播散,4例出现颅内新发病灶,2例骨髓转移,1例继发第二肿瘤,二次手术病理为胶质母细胞瘤。对于复发患儿,继续强化治疗:卡铂200 mg/m2 +依托泊苷100 mg/m2,96 h持续化疗,共4个周期;病情稳定后改为口服药物治疗:替莫唑胺150 mg/(m2·d),第1-5天,依托泊苷25 mg/(m2·d),第1-21天,28 d重复,疗程1~2年。
近年来髓母细胞瘤的治疗取得很大进展,生存率不断提高。美国学者Packer等[11]随访分析了1996至2000年期间的379例无播散髓母细胞瘤患儿,给予手术、放疗后化疗治疗,指出其5年和10年EFS率分别为(81.0±2.0)%和(75.8±2.3)%,OS率分别为(87.0±1.8)%和(81.3±2.1)%。法国Vigneron等[12]对52例6.0~17.5岁髓母细胞瘤患儿回顾性分析发现,其5年和10年OS率分别为62%和57%,5年和10年EFS率分别为80%和63%。单因素分析发现,预后不良因素为术后残瘤、脑脊液肿瘤细胞阳性、转移部位和高危分组,而多变量分析提示脑脊液肿瘤细胞阳性是一不利因素。德国Lannering等[13]对340例4~21岁标危髓母细胞瘤患儿放疗后进行顺铂、洛莫司汀、VCR化疗,共8周期,5年EFS率和OS率分别为(77±4)%和(87±3)%。上海新华医院Wang等[14]对67例髓母细胞瘤患儿回顾性分析研究发现,3年OS率和EFS率分别为(55.1±6.4)%和(45.6±6.7)%,单因素分析发现标危、术后联合放化疗、确诊时年龄≥3岁、肿瘤全切、家庭收入较高、城镇居民等为预后有利因素;多因素分析提示术后放疗联合化疗是一个独立的预后因素;同时指出放弃治疗率较高,达31%。
本课题回顾性分析研究的中位随访时间为4.4年,其3年、5年EFS率分别为(56.1±7.8)%、(53.7±7.8)%,3年、5年OS率分别为(78.0±6.5)%、(68.0±8.9)%;中位EFS为42个月,中位OS为47个月,其中CR 26例,SD 1例,IMP 4例,PD 7例,骨髓转移2例,继发第二肿瘤1例。5年OS与Vigneron等[12]的研究结果比较接近,但略低于德国5年EFS和OS[13];而3年OS和EFS均高于Wang等[14]的研究结果。本课题对3岁以上患儿进一步生存分析结果显示,5年OS率为(75.6±7.7)%,EFS率为(60.06±8.3)%,均略低于德国Lannering等[13]的研究。von Bueren等[15]对<4岁髓母细胞瘤患儿随访研究发现,总体5年EFS率和OS率分别为(57±8)%和(80±6)%。19例促纤维增生/结节型髓母细胞瘤患儿的5年EFS率和OS率均明显优于其他病理类型,分别为(90±7)%和(100±0)%;23例经典型患儿的5年EFS率和OS率分别为(30±11)%和(68±10)%;而间变型预后很差。这2组研究结果均说明病理分型和危险度分组为影响预后的重要因素。本课题对髓母细胞瘤患儿采用德国HIT-2000方案治疗,随访观察5年EFS和OS略低于德国癌症研究中心,多因素回归分析提示可能与患儿发病到确诊时间较长、化疗期间合并感染、化疗耐受性差等因素有关。
本研究中所有髓母细胞瘤患儿在随访期内均未出现放射性脑坏死及放射性脊髓炎,放疗期间出现不同程度的胃肠道反应和血象下降,但均未合并感染。化疗期间主要表现为胃肠道反应和血液学毒性,并由于粒细胞缺乏合并感染,主要表现为呼吸道感染和肠道细菌感染,经积极抗感染及对症治疗均痊愈;所有患儿均未出现明显肝肾、心脏等重要脏器损害。这在一定程度上提示中国髓母细胞瘤患儿的化疗耐受性低于国外儿童,应在化疗过程中进一步加强保护措施。Vieira等[16]回顾性分析放疗、顺铂化疗对髓母细胞瘤患儿的耳毒性,指出瘤床局部强化放疗较传统放疗可降低对内耳的损伤,放疗剂量应低于42 Gy,而顺铂的总化疗剂量不应超过375 mg/m2,本课题中所有髓母细胞瘤患儿给予顺铂化疗的总量均未超过375 mg/m2,故未做耳毒性相关分析研究。
本课题对受选患儿采用HIT-2000方案标准化治疗,患儿的3年、5年EFS和OS略低于德国,但高于国内其他同级医院。尽管化疗过程中出现了不同程度的不良反应,甚至合并感染,但经积极抗感染和对症处理后均痊愈。总之,HIT-2000方案治疗国内髓母细胞瘤患儿效果显著,且患儿耐受性良好,适合我国髓母细胞瘤患儿手术后的序贯治疗,可有效提高髓母细胞瘤患儿的长期EFS,为国内髓母细胞瘤患儿的治疗提供临床依据。



























