
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
气管和支气管受各种物理、化学、药物、变应原等刺激后所引起的气道阻力(Rrs)变化称为气道反应性(airway responsiveness,AR)。正常气道对轻微刺激不发生收缩反应或仅有微弱反应,是正常生理反应。气管和支气管受轻微物理、化学、药物、变应原等刺激后,Rrs明显增高的现象称为气道高反应性(airway hyper-responsiveness,AHR)[1]。其是基于气道慢性炎症的一种病理生理状态。AHR是支气管哮喘的主要病理生理特征,临床上通过支气管激发试验来测定AHR,判断其严重程度及临床疗效。
支气管激发试验是通过吸入抗原或非特异性刺激物来诱发气道平滑肌收缩及气道炎性反应的一种方法,以通过测定刺激前后肺功能指标的改变,判定气道收缩程度,对AHR作出定性或定量判断[2]。支气管激发试验是检测AHR最常用的临床检查[3]。
根据刺激物的作用机制,支气管激发试验可分为直接和间接2类激发试验,直接激发试验主要包括乙酰甲胆碱(Methacholine,Mch)、组胺、白三烯D4等;间接激发试验包括运动、甘露醇、腺苷、高渗盐水、冷空气等[4]。根据我国儿科临床应用支气管激发试验的现况和发展趋势,本指南着重阐述Mch直接支气管激发试验、运动激发试验和高渗盐水激发试验。
支气管激发试验中严重不良反应的发生率较低,但仍需重视,做好安全防范措施。应有具备执业医师资质的医师在场。试验地点最好设在易于抢救受试者的地方,配备相关的监护设备、急救物品和吸氧装置。操作过程中应对受试者进行严密观察,对可能发生的危险均有相应的应急预案[5]。
试验前详细了解受试者的病情,应在哮喘非发作期进行;近期未接触变应原,至少1周内无哮喘发作;近4周无气道感染病史,无喘息及呼吸困难症状,无甲状腺功能亢进及心脏病史,了解近期药物使用情况,进行体格检查,试验前第1秒用力呼气容积(forced expiratory volume in one second,FEV1)≥70%预计值[6],必要时行心电图检测。试验前停用影响气道收缩或反应性的药物以避免影响结果的判读,降低AR的因素见表1[6]。
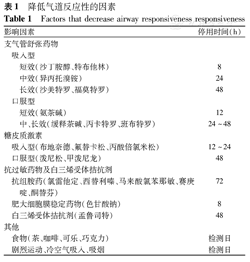
降低气道反应性的因素
Factors that decrease airway responsiveness responsiveness
降低气道反应性的因素
Factors that decrease airway responsiveness responsiveness
| 影响因素 | 停用时间(h) | ||
|---|---|---|---|
| 支气管舒张药物 | |||
| 吸入型 | |||
| 短效(沙丁胺醇、特布他林) | 8 | ||
| 中效(异丙托溴铵) | 24 | ||
| 长效(沙美特罗、福莫特罗) | 48 | ||
| 口服型 | |||
| 短效(氨茶碱) | 12 | ||
| 中、长效(缓释茶碱、丙卡特罗、班布特罗) | 24~48 | ||
| 糖皮质激素 | |||
| 吸入型(布地奈德、氟替卡松、丙酸倍氯米松) | 12~24 | ||
| 口服型(泼尼松、甲泼尼龙) | 48 | ||
| 抗过敏药物及白三烯受体拮抗剂 | |||
| 抗组胺药(氯雷他定、西替利嗪、马来酸氯苯那敏、赛庚啶、酮替芬) | 72 | ||
| 肥大细胞膜稳定药物(色甘酸钠) | 8 | ||
| 白三烯受体拮抗剂(孟鲁司特) | 48 | ||
| 其他 | |||
| 食物(茶、咖啡、可乐、巧克力) | 检测日 | ||
| 剧烈运动、冷空气吸入、吸烟 | 检测日 | ||
主要依据吸入Mch的雾化方式(手动简易或自动触发的雾化设备)、呼吸模式(深吸气或潮气呼吸)、激发剂最大浓度和递增剂量浓度区间设定、评价肺功能的方法参数(FEV1或Rrs)和激发试验判定的参数指标[当基线FEV1值下降20%时激发药物的浓度(PC20-FEV1)、当基线FEV1值下降20%时激发药物的累积剂量(PD20-FEV1)、最小诱发累积剂量(Dmin)]。临床常用的5种Mch支气管激发试验方法见表2。
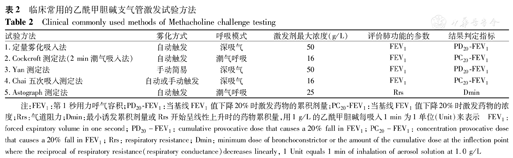
临床常用的乙酰甲胆碱支气管激发试验方法
Clinical commonly used methods of Methacholine challenge testing
临床常用的乙酰甲胆碱支气管激发试验方法
Clinical commonly used methods of Methacholine challenge testing
| 试验方法 | 雾化方式 | 呼吸模式 | 激发剂最大浓度(g/L) | 评价肺功能的参数 | 结果判定指标 |
|---|---|---|---|---|---|
| 1.定量雾化吸入法 | 自动触发 | 深吸气 | 50 | FEV1 | PD20-FEV1 |
| 2.Cockcroft测定法(2 min潮气吸入法) | 自动触发 | 潮气呼吸 | 16 | FEV1 | PC20-FEV1 |
| 3.Yan测定法 | 手动简易 | 深吸气 | 50 | FEV1 | PD20-FEV1 |
| 4.Chai五次吸入测定法 | 自动或手动触发 | 深吸气 | 16 | FEV1 | PC20-FEV1 |
| 5.Astograph测定法 | 自动触发 | 潮气呼吸 | 25 | Rrs | Dmin |
注:FEV1:第1秒用力呼气容积;PD20-FEV1:当基线FEV1值下降20%时激发药物的累积剂量;PC20-FEV1:当基线FEV1值下降20%时激发药物的浓度;Rrs:气道阻力;Dmin:最小诱发累积剂量或Rrs开始呈线性上升时的药物累积量,用1 g/L的乙酰甲胆碱每吸入1 min为1单位(Unit)来表示
FEV1:forced expiratory volume in one second; PD20-FEV1:cumulative provocative dose that causes a 20% fall in FEV1;PC20-FEV1:concentration provocative dose that causes a 20% fall in FEV1;Rrs: respiratory resistance; Dmin: minimum dose of bronchoconstrictor or the amount of the cumulative dose at the inflection point where the reciprocal of respiratory resistance(respiratory conductance)decreases linearly, 1 Unit equals 1 min of inhalation of aerosol solution at 1.0 g/L
采用不同的吸入方法和激发规程,激发剂的配制方法亦不相同。临床应用中一般为现用现配。通常是先配制"原液"及最大浓度的Mch。需要时将原液稀释(稀释液通常采用9 g/L盐水)。不同浓度的激发剂分别密封存储于不同的容器中,容器上应标明浓度与配制时间,置于4 ℃冰箱内保存,不超过2周。不要将配制好的激发剂直接保存在雾化器的储液槽中,以避免结晶阻塞毛细管孔口而影响雾化量。使用前需从冰箱取出并在室温下放置30 min,温度过低会影响雾化量[5],并导致受试者吸入冷的雾滴后出现气道痉挛。定量雾化吸入法-经气雾激发系统(aerosol provocation system,APS)吸入激发剂Mch的配制方法见表3[7],Astograph测定法中激发剂Mch的配制方法见表4[8]。Cockcroft测定法(2 min潮气吸入法)、Yan测定法(简易手捏式雾化吸入法)、Chai五次吸入测定法(间歇吸入法)的Mch原液浓度分别参照表2中最大激发液浓度配制后,采用倍比稀释获得试验规程所设置的相应浓度,故不赘述。
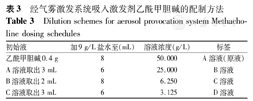
经气雾激发系统吸入激发剂乙酰甲胆碱的配制方法
Dilution schemes for aerosol provocation system Methacholine dosing schedules
经气雾激发系统吸入激发剂乙酰甲胆碱的配制方法
Dilution schemes for aerosol provocation system Methacholine dosing schedules
| 初始液 | 加9 g/L盐水至(mL) | 溶液浓度(g/L) | 标签 |
|---|---|---|---|
| 乙酰甲胆碱0.4 g | 8 | 50.000 | A溶液(原液) |
| A溶液取出3 mL | 6 | 25.000 | B溶液 |
| B溶液取出2 mL | 8 | 6.250 | C溶液 |
| C溶液取出3 mL | 6 | 3.125 | D溶液 |
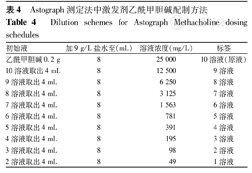
Astograph测定法中激发剂乙酰甲胆碱配制方法
Dilution schemes for Astograph Methacholine dosing schedules
Astograph测定法中激发剂乙酰甲胆碱配制方法
Dilution schemes for Astograph Methacholine dosing schedules
| 初始液 | 加9 g/L盐水至(mL) | 溶液浓度(mg/L) | 标签 |
|---|---|---|---|
| 乙酰甲胆碱0.2 g | 8 | 25 000 | 10溶液(原液) |
| 10溶液取出4 mL | 8 | 12 500 | 9溶液 |
| 9溶液取出4 mL | 8 | 6 250 | 8溶液 |
| 8溶液取出4 mL | 8 | 3 125 | 7溶液 |
| 7溶液取出4 mL | 8 | 1 563 | 6溶液 |
| 6溶液取出4 mL | 8 | 781 | 5溶液 |
| 5溶液取出4 mL | 8 | 391 | 4溶液 |
| 4溶液取出4 mL | 8 | 195 | 3溶液 |
| 3溶液取出4 mL | 8 | 98 | 2溶液 |
| 2溶液取出4 mL | 8 | 49 | 1溶液 |
(1)受试者先休息15 min。(2)测定肺通气功能,FEV1取3次中高值为基线值。(3)吸入9 g/L盐水,2 min后重复上述肺通气功能检查(参照值),与基线值比较:若FEV1下降≥10%,则休息5 min,然后重复,若仍≥10%则终止;若FEV1下降<10%,则继续。(4)从最低浓度开始吸入Mch,通过APS系统定量雾化器已设计完善的激发规程(表5)自动触发雾化药物,受试者从残气位缓慢深吸气至肺总量位,要求按照标准吸气方式完成各浓度下设定的吸入次数。每一剂量吸入后2 min测定肺通气功能,若FEV1下降<20%,则吸入下一浓度,直至FEV1下降达20%基线值。同时观察受试者的症状,询问受试者的感受。(5)FEV1下降达20%后立即停止激发,记录受试者的症状、体征。即刻吸入支气管舒张剂。(6)15 min后复查肺通气功能,至FEV1恢复至基线值,若未恢复,持续观察15 min再次复查,复查受试者的体征。
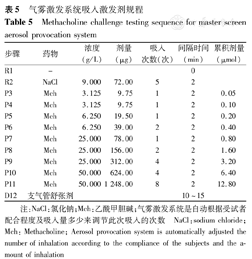
气雾激发系统吸入激发剂规程
Methacholine challenge testing sequence for master screen aerosol provocation system
气雾激发系统吸入激发剂规程
Methacholine challenge testing sequence for master screen aerosol provocation system
| 步骤 | 药物 | 浓度(g/L) | 剂量(μg) | 吸入次数(次) | 间隔时间(min) | 累积剂量(μmol) |
|---|---|---|---|---|---|---|
| R1 | - | 0 | ||||
| R2 | NaCl | 9.000 | 72.00 | 5 | 2 | |
| P3 | Mch | 3.125 | 9.75 | 1 | 2 | 0.05 |
| P4 | Mch | 3.125 | 9.75 | 1 | 2 | 0.10 |
| P5 | Mch | 6.250 | 19.50 | 1 | 2 | 0.20 |
| P6 | Mch | 6.250 | 39.00 | 2 | 2 | 0.40 |
| P7 | Mch | 25.000 | 78.00 | 1 | 2 | 0.80 |
| P8 | Mch | 25.000 | 156.00 | 2 | 2 | 1.60 |
| P9 | Mch | 25.000 | 312.00 | 4 | 2 | 3.20 |
| P10 | Mch | 50.000 | 624.00 | 4 | 2 | 6.40 |
| P11 | Mch | 50.000 | 1 248.00 | 8 | 2 | 12.80 |
| D12 | 支气管舒张剂 | 10~15 |
注:NaCl:氯化钠;Mch:乙酰甲胆碱;气雾激发系统是自动根据受试者配合程度及吸入量多少来调节此次吸入的次数
NaCl:sodium chloride; Mch: Methacholine; Aerosol provocation system is automatically adjusted the number of inhalation according to the compliance of the subjects and the amount of inhalation
采用射流雾化器持续雾化,用压缩气源与雾化器连接,雾化量可通过气体流量进行调节,一般要求为0.13 mL/min(±10%)。试验时让受试者用口含住接口器,嘱受试者平静、均匀地潮气呼吸(雾化器需直立,否则影响释雾量)。吸入的10个激发剂质量浓度依次为0.030、0.060、0.125、0.250、0.500、1.000、2.000、4.000、8.000、16.000 g/L,每个浓度潮气呼吸吸入2 min,雾化颗粒直径为1.0~3.6 μm,吸入后分别在30 s和90 s检测FEV1,取其高值;间隔5 min吸入下一浓度,FEV1下降20%以上或达到最高药物浓度,停止试验。采用连续潮气呼吸形式,需受试者吸入配合较少,较适用于儿童[4,6]。
国内钟南山等采用简易手捏式雾化吸入法测定AR,该方法采用手捏式雾化器输送一定雾粒直径和雾化量的激发剂(组胺或Mch),见表6[5]。起始质量浓度为3.125 g/L,按累积剂量倍增式吸入,最大质量浓度为50.000 g/L。受试者从功能残气位吸入,在吸气开始后同步喷入药物,1~2 s吸至肺总量位,屏气3 s。每次吸入后60 s测定FEV1,FEV1下降20%以上或达到最大吸入累计剂量,终止试验。
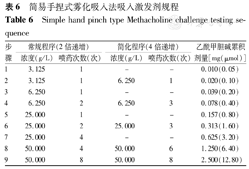
简易手捏式雾化吸入法吸入激发剂规程
Simple hand pinch type Methacholine challenge testing sequence
简易手捏式雾化吸入法吸入激发剂规程
Simple hand pinch type Methacholine challenge testing sequence
| 步骤 | 常规程序(2倍递增) | 简化程序(4倍递增) | 乙酰甲胆碱累积剂量[mg(μmol)] | ||
|---|---|---|---|---|---|
| 浓度(g/L) | 喷药次数(次) | 浓度(g/L) | 喷药次数(次) | ||
| 1 | 3.125 | 1 | - | - | 0.010(0.05) |
| 2 | 3.125 | 1 | 6.250 | 1 | 0.020(0.10) |
| 3 | 6.250 | 1 | - | - | 0.039(0.20) |
| 4 | 6.250 | 2 | 6.250 | 3 | 0.078(0.40) |
| 5 | 25.000 | 1 | - | - | 0.157(0.80) |
| 6 | 25.000 | 2 | 25.000 | 3 | 0.313(1.60) |
| 7 | 25.000 | 4 | - | - | 0.625(3.20) |
| 8 | 50.000 | 4 | 50.000 | 6 | 1.250(6.40) |
| 9 | 50.000 | 8 | 50.000 | 8 | 2.500(12.80) |
该试验方法通过定量雾化吸入器从低浓度至高浓度逐渐定量吸入雾化液;受试者在吸气开始时经定量雾化吸入器吸入雾化药物,每次均从残气位缓慢深吸气至肺总量位,吸气时间5 s,每一浓度吸入5次,总时间不超过2 min,吸入后3 min测定FEV1,要求按照标准吸气方式完成各浓度下设定的吸入次数,直至FEV1下降20%以上或达到最高设定吸入量,终止试验[4]。
通过强迫振荡法,在受试者的口腔侧施加一正弦波形的振荡压力,连续测定呼吸阻力,儿童测试时选择振荡频率7 Hz[8]。(1)仪器校准,开机前检查是否电源连接可靠,打开主机电源及仪器,等待仪器预热(15 min左右),进行偏流检查并记录偏流值(>150 mL/s为正常);进行严格测试检查各雾化罐是否正常喷雾;进行零点校正、3 L定标筒容量校正、(low)标准阻抗管校正1.9~2.2 cmH2O/(L·s)(1 cmH2O=0.098 kPa)和(High)标准抵抗管10.2~10.7 cmH2O/(L·s)。(2)吸入9 g/L盐水,记录好稳定的基础呼吸阻力(Rrs cont),若基础阻力>15.0 cmH2O/(L·s),则此次激发试验暂缓。(3)吸入浓度逐渐递增的Mch并实时监测Rrs,Mch质量浓度依次为49、98、19、391、781、1 563、3 125、6 250、12 500、25 000 mg/L。每一浓度吸入1 min,仪器将自动切换为下一浓度,连续测定Rrs,直至Rrs升高到基础水平的2倍或受试者肺部出现哮鸣音及剧烈咳嗽需停止激发。如Rrs无明显升高,则最高浓度吸入结束后终止。(4)即刻吸入支气管舒张剂至Rrs恢复接近基础阻力水平。(5)15 min后复查肺通气功能。
间接支气管激发试验方法包括运动激发试验、甘露醇干粉激发试验、冷空气过度通气激发试验、高渗盐水激发试验、蒸馏水激发试验。所用激发物并非直接作用于气道平滑肌引起收缩,而是主要通过刺激支气管内炎症细胞、神经细胞,使其释放细胞介质或细胞因子,作用于支气管平滑肌引起气道收缩。
运动激发试验基本原理为运动时通气量增大引起气道内衬液层温度改变和渗透压变化从而诱发支气管收缩。常用运动器械是平板或踏车,可调节平板的坡度、速度或踏车的功率调节运动量。带鼻夹,呼吸空气的相对湿度<50%,环境温度20~25 ℃,同时监测心率及血氧饱和度[6]。
(1)平板跑步:平板坡度一般为10%,速度5~8 km/h,运动持续时间12岁以上儿童一般8 min,12岁以下至少6 min[6],起始速度在最初2~3 min可以缓慢,逐渐加快,使心率达到最高预计值的80%~90%,最高预计值为[220-年龄(岁)][6],通气量达到最大通气量(maximum voluntary ventilation,MVV)预计值的40%~60%,MVV约为FEV1的35倍,运动停止后1 min、5 min、10 min、15 min、20 min分别测定FEV1,任一监测时点FEV1下降≥10%为运动激发试验阳性[4]。
(2)踏车法:采用自行车功率计测定,运动负荷评估公式为:功率=(53.76×FEV1实测值)-11.07,第1 min运动负荷为60%,第2 min为75%,第3 min为90%,第4 min为100%,并持续4~6 min,由于水分丢失的速度是诱导支气管收缩的关键因素,若长时间处于次级运动负荷,可能使受试者耐受,引起假阴性,因此,在4 min内达到目标心率或通气量是非常重要的,运动停止后时间同上,分别测定FEV1,任一监测时点FEV1下降≥10%为运动激发试验阳性[6]。
运动激发试验的优点是特异度高,但敏感性差,尤其对于早期、非典型哮喘、运动诱发哮喘等[9]。无平板或踏车试验条件时,可采用简易运动激发试验(即6 min跑步试验),受试者连续跑步运动6 min,运动前后测定FEV1下降≥15%为运动激发试验阳性,可作为运动诱发哮喘筛查试验[10]。
方法较简单、安全,适用于儿童哮喘流行病学调查或慢性咳嗽鉴别诊断等[4],可有2种方法选择。
(1)采用固定浓度的高渗盐水,通过逐渐加倍延长吸入时间的方式,多用4.5%(45 g/L)的高渗盐水,通过超声雾化产生雾化液吸入,吸入前和吸入后测定FEV1,首次吸入雾化液30 s,隔60~90 s重复测定肺功能,若FEV1下降>10%,重复目前吸入时间;若FEV1下降<10%,加倍时间吸入,相继为1 min、2 min、4 min、8 min,此过程中若FEV1下降≥15%诊断为高渗盐水激发试验阳性,若吸入8 min后FEV1下降<10%,则高渗盐水激发试验阴性,试验停止[4,11];
(2)逐步增加高渗盐水吸入浓度,每一浓度吸入时间固定,此种方法可同时行诱导痰检测。一般依次雾化吸入浓度为2.5%(25 g/L)~10%(100 g/L)的高渗盐水,每一浓度吸入2 min,同时雾化期间留取痰液。重复测定FEV1,任一浓度高渗盐水吸入后FEV1下降≥15%或咳嗽、胸闷、气促且肺部哮鸣音时,试验终止,诊断为高渗盐水激发试验阳性[12]。
运动激发试验及高渗盐水激发试验作为生理性刺激,操作方便,安全性高,临床上更易被儿童及监护人接受。其他间接激发试验,例如甘露醇干粉激发试验、冷空气过度通气激发试验、蒸馏水激发试验等未见国内儿科临床应用的资料报道,上述方法仅限于研究,故未列入本指南阐述。
选择试验方法不同,判定指标不同。
以上Mch直接支气管激发试验的方法1~4均采用FEV1作为监测肺通气功能指标,激发结果的判定指标采用累积激发剂量(PD)定量判断AR,为目前肺通气功能测定法最常用的定量指标。
(1)PC20-FEV1(provoking concentration):FEV1基线值在下降20%时激发药物的浓度;PC20计算方式:
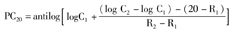
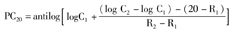
其中C1:使FEV1下降20%前的浓度;C2:使FEV1下降20%时或后的浓度;R1:C1浓度下的FEV1下降百分比;R2:C2浓度下的FEV1下降百分比。
(2) PD20-FEV1 (provoking dose): FEV1基线值在下降20%时激发药物的累积剂量。APS实例见图1。
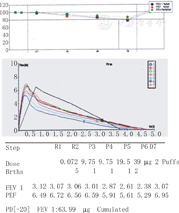

注:Step:操作步骤;Dose:吸入剂量;Brths:吸入次数;FEV1:第1秒用力呼气容积;PEF:呼气峰值流量;R1:试验前测得FEV1,为基线值;R2:吸入9 g/L盐水5次,2 min后测定FEV1,为参照值;P3:吸入1次质量浓度为9.75 mg/L激发剂,2 min后测定FEV1;P4:吸入1次质量浓度为9.75 mg/L激发剂,2 min后测定FEV1;P5:吸入1次质量浓度为19.50 mg/L激发剂,2 min后测定FEV1;P6:吸入2次质量浓度为39.00 mg/L激发剂,2 min后测定FEV1,此时测得的FEV1下降达20%基线值,终止试验;D7:吸入支气管扩张剂2次,FEV1恢复至基线值水平
Step:the procedure;Dose: the inhaled dose:Brths: the number of inhalation;FEV1:forced expiratory vo-lume in one second;PEF:peak expiratory flow;R1:the baseline value of FEV1 before the challenge testing;R2:measure the FEV1 at about 2 minutes after 5 times inhaled saline,as the reference value;P3:measure the FEV1 at about 2 minutes after once inhaled the concentration of 9.75 mg/L Methacholine;P4:measure the FEV1 at about 2 minutes after once inhaled the concentration of 9.75 mg/L Methacholine;P5:measure the FEV1 at about 2 minutes after once inhaled the concentration of 19.50 mg/L Methacholine;P6:measure the FEV1 at about 2 minutes after 2 times inhaled the concentration of 39.00 mg/L Methacholine,the FEV1 falls more than 20% from baseline,stopping test;D7:the FEV1 recovered to the baseline level with inhaled bronchodilators at 2 times
结果主要指标Rrs[单位cmH2O/(L·s)]指在吸入9 g/L盐水时的呼吸阻力;传导率[Grs,单位L/(s· cmH2O)]为Rrs的倒数;传导率下降斜率[SGrs,单位L/(s·cmH2O·min)]为单位时间内Grs的变化;最小诱发累积剂量或反应阈值(Dmin,单位Unit)指呼吸阻力开始呈线性上升时的药物累积量,用1 g/L的Mch每吸入1 min为1 Unit来表示;PD35(单位Unit)指Rrs升高到基础水平135%所需Mch的累积剂量。以上监测指标中的Dmin、PD35能反映气道敏感性,SGrs/Grs、SGrs是反映AR的指标。
采用的试验方法不同,报告解读的指标也不同。
(1)Mch直接激发试验以FEV1为常用的判断指标,呼气峰值流量(PEF)、比气道传导率(sGaw)等在临床上也可应用于判断AR。以尚未完全在最高浓度吸入后FEV1、PEF较基础值下降≥20%或sGaw下降≥35%可判断为支气管激发试验阳性[7,13,14]。Astograph测定法以尚未在达到最高吸入浓度即出现Rrs上升至基础阻力2倍,或受试者肺部出现哮鸣音及剧烈咳嗽可判断为激发试验阳性[8,15]。(2)间接激发试验中运动激发试验阳性的判断标准为FEV1下降≥10%,高渗盐水激发试验阳性的判断标准为FEV1下降≥15%。Astograph测定法的直接Mch激发试验阳性和阴性的实例见图2、图3。


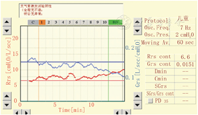

如果直接激发试验的Mch吸入达最大浓度或剂量,或间接激发试验的运动负荷量达标或高渗盐水最大吸入量在各时点监测FEV1未达到激发阳性标准,则激发试验阴性。
以PC20-FEV1和PD20-FEV1作为判定Mch直接激发试验的指标时,可参照表7[5]对AHR进行严重度分级。
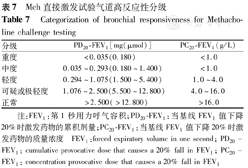
Mch直接激发试验气道高反应性分级
Categorization of bronchial responsiveness for Methacholine challenge testing
Mch直接激发试验气道高反应性分级
Categorization of bronchial responsiveness for Methacholine challenge testing
| 分级 | PD20-FEV1[mg(μmol)] | PC20-FEV1(g/L) |
|---|---|---|
| 重度 | <0.035(0.180) | <1.0 |
| 中度 | 0.035~0.293(0.180~1.400) | <1.0 |
| 轻度 | 0.294~1.075(1.500~5.400) | 1.0~4.0 |
| 可疑或极轻度 | 1.076~2.500(5.500~12.800) | 4.0~16.0 |
| 正常 | >2.500(>12.800) | >16.0 |
注:FEV1:第1秒用力呼气容积;PD20-FEV1:当基线FEV1值下降20%时激发药物的累积剂量;PC20-FEV1:当基线FEV1值下降20%时激发药物的质量浓度
FEV1:forced expiratory volume in one second; PD20-FEV1:cumulative provocative dose that causes a 20% fall in FEV1;PC20-FEV1:concentration provocative dose that causes a 20% fall in FEV1
Dmin、PD35是反映气道敏感性的定量指标,阈值越低,气道越敏感;SGrs/Grs、SGrs是AR的定量指标。但上述各定量指标用于AHR的程度分级尚无公认标准。
典型哮喘患者的支气管激发试验阳性通常以中重度多见,或在激发试验过程中出现明显的喘息、胸闷等症状[5],而经过治疗达哮喘控制状态者可见激发阳性的程度较治疗前减轻,可用于监测治疗疗效。慢性咳嗽患者支气管激发试验阳性支持哮喘诊断。此外,其他相关因素导致的AHR,如接触暴露环境变应原、变应性鼻炎、慢性支气管炎、上气道感染等也可出现支气管激发试验阳性,但程度较典型哮喘患者轻。对于结果可疑者(如FEV1下降15%~20%,无气促喘息发生),可预约2~3周复查,必要时2个月后复查[5]。
支气管激发试验阴性可考虑排除哮喘。但应除外是否有以下可能原因所致直接支气管激发试验假阴性。(1)药物因素:是否曾使用影响AR的药物或停药时间不足,如β2受体激动剂、抗胆碱能药、抗组胺药、茶碱类药物、白三烯受体拮抗剂、糖皮质激素等。(2)仪器的影响:如雾化装置及雾化量等未达到质量控制标准。(3)操作人员的影响:如手捏式雾化吸入时,操作人员未能充分捏满橡皮球,使受试者吸入雾化液量不足。(4)受试者配合不佳,吸入激发剂不足。(5)激发剂过期或未按要求保存。(6)部分运动诱发哮喘患者可能对Mch等直接支气管激发试验不敏感,需通过间接支气管激发试验等才可诱导出来。
本指南主要适用于≥6岁且配合良好的儿童。
了解治疗前后AR是否发生改变:哮喘患者经长期治疗后,病情缓解,维持哮喘良好控制水平,此时可进行AR检测,若支气管激发试验结果为阴性,或AHR程度减轻,可调整治疗方案,减药或停药[4,21,22]。
变应性鼻炎与哮喘均属于气道过敏性疾病,发病密切相关,常同时存在,或先后发生。2001年变应性鼻炎及其对哮喘的影响(allergic rhinitis and its impact on asthma,ARIA)指南更明确指出哮喘和鼻炎"同一个气道,同一种疾病"的概念[23];部分变应性鼻炎患者存在AHR,可能发展为哮喘,通过支气管激发试验可筛查出这部分患者,并作出相应干预预防哮喘发生[24,25,26]。
在某些关于哮喘的流行病学研究中,AHR作为诊断支气管哮喘的重要指标[28]。
(1)气流受限FEV1<60%的预计值;(2)曾有过致死性哮喘发作,或近3个月内曾有因哮喘发作需机械通气治疗者;(3)对吸入的激发剂有明确的超敏反应;(4)主动脉瘤;(5)不能解释的荨麻疹;(6)有其他不适宜用力通气功能检查的禁忌证;(7)哮喘发作或急性加重期[29]。
(1)基础肺功能呈中度以上损害(FEV1占预计值百分比<70%),但如严格观察并做好充足的准备,则FEV1占预计值百分比>60%者仍可考虑行支气管激发试验;(2)基础肺功能检查配合不佳,不符合质量控制要求;(3)近期呼吸道感染(<4周);(4)正在使用胆碱酶抑制剂(治疗重症肌无力)的患者不宜行Mch激发试验,正在使用抗组胺药物的患者不宜行组胺激发试验[5]。
为使同一受试者不同时段或不同受试者的检查结果具有可比性,必须对支气管激发试验质量进行严格控制,试验方法应标准化[30]。
应注意激发剂的配制和保存,过期的一定要弃掉。实验室的温度和湿度要相对恒定,加强通风。Mch原装开封后应立即称重,配成水溶液,激发剂使用前先室温放置约30 min[5];雾化器释放的颗粒直径以1~5 μm最理想。在给予激发剂时,呼吸深度一致。要求受试者放松,避免过于紧张,强调避免吞咽动作,容积时间图上呼吸曲线的平稳是良好质控的前提。
为提高支气管激发试验的安全性,建议先吸入9 g/L盐水,激发剂刺激的强度则应从低浓度开始,逐渐增加;当机体反应达到一定的强度(如肺功能指标FEV1较基础值下降20%或以上、Rrs升高到基础水平的2倍或以上,出现喘息、剧烈咳嗽等)及时终止支气管激发试验转为吸入支气管舒张剂,直至FEV1恢复至基础值的90%以上,或呼气阻力恢复至接近基础阻力水平;支气管激发试验过程中除观察肺功能指标或呼吸阻力的变化外,同时密切观察受试者的反应,如有无出现咳嗽、喘息、呼吸困难及其配合检查的程度等;若受试者出现哮喘急性发作,应及时按照哮喘急性发作救治方案进行处理[5]。
参与本指南制订的专家:向莉(首都医科大学附属北京儿童医院过敏反应科);张皓(上海交通大学医学院附属上海儿童医学中心呼吸内科);刘传合(首都儿科研究所附属儿童医院哮喘防治中心);郝创利(苏州大学附属儿童医院呼吸科);万莉雅(天津市儿童医院呼吸内科);杨文兰(同济大学附属肺科医院);申昆玲(首都医科大学附属北京儿童医院呼吸科);郑劲平(广州医科大学附属第一医院广州呼吸疾病研究所,国家呼吸疾病临床医学研究中心,呼吸疾病国家重点实验室);洪建国(上海交通大学附属第一人民医院儿内科);鲍一笑(上海交通大学医学院附属新华医院儿内科);陈育智(首都儿科研究所附属儿童医院哮喘防治中心);黄剑峰(复旦大学附属儿科医院呼吸科);邬宇芬(上海交通大学医学院附属上海儿童医学中心呼吸内科);许巍(首都医科大学附属北京儿童医院过敏反应科);刘莎(重庆医科大学附属儿童医院呼吸科)
参与本指南审定的专家:唐宁波(烟台毓璜顶医院);鲍燕敏(深圳市儿童医院);房定珠(上海交通大学医学院附属新华医院);艾涛(成都市儿童医院);刘峰(南京医科大学附属儿童医院);任立歆(天津市儿童医院);龙珍(湖北省妇幼保健院);刘建梅(江西省儿童医院);苑修太(济宁市第一人民医院);李金英(河北省儿童医院);计明红(安徽省立医院);王艳丽(武汉市儿童医院);潘志伟(佛山市妇女儿童医院)

























