
观察人绒毛膜促性腺激素(HCG)治疗尿道下裂并小阴茎的临床疗效及安全性。
将48例尿道下裂并小阴茎的患儿简单随机法随机分为HCG治疗组(试验组)和非治疗组(对照组),各24例。观察试验组患儿用药后阴茎长度和阴茎头直径的变化,同时检测患儿用药前后骨龄、睾酮(T)及第二性征等的改变。对2组患儿均采用Duckett尿道成形术,术后密切随访,记录可能出现的并发症,如尿瘘、尿道狭窄、尿道憩室及尿道崩裂。
1.试验组患儿治疗后阴茎长度增长(1.08±0.47) cm,治疗前后比较差异有统计学意义(t=-5.196,P<0.05);治疗后阴茎头直径增长(0.31±0.06) cm,治疗前后比较差异有统计学意义(t=-5.080,P<0.05)。2.试验组2例发生尿瘘,对照组8例发生尿瘘,2组比较差异有统计学意义(χ2=4.547,P<0.05)。试验组中3例需再次手术,对照组中9例需再次手术,2组比较差异有统计学意义(χ2=4.000,P<0.05)。试验组尿道下裂并小阴茎患儿术中阴茎解剖清晰,层次分明,更易于分离,岛状皮瓣血供更加丰富。
短期HCG治疗能够有效促进尿道下裂并小阴茎患儿的阴茎生长,改善阴茎解剖条件,能使患儿阴茎体周围的皮肤及皮下软组织进一步发育成熟,无明显并发症,其治疗安全有效,并有助于提高手术成功率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
尿道下裂是小儿泌尿生殖系统最为常见的先天性畸形之一,其发病率近年来呈逐渐上升趋势,一般报道在男性新生儿发病率为1/300~1/250[1]。Li等[2,3,4]报道轻度和重度尿道下裂的发病率均在持续上升,我国学者也报道从1996年到2008年,中国尿道下裂的发病率持续上升。手术矫正仍是目前唯一的治疗手段,但总的手术成功率不令人满意,尤其是对中重度尿道下裂并小阴茎的手术治疗。为降低手术难度,提高手术成功率,术前使用激素治疗以改善阴茎长度、阴茎头直径及包皮组织的血管密度等已经成为许多小儿泌尿外科医师的常用手段[5,6]。本研究旨在观察人绒毛膜促性腺激素(HCG)辅助治疗尿道下裂并小阴茎患儿阴茎状态变化及其对手术效果的影响。
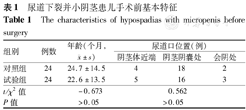
选择2014年1月至2015年5月广西医科大学第一附属医院小儿外科共收治48例尿道下裂并小阴茎患儿[阴茎长度小于正常同龄儿童阴茎长度2.5标准差(SD)[7]]。全组患儿监护人均签署知情同意书并经医院医学伦理委员会审批通过(批号:2014-KY-桂卫-001)。将48例患儿按简单随机对照原则分成试验组和对照组,各24例。试验组在术前使用HCG肌肉注射治疗,对照组术前不使用任何药物治疗。所有患儿的染色体检查均为46,XY。任何有内分泌疾病和尿道下裂手术史的患儿均排除在外。试验组患儿HCG试验均为阳性。手术前2组患儿一般情况比较差异无统计学意义,见表1。
尿道下裂并小阴茎患儿手术前基本特征
The characteristics of hypospadias with micropenis before surgery
尿道下裂并小阴茎患儿手术前基本特征
The characteristics of hypospadias with micropenis before surgery
| 组别 | 例数 | 年龄(个月, ±s) ±s) | 尿道口位置(例) | ||
|---|---|---|---|---|---|
| 阴茎体近端 | 阴茎阴囊处 | 会阴处 | |||
| 对照组 | 24 | 24.7±14.5 | 4 | 18 | 2 |
| 试验组 | 24 | 22.6±13.5 | 5 | 16 | 3 |
| t/χ2值 | -0.673 | 0.562 | |||
| P值 | >0.05 | >0.05 | |||
试验组患儿均经HCG试验阳性后开始使用HCG(中国丽珠集团丽宝生物化学制药公司生产,珠海,生产批号:150710)治疗。HCG肌肉注射1 000 U,2次/周,连用10次为1个疗程[8]。治疗目标为患儿阴茎长度达到最小值(即>均数-2.5SD)。如未能达到治疗目标可使用2个疗程。尿道成形术在HCG治疗结束后3个月实施。对照组患儿术前均未经任何激素治疗。
阴茎长度和阴茎头最大直径均由2名经过培训的外科医师进行测量,取其平均值为测量值。患儿放松,阴茎静息状态下,牵拉阴茎至阴茎完全伸展直立,量尺平行于阴茎背侧,测量阴茎夹角为90°时从耻骨联合阴茎根部至阴茎顶端的长度。阴茎头直径为患儿阴茎头最宽处的距离。由广西医科大学第一附属医院放射免疫中心在HCG治疗前、后采用同位素放射免疫法检测睾酮(T)、促黄体素生成素(LH)和促卵泡生成素(FSH)水平。摄左手腕、掌、指骨正位X线片,由广西医科大学第一附属医院放射影像科固定专人在HCG治疗前后1年用G-P图谱法评测其骨龄。治疗过程中观察患儿的精神状态、日常行为、会阴区毛发、皮肤颜色等有无改变。
48例患儿均采用横裁包皮岛状皮瓣尿道成形术(Duckett术),如背侧包皮长度不够,可加用近端尿道口周围皮瓣卷管(Duckett术+Duplay术)。
所有患儿在术后第1个月、第3个月、第6个月和第12个月回院门诊复查,此后每年复查1次。观察阴茎外观和排尿形态。详细记录患儿可能出现的并发症,如尿瘘、尿道或尿道口狭窄、尿道憩室、龟头裂开和阴茎残留下弯等,以及后续并发症处理方案。
采用SPSS 19.0统计软件进行统计分析。用Kolmogorov-Smirnov检验样本正态性,非正态计量资料取常用对数转化为正态数据后进行分析,结果以 ±s表示。用配对t检验或Wilcoxon符号秩检验来判定实验组用药前后的差异性。用χ2检验和t检验来判定实验组和对照组2组之间的差异性,P<0.05为差异有统计学意义。
±s表示。用配对t检验或Wilcoxon符号秩检验来判定实验组用药前后的差异性。用χ2检验和t检验来判定实验组和对照组2组之间的差异性,P<0.05为差异有统计学意义。
试验组24例患儿全部完成激素治疗。14例于第1疗程结束即达到治疗目标;余10例参加第2疗程,其中6例在第2疗程结束达到治疗目标,仅有4例未达到治疗目标,阴茎长度略有增长。
阴茎长度增长情况:HCG治疗前长度(1.83±0.38) cm,治疗后长度为(2.92±0.53) cm,增长(1.08±0.47) cm,用药前后阴茎长度差异有统计学意义(t=-5.196,P<0.05)。阴茎头直径增长情况:HCG治疗前宽度(1.08±0.12) cm,治疗后宽度为(1.41±0.11) cm,增长(0.31±0.06) cm,用药前后阴茎头直径差异有统计学意义(t=-5.080,P<0.05)。
雄激素水平较治疗前有轻微增高,治疗前为(0.011±0.002) μg/L,治疗后为(0.034±0.012) μg/L,用药前后雄激素水平差异有统计学意义(t=-3.580,P<0.05)。但治疗后雄激素水平仍在儿童正常范围(标准为0~0.40 μg/L)。有2例患儿会阴区出现少许毛发。LH和FSH水平均在正常范围内未见明显波动,LH治疗前为(2.26±0.45) IU/L,治疗后为(2.02±0.36) IU/L,治疗前后差异无统计学意义(t=-1.27,P>0.05),FSH治疗前为(1.55±0.43) IU/L,治疗后为(1.42±0.36) IU/L,治疗前后差异无统计学意义(t=-1.27,P>0.05)。患儿骨龄未见明显影响,均符合年龄改变,与雄激素治疗前无明显差异。
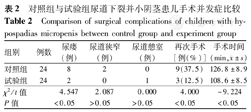
试验组6例患儿接受Duckett联合Duplay尿道成形术式,其余均为Duckett尿道成形术;对照组4例患儿接受Duckett联合Duplay尿道成形术式,其余均为Duckett尿道成形术。试验组平均随访时间为17个月(12~23个月),对照组平均随访时间为20个月(15~28个月)。试验组与对照组在尿瘘发生率、再次手术以及手术时间等方面比较差异均有统计学意义(均P<0.05);在尿道狭窄、尿道憩室等方面差异无统计学意义(均P>0.05),见表2。
对照组与试验组尿道下裂并小阴茎患儿手术并发症比较
Comparison of surgical complications of children with hypospadias micropenis between control group and experiment group
对照组与试验组尿道下裂并小阴茎患儿手术并发症比较
Comparison of surgical complications of children with hypospadias micropenis between control group and experiment group
| 组别 | 例数 | 尿瘘(例) | 尿道狭窄(例) | 尿道憩室(例) | 再次手术[例(%)] | 手术时间(min, ±s) ±s) |
|---|---|---|---|---|---|---|
| 对照组 | 24 | 8 | 2 | 0 | 9(37.5) | 126.8±8.9 |
| 试验组 | 24 | 2 | 0 | 1 | 3(12.5) | 108.6±8.5 |
| χ2/t值 | 4.547 | 2.087 | 0.000 | 4.000 | -9.224 | |
| P值 | <0.05 | >0.05 | >0.05 | <0.05 | <0.05 |
尿道下裂是小儿泌尿生殖系统最为常见的先天性畸形之一,居高不下的发病率引起了人们对尿道下裂病因发生的重视,对其病因学的研究也逐渐增多,但其发病机制仍然不十分明确,因此,尚无有效的方法来预防或干预尿道下裂的发生[9]。手术矫正仍是唯一治疗手段。手术治疗效果不仅与手术者的熟练程度、手术方式等有关,而且与患儿阴茎发育状态,特别是可以用的包皮组织的质量密切相关。因此,术前激素治疗已经被作为一种可以改善患儿阴茎包皮质量、阴茎长度、阴茎头直径和组织血供等的常用方法。美国小儿泌尿外科协会的一项调查发现,北美78%的泌尿外科医师在手术治疗尿道下裂之前愿意使用术前激素治疗,但仅限于那些近端型的、阴茎体较短的、龟头较小的和尿道板较窄的尿道下裂患儿[10]。目前将小阴茎分为低促性腺激素性腺发育不良型、高促性腺激素性腺发育不良型和特发性小阴茎3类。临床上以低促性腺激素性腺发育不良型最为多见,其内分泌特点为LH、FSH、T水平均低,HCG刺激试验为阳性反应(血清T水平升高),内分泌治疗反应较好。HCG是胎盘滋养层细胞分泌的一种促性腺激素,是胚胎期刺激睾丸发育的生理活性物质。HCG作用于睾丸间质细胞HCG受体,刺激其发育增大并分泌睾酮促进发育不良的阴茎生长。王光义等[11]报道了18例3~10岁合并阴茎发育不全的尿道下裂患儿使用HCG治疗的情况:每次肌肉注射HCG 500~1 000 U,2~3 d注射1次,总量5 000~20 000 U。治疗前阴茎长度为(1.92±0.53) cm,治疗后阴茎长度为(3.29±0.89) cm(P<0.01),增长最多为3 cm,1例无效。张富义和孙文榕[12]于1998年对35例1~7岁严重尿道下裂患儿进行自身用药前后对照。用药方法为1 000 U/次,每周2次肌肉注射,5周为1个疗程,总量为10 000~15 000 U。治疗前阴茎长度(1.95±0.53) cm,治疗后3~6个月为(3.29±0.89) cm(P<0.05)。
本组24例患儿均按照疗程完成激素治疗,充分体现出该药依从性高,可行性好。24例患儿治疗前后比较,阴茎得到了充分的生长,增长(1.08±0.47) cm,并且阴茎头直径也得到了一定程度的增大,增长(0.31±0.06) cm,为尿道成形术的顺利进行创造了良好的解剖条件。
尿道下裂手术的最终目的是达到良好外观和正常功能。无论采用何种手术方式,以达到伸直的阴茎伴正常尺寸的尿道,位于龟头正中有成自然裂隙状的尿道外口为治愈[7]。相对于远端型尿道下裂,近端型尿道下裂的治疗效果并不令人满意[13]。尿道下裂并小阴茎的患儿大多为近端型尿道下裂,且伴中重度阴茎下弯。其治疗难度更是对每一位小儿泌尿外科医师的挑战。潘永斌等[14]报道21例尿道下裂伴阴茎发育不良的患儿在术前使用HCG 1~2个疗程均能使阴茎、阴茎头直径达到1.2 cm,停药后1个月予以行手术治疗,获得了较好成功率和阴茎外观,手术效果满意。Koff和Jayanthi[15]认为尿道下裂患儿在使用HCG后阴茎并不是均匀增长,尿道口近段阴茎增长明显,使尿道口前移,阴茎大小及阴茎下弯程度得到改善,约67%的患儿只通过包皮脱套即可矫正阴茎下弯,这可能与尿道外口远近段组织的雄激素受体不同有关。同时术中见包皮组织更丰富,并且血管蒂厚度增加,血供更丰富,使手术操作更加简单有效,约25%的患儿由原来需使用阴茎岛状皮瓣才能完成修复的,在使用HCG治疗后仅使用局部尿道口包皮瓣即可修复尿道下裂。再者,使用HCG后阴囊上的毛囊更容易显现,有利于手术再造尿道时不将有毛发的皮肤带入重建尿道中。在一组兔尿道下裂动物模型实验中发现HCG治疗不仅能促使兔阴茎外观增大,并且能提高阴茎包皮组织中的血管表皮生长因子的表达,促进伤口的愈合[16]。本研究中试验组术后再次手术率为12.5%,明显低于对照组的37.5%。尤其在与皮肤愈合密切相关的并发症尿瘘发生方面尤为明显。术中发现试验组尿道下裂并小阴茎患儿术中解剖清晰,层次分明,更易于分离,手术时间较对照组有明显缩短,证实术前激素治疗不仅能促进阴茎大小的改善,而且能使患儿阴茎体周围的皮肤及皮下软组织进一步发育成熟。
激素治疗虽然能够有效增加阴茎长度和阴茎头直径,有效改善尿道下裂患儿的解剖条件,但是由于其不良反应的不确定性,其在临床的应用仍然存在争议[17]。目前国内外大部分学者一致认为术前短期应用激素会使尿道下裂患者出现不同程度的男性化表现及性早熟表现,如情绪变化、阴茎勃起、会阴部毛发过早出现、会阴部色素沉淀及增加术中出血等,但这些不良反应均比较轻微,一般都在停药3~6个月消失或减轻。本试验组中仅2例患儿出现会阴部毛发过早出现,未见骨龄早闭等其他异常。患儿的雄激素水平较HCG治疗前有明显增高,但其血清T水平均在正常值范围内。患儿在HCG治疗前后FSH和LH未见有明显差异,对下丘脑-垂体影响不明显。HCG短期治疗尿道下裂并小阴茎是安全可靠的。
术前激素治疗是重度尿道下裂治疗的一个重要方向,并且已得到广泛应用。本组采用HCG治疗尿道下裂并小阴茎患儿取得了较好的疗效,不仅改善了患儿的阴茎解剖条件,提高了手术成功率,降低了手术并发症,并且未见骨骺早闭等严重并发症的发生,其治疗是安全有效的。



























