
胎胎输血综合征是单绒毛膜双羊膜囊单卵双胎妊娠的特有并发症,有较高的围生期病死率及患病率。现介绍胎胎输血综合征在临床表现、合并症、诊断与治疗等方面的进展,旨在引起临床医师对双胎妊娠绒毛膜诊断的重视,尤其是单绒毛膜双胎,为双胎妊娠的妊娠期早期管理及干预提供帮助。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胎胎输血综合征(twin-twin transfusion syndrome,TTTS)是单绒毛膜双羊膜囊双胎(monochorionic diamnionic twin,MCDA)特有的、严重的并发症之一,好发于孕中期(孕16~26周),占所有单绒毛膜双胎的10%~15%[1],若不予治疗,TTTS围生期病死率可高达70%~90%[2],且与存活胎儿的不良神经预后高度相关。现主要介绍TTTS在分型、合并症、诊断与治疗等方面的进展,旨在引起临床医师对双胎妊娠绒毛膜,尤其是对单绒毛膜双胎诊断的重视,以便及时采取干预措施,提高双胎儿存活率,减少后遗症。
在所有MCDA中TTTS的发生率为10%~15%。而TTTS的临床表现因双胎输血发生的时间及程度不同而异。主要分为急性TTTS、慢性TTTS,而临床上以慢性型最为常见;同时,其围生儿的各种合并症对预后有很大影响。
急性TTTS是双胎间胎盘的吻合血管在短期内大量血液灌注,从而导致一系列病理生理学改变。急性TTTS主要包括4种情况[3,4,5]:(1)出生前后的TTTS。出生时,表现为双胎出生体质量相似,血红蛋白(Hb)水平及红细胞压积高低差异较大。双胎出生后一个多血红润,一个缺血苍白。(2)出生时一胎急性死亡的TTTS。最明显的改变为存活胎儿出现贫血,原因可能为当一个胎儿发生胎死宫内时,会出现血压下降、心率减慢等情况。由于双胎间有血管压力差,存活胎儿会通过血管吻合支向频死胎儿供血,导致存活胎儿出现贫血。(3)胎盘-胎儿间的输血。双胎之一Hb水平正常,另一胎儿由于胎盘的输血出现Hb水平升高。(4)胎儿-胎盘间的输血。双胎之一Hb水平正常,另一胎儿由于血液输注给胎盘出现Hb水平降低。
慢性TTTS是双胎之间通过胎盘血管吻合长期存在持续的血流交换,对双胎本身而言,双胎血容量不平衡使一胎成为供血儿,另一胎成为受血儿。供血儿的心脏泵血除了满足自身需要外,还要向受血儿输血。长期慢性输血,使供血儿处于低血容量,从而导致肾脏灌注减少而出现少尿、羊水过少甚至膀胱消失,晚期还会出现胎儿贫血、发育受限,严重者可导致胎儿被羊膜包裹贴附于宫壁的一侧,形成"贴附儿"[6]。供血儿由于自身血容量不足,造成心、脑、肾缺氧缺血而发育不良甚至萎缩,严重者可致胎死宫内。受血儿则相反,其体内血容量过多,造成膀胱过度充盈、羊水过多,甚至因循环血量超负荷致心功能不全、心力衰竭、严重水肿、胸腔积液等。
TTTS最主要的发病机制为胎盘间异常的血管吻合引起胎胎间异常输血,而异常输血所致最直接的结局为双胎之间一个贫血、一个多血。大部分贫血-多血胎儿发生于TTTS应用胎儿镜激光电凝术治疗后,残余的微小动脉-静脉/静脉-动脉(AV/VA)血管吻合慢性输血所致,约占13%,这部分胎儿无羊水量的变化;而原发的贫血-多血胎儿仅占3%。大脑中动脉峰值流速(MCA-PSV)为最重要的监测指标。当胎儿多血时,受血胎儿体内的红细胞增多,血液黏滞,流速减慢,MCA-PSV降低,临床上表现为皮肤充血、淤血甚至血栓形成等;当胎儿缺血时,供血胎儿血管内的红细胞减少,血液黏度降低,流速快,MCA-PSV升高,临床上表现为皮肤苍白、失血性休克等。
无心畸胎其本质也是一种通过胎盘血管吻合使血液循环相交通。其中一胎发育正常(泵血胎儿),另一胎心脏缺如或拥有无功能的心脏(无心畸胎)[9],泵血胎儿除维持自身血液循环外,还通过胎盘血管吻合,向无心畸胎供血。当供血胎儿氧合较低的静脉血直接成为受血胎儿的动脉供血,氧合较低的静脉血不足以维持无心胎儿基本的代谢需求,缓慢缺氧逐渐造成其脑、心等重要脏器缺氧缺血,甚至逐渐萎缩[10]。
发生TTTS时,若双胎间存在持续的慢性胎胎间输血,会导致供血儿因长期慢性缺氧缺血而发育受限,最终可导致胎儿死亡。死亡胎儿发生弥散性血管内凝血(DIC),释放促凝血酶原激酶样物质,细小的血栓通过血管交通支到另一胎儿,引起存活胎儿异常凝血,导致多脏器功能损害,甚至引起肺、心、肾、肝及神经系统栓塞及梗死。
TTTS的Quintero分期一直作为超声科医师描述TTTS进展的标准,这一分期系统体现了未经标准化治疗的TTTS的进展,使临床医师可以依照标准适时采取干预措施。但Quintero分期亦有局限性,其以羊水量、脐血流情况、胎儿水肿等指标作为分期标准,不能评估TTTS的预后,也缺乏对于心血管方面变化的描述。
研究显示,胎儿的心功能变化贯穿于TTTS病情发展的全过程,对于该病的预后及转归有重要评估意义。Degenhardt等[16]提出了一个包括心功能变化的评分标准——CHOP心血管评分(表1),来弥补Quintero分期的不足。受血儿心功能的变化与TTTS的病情进展密切相关。研究显示,TTTS分期越高,CHOP心血管评分越高,胎儿心功能越差,而约10%的早期TTTS胎儿也存在心功能异常。CHOP心血管评分主要借助超声心动图,指标包括心室肥大、收缩及舒张功能障碍、三尖瓣及二尖瓣反流、Tei指数等,对于TTTS治疗方案的选择、预后评估、新生儿生存质量预测有很大的指导意义。
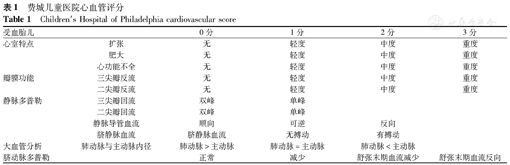
费城儿童医院心血管评分
Children′s Hospital of Philadelphia cardiovascular score
费城儿童医院心血管评分
Children′s Hospital of Philadelphia cardiovascular score
| 受血胎儿 | 0分 | 1分 | 2分 | 3分 | |
|---|---|---|---|---|---|
| 心室特点 | 扩张 | 无 | 轻度 | 中度 | 重度 |
| 肥大 | 无 | 轻度 | 中度 | 重度 | |
| 心功能不全 | 无 | 轻度 | 中度 | 重度 | |
| 瓣膜功能 | 三尖瓣反流 | 无 | 轻度 | 中度 | 重度 |
| 二尖瓣反流 | 无 | 轻度 | 中度 | 重度 | |
| 静脉多普勒 | 三尖瓣回流 | 双峰 | 单峰 | ||
| 二尖瓣回流 | 双峰 | 单峰 | |||
| 静脉导管血流 | 顺向 | 可逆 | 反向 | ||
| 脐静脉血流 | 脐静脉血流 | 无搏动 | 有搏动 | ||
| 大血管分析 | 肺动脉与主动脉内径 | 肺动脉>主动脉 | 肺动脉=主动脉 | 肺动脉<主动脉 | |
| 脐动脉多普勒 | 正常 | 减少 | 舒张末期血流减少 | 舒张末期血流反向 |
单绒毛膜双胎妊娠早期通过超声检测可见"T字征",是通过靠近胎盘并与胎盘成90°的2个羊膜层共同形成薄薄的一层膜;反之,双绒毛膜是由2层薄的羊膜与较厚的绒毛膜共同形成的2个胎儿之间的膜,超声可见"λ征"。产前超声为TTTS诊断的金标准,需同时符合以下2条:(1)MCDA(性别相同、一个胎盘、有一薄层隔膜),妊娠早期可见1个孕囊中有2个胚芽,妊娠中期可见胎盘与羊膜分隔之间为"T"形;(2)羊水量的差异,受血儿羊水过多(20周前羊水最大液性暗区≥8 cm,20周后≥10 cm),供血儿羊水过少(羊水最大液性暗区≤2 cm)。
对于产前未经超声确诊的TTTS,可通过以下方法进行产后诊断:(1)胎盘。供血儿胎盘苍白、萎缩,羊水过少,羊膜上有羊膜结节;受血儿胎盘充血、红润、饱满,羊水充盈。(2)Hb水平[17]。双胎间Hb水平有差异,慢性TTTS双胎之间可达50 g/L以上,但不能确诊TTTS,因为双绒毛膜双胎妊娠,两胎儿之间Hb水平亦可有差异;再者,若双胎之间Hb水平无差异,不能排除TTTS,因为出生时急性输血及供血儿的代偿性造血,可导致二者Hb水平无明显差异。(3)体质量差异。慢性输血时,双胎之间体质量差异可>20%,急性输血时二者的体质量差异小,因此体质量差异可用于评估双胎输血的时间及程度。(4)围生儿各种合并症。双胎之间发生慢性输血时,可有缺氧缺血性脑损伤及脑梗死等情况,可通过颅脑磁共振成像(MRI)检查间接诊断;同时借助心脏超声检查,可进一步推断先天性心脏病的双胎是否发生宫内TTTS;另外,血凝、血常规等检验指标亦可对TTTS进行产后推断。
理论上,对于TTTS的管理包括宫内治疗(保守治疗、羊水减量术、胎儿镜激光电凝术、羊膜中隔穿孔、选择性减胎),新生儿治疗。因为TTTS的预后差、存活率低,所以保守治疗对于Ⅱ期及以上的TTTS是不推荐的。
Ⅰ期的管理策略至今仍存在争议,因为只有很少的资料对于Ⅰ期的结局作详细研究。研究发现,TTTS Ⅰ期可能不进展甚至会恢复正常[18]。相反,在Ⅰ期采取任何干预措施,与保守治疗相比,均有可能改善长期神经系统预后及围生期存活率。在一篇关于TTTS Ⅰ期的文献回顾中,采取保守治疗总的存活率为86%,羊水减量为77%,激光电凝后为86%,因此认为,TTTS Ⅰ期首选保守治疗[19]。
羊膜腔内羊水抽取可减少受血儿羊膜腔内多余羊水,是目前最简单且应用广泛的方法。羊水减量可反复多次抽取,单次抽取羊水量3 L左右,一般液性暗区减至5~6 cm。其机制是减少羊水量可降低羊膜腔及胎盘血管内压力,从而增加胎盘的单位血流量,改善胎儿的生存环境。然而,反复羊水抽取也有不利的一面,可能增加胎膜早破、早产、胎盘早剥、感染等风险,而且也不能从根本上解决血管吻合的问题[20]。
胎儿镜下激光凝固术是通过凝固双胎绒毛膜板间吻合的血管,使血管堵塞不通,从而纠正双胎间异常血流,是一种针对病因的治疗手段。被推荐作为处于Ⅱ~Ⅳ期且<26周胎儿的首选治疗手段。激光凝固的目标是"双绒毛膜化",是把单绒毛膜胎盘分离成有功能的2个胎盘,分别营养2个胎儿。选择性激光凝固技术是选择性地凝固胎盘间吻合的血管,改善双胎之间的血流动力学[21],该方法可显著减少宫内死胎的发生,提高胎儿存活率。目前研究表明,基于双胎间AV/VA吻合的单向血流,而非AA/VV吻合是造成TTTS的根本原因,因此采用高选择性凝固方法,即只选择性地凝固导致TTTS的AV/VA吻合,但这一理论仍在研究阶段,可行性还未可知[22]。
临床上很少应用该技术。具体方法是在两羊膜间的隔膜上打孔,目的是使两羊膜腔内的羊水可以互相流通,从而减少受血儿羊膜腔内压力,缓解其羊水过多的压力。其理论依据是,人为制造一个单绒毛膜单羊膜囊双胎,恢复双胎之间的羊水量,使其不发生TTTS。由于临床上很少应用,其病理生理学机制及疗效仍需进一步探讨。
早在1993年就提出了选择性减胎,仅用于重度TTTS,早期超声已检测出其中一胎处于严重衰竭,采取其余任何措施均无法救治双胎,可采取该方式。濒临衰竭的胎儿一旦胎死宫内,将造成另一胎儿长期不可逆的脑损伤,所以适时选择性减胎,是保住另一胎儿的可行方式。其中最合适的方式是脐带结扎术,易操作,能较好地保护存活胎儿。然而,采取选择性减胎面临的最大争议是如何判断哪个胎儿预后更差。而目前大家普遍认为应选择保留供血儿,因为脐带结扎后,供血儿的异常血流减少被阻断,更易恢复自身血容量,且受血儿有较高的概率出现先天性心脏病及神经系统合并症。最重要的一点,是只有在其中一胎即将发生死亡的情况下才能应用该技术,而激光凝固确实能在疾病的任何时期抢救胎儿[23]。
经适当宫内干预措施后,TTTS双胎的围生期病死率较前明显降低。存活的双胎,尤其是供血儿,若出生后出现缺氧性呼吸窘迫,甚至窒息,需立即由有经验的产科或新生儿科医师转运至符合条件的新生儿重症监护病房进行抢救。并防治后续一系列并发症,如供血胎儿可予多次输注红细胞纠正贫血;受血胎儿可予适度放血、扩容等减轻血液高黏滞状态;先天性心脏病患儿可予定期复查心脏超声,并进行心肺功能评价,如有必要,可行外科手术辅助干预;神经系统损害即脑损伤患儿可早期予营养神经治疗,后期可行康复训练。
总之,TTTS是MCDA的严重并发症,围生期病死率极高,早期产前诊断及有效处理是改善妊娠结局的关键。需要产科医师、超声科医师、新生儿科医师共同协作,加强对孕产妇的产前超声监测,早期明确妊娠绒毛膜及有无TTTS等异常胎儿合并症,及时对症处理,从而提高TTTS的存活率。



























