
幼年特发性关节炎(JIA)中糖皮质激素的使用适应证为全身型JIA非甾体类抗炎药使用无效、合并巨噬细胞活化综合征、合并炎症性肠病、合并葡萄膜炎和活动性关节炎的关节腔内注射患者。长期使用糖皮质激素存在各种不良反应风险,需密切监测药物相关不良反应,严格控制其使用剂量和疗程,必要时及时联合传统和/或生物制剂缓解病情抗风湿病药物。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
幼年特发性关节炎(juvenile idiopathic arthritis,JIA)是儿童时期常见的风湿性疾病,是一组异质性疾病,分为7型:全身型、少关节型、多关节型(类风湿因子阴性)、多关节型(类风湿因子阳性)、与附着点相关型、银屑病相关型和未分化型。全身型、多关节型(类风湿因子阳性)、与附着点相关型和银屑病相关型往往会持续到成人阶段,甚至需要终身治疗。
JIA是存在致残和致盲风险的一组疾病。JIA经过治疗,若未达到临床无疾病活动状态或低疾病活动状态(low disease activity),远期常常会导致不同程度的残疾。另外,JIA患者合并的葡萄膜炎,症状常常隐匿,不易及时获得诊断;若延误诊断时间长,治疗不及时,最终可导致失明。因此,需要儿童风湿科专科医师更为规范、科学地管控疾病,合理地使用各种药物。
目前,JIA的治疗药物主要包括非甾体类抗炎药(NSAIDs)、糖皮质激素、改善病情抗风湿病药物(disease-modifying anti-rheumatic drugs,DMARDs),DMARDs包括传统DMARDs(traditional MDARD,tDMARDs)和生物制剂DMARDs(biological MDARD,bDMARDs)。近年来大量的文献证实,生物制剂DMARDs起效更快,更利于阻止骨侵蚀的进展,但糖皮质激素在JIA的治疗中仍有不可取代的地位。
糖皮质激素是一类具有抗炎和免疫抑制特性的药物,用于多种免疫系统过度活跃所致的疾病,如自身免疫疾病、自身炎症疾病等。值得重视的是,糖皮质激素长期使用可能会导致严重不良反应,特别是在儿童,因此,儿童风湿科专科医师应权衡获益与风险,个体化使用糖皮质激素,使JIA患儿尽可能获得临床无疾病活动状态或低疾病活动状态,同时尽可能规避药物不良反应。
SoJIA是一种复杂的、具有挑战性的儿童疾病,主要表现在其病因不明,需要进行广泛的鉴别诊断及制定恰当的个体化的治疗方案等方面。据国际风湿病学联盟协会的定义,SoJIA是JIA的一个亚型,其表现为16岁以下儿童发热持续时间至少2周,伴随1个或多个下列症状和体征:短暂的红斑皮疹、广泛的淋巴结大、肝脾大和浆膜炎[1]。
糖皮质激素用于SoJIA的治疗已有若干年,主要用于控制发热和其他的全身症状,部分患者单用糖皮质激素尚不能完全控制SoJIA。如今,临床医师有了有效的替代方案——生物制剂,如白细胞介素(IL)-1受体拮抗剂(阿那白滞素)和IL-6受体单抗(妥珠单抗),彻底改变了该病治疗的自然史。目前治疗患者的管理仍然有很大的异质性,主要包括糖皮质激素治疗方案、tDMARDs和bDMARDs。
2011美国风湿病学会(ACR)发表了关于治疗JIA的药物的启动和安全监测的建议[2]。SoJIA的治疗分为2类:(1)SoJIA以全身症状为主;(2)SoJIA以活动性关节炎为主。糖皮质激素,一般在给予2周的NSAIDs,试图控制疾病失败后,方被推荐。部分患者虽在病程早期,如有持续发热或疾病整体活动性评估(MD Global)达7分以上,可予全身性糖皮质激素治疗。由于缺乏相关的临床试验,指南没有提到糖皮质激素的使用剂量、给药途径及减少和停用糖皮质激素的时间。以活动性关节炎为主的SoJIA患者,推荐关节内注射类固醇,而不是全身性糖皮质激素管理[2]。
儿童关节炎和风湿研究联盟(CARRA)是一个北美超过350名儿科风湿病医师的组织,2012年出版了SoJIA的临床治疗方案和标准化评估计划的共识[3]。治疗药物主要包括糖皮质激素、甲氨蝶呤(MTX)、阿那白滞素及妥珠单抗。其中提到了糖皮质激素的剂量、疗程等。
SoJIA应用NSAIDs治疗失败或出现严重贫血、心包炎、巨噬细胞活化综合征(MAS)等并发症危及生命时,可考虑使用糖皮质激素。
(1)口服[3]:泼尼松是儿童时期经常使用的口服糖皮质激素,因为其半衰期短,可使毒性最小化。剂量为1~2 mg/(kg·d)(最大60 mg),一般分为1次或2、3次,标准疗法是每日给药,而不是隔日服药。晨起顿服是为了更符合生理皮质醇的节律。也有报道显示大剂量隔日泼尼松可有效控制SoJIA的全身症状,且患者可以耐受,但同时使用霉酚酸酯。另外,国外有一种新型的小剂量泼尼松程序释放药物——Lodotra®,摄入约4 h后,泼尼松可迅速从药片核心释放,这意味着这种药物可以在睡前服用,然后在凌晨释放[4],从而使关节晨僵明显降低。糖皮质激素的总疗程不超过3个月。如果患者经过1~2周的治疗后病情恶化,口服泼尼松龙的剂量可增加至2 mg/(kg·d)(最高100 mg)。若病情改善不充分,或糖皮质激素3个月内初始剂量不能达到减半,建议加用MTX、阿那白滞素或妥珠单抗。在病情改善的情况下,糖皮质激素剂量应尽快减停,治疗不应持续超过6个月。另外,改良德尔菲法(Delphi Method)(专家意见法)达成SoJIA激素使用流程的共识,建立了用特定的标准来开始、增加和减量糖皮质激素[5],见图1、图2。
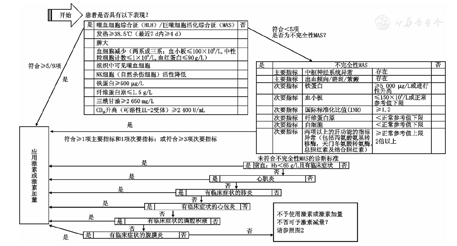

注:SoJIA:全身型幼年特发性关节炎 SoJIA:systemic-onset juvenile idiopathic arthritis
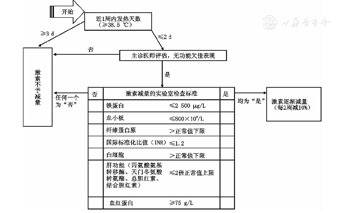

注:SoJIA:全身型幼年特发性关节炎 SoJIA:systemic-onset juvenile idiopathic arthritis
(2)静脉大剂量冲击:当SoJIA危及生命的最佳给药方法为甲泼尼龙冲击,30 mg/(kg·d)(最大为1 g),连续3 d,可迅速控制疾病的全身症状,55%的患者可达到完全缓解,必要时根据疾病活动在随后的几周内可重复。Picco等[6]的数据显示,SoJIA患者给予小剂量静脉甲泼尼龙冲击[5 mg/(kg·d)]对早期临床症状及炎症生物学指标的改善有益,累积每日治疗剂量较常规的口服糖皮质激素要低。然而,不良反应并非罕见:有研究发现在4年期间,在213例风湿性疾病接受静脉糖皮质激素治疗的患者中,46例(22%)有不良反应。其中21例患儿有行为改变,包括情绪改变、过度活跃、精神错乱、定向障碍、睡眠障碍。其他不良反应包括头痛、腹痛、高血压和心动过速。另外,大剂量甲泼尼龙冲击的不良反应还有钾耗竭继发心律失常、继发于钠潴留的高血压、急性精神病、惊厥、高血糖伴或不伴酮症、过敏反应、感染及股骨头坏死等[7]。
(3)关节腔糖皮质激素注射:局部糖皮质激素主要用于活动性的滑膜炎,主要用于控制无全身症状,仅1个或数个关节的炎症,包括髋关节、膝关节、踝关节、距下关节、腕关节、指(趾)间关节、颞颌关节等。已曲安奈德(Triamcinolone hexacetonide)是最佳的选择,其效果所能持续的时间较久,可快速缓解疼痛或功能障碍。Neidel等[8]报道,接受单次髋关节注射已曲安奈德(1 mg/kg,最多40 mg)的SoJIA患者2年的缓解率可达58%。不良反应主要为注射部位的萎缩皮肤变化,婴幼儿表现更为明显。一些较小的关节,如腕、踝和指间关节经多次注射,可能出现无症状的影像学下钙化[9]。
与附着点相关JIA,各项指南均无全身糖皮质激素使用建议。部分患者合并存在炎症性肠病的证据,若为炎症性肠病相关型关节炎,需停止使用NSAIDs。口服糖皮质激素(泼尼松)治疗是经典的治疗。方案为以1~2 mg/(kg·d),最大40~60 mg/d,持续2~4周。短期治疗常用于中、重度症状的炎症性肠病患者,可迅速缓解症状。重要的是,应该尽量减少长期使用糖皮质激素所带来的不良反应,如高血压、糖耐量异常、骨质疏松、白内障、线性增长减少和感染等的风险。因此,一旦患者临床有好转,每日糖皮质激素应在8~10周期间缓慢减量,直到完全停止。糖皮质激素的诱导治疗及减量时间,有赖于医师的经验和患者对治疗的反应[14,15]。10%~20%的中、重度克罗恩病患者,对口服糖皮质激素无效,需要静脉给药。在严重情况下,静脉给药需立即给予。此外,约30%的克罗恩病患者依赖糖皮质激素,或在激素减量时出现疾病活动[15,16]。此时需要考虑替代疗法替代糖皮质激素,如免疫抑制剂和生物制剂等。
布地奈德是一种对肠道糖皮质激素受体具有很高亲和力的糖皮质激素,可增强肝脏的首过代谢,降低全身性糖皮质激素的吸收。其局部活性高,系统的生物利用度低,因此,系统性糖皮质激素相关并发症的风险较低。一项系统综述显示,布地奈德诱导治疗8周后,疗效优于安慰剂与美沙拉嗪(5-氨基水杨酸)[17]。但主要用于轻、中度的炎症性肠病。对于存在炎症性肠病相关关节病变的患者,MTX可作为首选的免疫抑制剂,必要时肿瘤坏死因子α单克隆抗体(英夫利昔单抗或阿达木单抗)亦有相当的作用。
由于眼球受累在儿童风湿性疾病的关节外表现中发病率较高,而且可导致失明,因此十分重要。JIA是最常见的儿童风湿性疾病,可同时累及关节和眼球。在美国,6%的葡萄膜炎患者为儿科患者,约80%与JIA相关[19]。JIA的患者中11%~30%的患者会合并葡萄膜炎,其中78%~90%的JIA相关的葡萄膜炎表现为少关节型JIA,90%的患者存在ANA阳性,7%~14%为多关节型JIA,2%~6%为全身型JIA。JIA葡萄膜炎的平均发病年龄为6~8岁。主要在关节炎起病的4~7年发生,但也有约6%的患者,葡萄膜炎发生在关节炎之前。由于缺乏明显的眼部症状,如发红、疼痛或光敏感,诊断可能会被忽略。如不及时治疗会出现并发症,严重威胁视力,如带状角膜病变、白内障、青光眼或低眼压等。因此,最为有效且低成本的手段是定期进行裂隙灯筛查,以便早期发现早期治疗[20]。
糖皮质激素是治疗葡萄膜炎的关键,但应避免长期使用,以避免严重不良反应,特别是在儿科患者。在眼部并发症的发展之前(早期带状角膜病变、虹膜后黏连、白内障、黄斑水肿),外用糖皮质激素和散瞳剂可以作为轻度前葡萄膜炎患者的一线治疗。局部使用皮质类固醇的频率,应根据每例患者炎症的严重程度决定,在使用期间应密切随访,监测眼内压,如果治疗效果满意,可逐渐降低滴数。如果治疗效果不佳,或局部给药剂量减少时出现复发,可给予局部糖皮质激素眼球注射或短期全身性给予糖皮质激素。全身性给予糖皮质激素的剂量与治疗SoJIA的剂量相同,必要时可以大剂量静脉使用。
需要牢记的是糖皮质激素的不良反应,糖皮质激素眼球注射的主要不良反应为眼压升高。长期外用糖皮质激素或局部糖皮质激素注射可导致眼不良反应,如白内障和青光眼,长期使用全身糖皮质激素可导致严重的不良反应,如生长发育迟缓、肾上腺抑制、骨骺过早闭合、高血糖、感染和骨质疏松等。除了糖皮质激素,长期治疗葡萄膜炎相关的方案还包括抗代谢药物、烷化剂和生物制剂,但NSAIDs对于葡萄膜炎是无效的。若患者无明显的眼部并发症,外用糖皮质激素减量时复发,或眼球注射糖皮质激素出现高眼压,需尽快加用免疫调节剂。如果患者的一个眼球出现眼部并发症,则需要联合糖皮质激素和免疫调节剂。MTX是首选的免疫调节治疗,因为其疗效和安全性在儿科患者是公认的,其长期使用不会增加患癌症的风险。MTX治疗JIA相关葡萄膜炎60%~82%患者可得到改善。若MTX早期应用并持续至少3年,在停药2年或更长时间,葡萄膜炎复发的风险一般较低。
与JIA相似,成人的类风湿性关节炎(RA)、强直性脊柱炎(AS)和银屑病关节炎(PsA)[21]亦与潜在的威胁视力的炎性眼病有关,这3种疾病可起病于青少年期。AS与PsA的眼部表现相似,为前葡萄膜炎,但类风湿关节炎不同,干眼、周边溃疡性角膜炎、巩膜炎为其主要并发症。眼部润滑剂、局部糖皮质激素、全身性激素和免疫抑制等的治疗方法是相似的。
最近,来自美国、加拿大、欧洲和澳大利亚的19位专家、医师们(包括风湿科、儿科风湿科、肾脏科、骨质疏松科、呼吸科、神经科、眼科、皮肤科、感染科和精神科)统一定义了糖皮质激素毒性指数(glucocorticoid toxicity index,GTI)[22],包含了31项综合GTI项目(Composite GTI)、6个月~3年期间不同累积剂量糖皮质激素的常见毒性项目和23条特别项目(specific list),即重要的未包括在综合GTI项目中的糖皮质激素相关不良反应;总分为-36~439分,见表1。

糖皮质激素毒性指数
Glucocorticoid toxicity index
糖皮质激素毒性指数
Glucocorticoid toxicity index
| 综合GTI项目 | 项目权重(分) | 特别项目 | |
|---|---|---|---|
| 体质量指数(BMI) | |||
| BMI改善 | -8 | BMI明显增加 | |
| BMI无变化 | 0 | ||
| BMI适度增加 | 21 | ||
| BMI明显增加 | 36 | ||
| 葡萄糖耐受性 | |||
| 葡萄糖耐受性改善 | -8 | 糖尿病性视网膜病变 | |
| 葡萄糖耐受性无改善 | 0 | 糖尿病肾病 | |
| 葡萄糖耐受性恶化 | 32 | 糖尿病神经病变 | |
| 尽管治疗,葡萄糖耐受性恶化 | 44 | ||
| 血压 | |||
| 血压改善 | -10 | 高血压急救后部可逆性脑病综合征 | |
| 血压无变化 | 0 | ||
| 血压恶化 | 19 | ||
| 尽管治疗,血压恶化 | 44 | ||
| 血脂 | |||
| 血脂改善 | -9 | ||
| 血脂无改善 | 0 | ||
| 高脂血症恶化 | 10 | ||
| 尽管治疗,高脂血症恶化 | 30 | ||
| 骨密度 | |||
| 骨密度改善 | -1 | 骨密度大幅度下降不完全骨折 | |
| 骨密度无改变 | 0 | ||
| 骨密度降低 | 29 | ||
| 激素相关肌病 | |||
| 无激素相关肌病 | 0 | 严重的激素相关肌病 | |
| 轻度激素相关肌病 | 9 | ||
| 中重度激素相关肌病 | 63 | ||
| 皮肤毒性 | |||
| 无皮肤毒性 | 0 | 严重的皮肤毒性 | |
| 轻度皮肤毒性 | 8 | ||
| 中重度皮肤毒性 | 26 | ||
| 神经精神毒性 | |||
| 无神经精神症状 | 0 | 精神病 | |
| 轻度神经精神症状 | 11 | 糖皮质激素诱导暴力 | |
| 中重度神经精神症状 | 74 | 其他严重的神经精神症状 | |
| 感染 | |||
| 无明显感染 | 0 | Ⅳ感染 | |
| 口腔或阴道念珠菌病或单纯疱疹 | 19 | Ⅵ感染 | |
| Ⅲ级以上感染 | 93 | ||
| 内分泌 | 肾上腺皮质功能不全 | ||
| 胃肠道 | 穿孔 | ||
| 消化性溃疡 | |||
| 肌肉骨骼 | 股骨头缺血性坏死 | ||
| 肌腱断裂 | |||
| 眼部 | 中心浆液性视网膜病变 | ||
| 眼内压增高 | |||
| 后囊下白内障 | |||
| 总分 | -36~439 | ||
除此之外,儿科风湿科专科医师更关注的还有JIA患者的生长迟缓、青春期延迟及骨折等。
JIA患者中10%~40%会出现身材矮小。生长迟缓在全身型JIA和多关节JIA患儿中更为严重[23]。生长迟缓在疾病长期持续活动的患儿中更为多见,与高水平的促炎细胞因子(IL-1、IL-6和TNF-α)有关,这些细胞因子减少了垂体生长激素的分泌,也直接抑制长骨的生长。医师们普遍认为,泼尼松在0.25 mg/(kg·d)的剂量可以影响生长。JIA患者中,女童的月经初潮时间较健康儿童延迟近2年;男童的青春期延迟是由于睾丸Leydig细胞睾酮生成减少所致。因此,为了减少JIA患儿生长迟缓的发生,关键是及时获得疾病缓解,并尽可能减少皮质类固醇治疗的剂量和持续时间。
最近有文献报道,新诊断的儿童风湿性疾病患者,每年脊椎骨折发生率为4%~ 6%,既往诊断的患者中的患病率为7%~28%[24]。骨折往往无症状。儿童中长骨骨折的风险相对较高,如前臂和腕关节。但是在系统性风湿性疾病,如系统性红斑狼疮(SLE)和幼年型皮肌炎(JDM)的患者骨折危险度较其他儿童风湿性疾病更高,与骨密度和糖皮质激素的量有关。需要长期监测维生素D是否缺乏,并及时补充。
糖皮质激素在成人RA为代表的炎性关节疾病中逐步被重新关注,但仍然强调要平衡激素的风险与获益[25],持续时间相对较短(3个月内)的中、小剂量(≤7.5 mg/d)的糖皮质激素治疗,普遍共识其有积极的获益/风险比。并提倡病初糖皮质激素(快速反应药物)和传统DMARDS药物同时给予。
TENDER试验证实,难治性SoJIA患儿(持续6个月疾病活动且对糖皮质激素和NSAIDs治疗无效)给予定期的IL-6受体单抗,青春发育期前入组的患儿,观察(4.1±3.2)年后,可使患者减停激素,并获得生长追赶[26,27]。同时,2017年泰国有报道显示早期用生物制剂较晚期用生物制剂获得疾病控制的比例更高[28]。
综上所述,糖皮质激素在JIA的治疗中有不可取代的作用,特别对于SoJIA、MAS、JIA相关葡萄膜炎及1个或数个活动性关节炎的关节腔内治疗。期间应严格控制使用的剂量和持续时间,推荐小剂量、短疗程糖皮质激素;并及时联合tDMARDs和/或bDMARDs,以期尽快达到疾病缓解,迅速减停激素,避免长期糖皮质激素和持续疾病活动带来的各种不良反应和并发症。



























