
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
白血病是因造血干/祖细胞在分化过程中的不同阶段发生分化阻滞、凋亡障碍和恶性增殖而引起的一组异质性的造血系统恶性疾病;急性白血病(AL)阻滞发生在较早阶段,按照细胞来源分为急性髓系白血病(AML)和急性淋巴细胞白血病(ALL)[1]。急性巨核细胞白血病(AMKL)根据FAB协作组的分型属于AML-M7型,其发生率占儿童AML的4.0%~15.0%[2],常并Down综合征(DS)[3]。混合谱系白血病(MLL)基因定位于11号染色体长臂2区3带(11q23),其与4号染色体长臂2区1带(4q21)易位t(4; 11 )形成的MLL-AF4融合基因多见于小儿B细胞系ALL(B-ALL)[4]。广州市妇女儿童医疗中心收治1例AMKL伴MLL-AF4融合基因患儿,现报告如下,以期为AMKL的诊治提供经验。
患儿,男,5岁,因"头晕无力、贫血、血小板减少3个月"入院。入院查体:贫血貌;颈部及胸部可见散在的针尖样皮下出血点;肝、脾、淋巴结未及肿大。血常规:白细胞6.7×109/L,红细胞2.69×1012/L,血红蛋白85 g/L,血小板45×109/L。五分类血细胞分析仪分析未提示幼稚细胞。血涂片人工分类:中性分叶核细胞占0.09,淋巴细胞占0.82,单核细胞占0.01,可见一类原始幼稚细胞占0.08。骨髓穿刺检查:骨髓增生明显活跃,髓系细胞占0.02,红系细胞占0.01,淋巴细胞占0.06,可见一类原始幼稚细胞占0.91,此类细胞胞体较小、大小不一、边缘不整齐、呈锯齿状或云雾状、有指状或泡状突起,胞质量少、呈蓝色或灰蓝色、着色不均、不透明,部分细胞胞质中有空泡,可见胞质在突起后呈球状或片状脱落,胞核圆形,可见凹陷折叠等变形,不如单核细胞明显,核染色质呈粗颗粒状,胞核1~ 3个,较原始粒细胞少。骨髓细胞组织化学染色:此类原始幼稚细胞呈过氧化物酶(POX)反应阴性、糖原(PAS)反应阳性、醋酸AS-D萘酚酯酶(NAE)反应阳性。流式细胞术免疫分型检查:此类原始幼稚细胞CD7、CD9、CD13、CD33、CD34、CD36、CD41a、CD42b和CD61表达阳性;CD2、CD3、CD4、CD5、CD8、CD10、CD11a、CD11b、CD11c、CD14、CD15、CD19、CD35、CD38、CD44、CD56、CD64、CD95、CD99、CD117、CD123、人类白细胞抗原DR(HLA-DR)、cCD3、cCD79a和细胞内髓过氧化物酶(cMPO)表达阴性。主要表达原始髓系细胞和巨核细胞标志,提示符合AMKL的免疫分型。结合以上各项检查结果分析,考虑诊断该患儿为AML-M7型。染色体核型分析:采用直接法、24 h培养法和同步法制备染色体;G显带技术显带;根据《人类细胞遗传学国际命名体制(ISCN,1995 )》描述核型:46,XY,t(4;11)(q21;q23),del(12)(p11)[9]/46,XY[1]。间期细胞荧光原位杂交(FISH)检测:采用染色体短期培养法培养的标本,气干法滴片,实验方法按说明书操作,分析间期细胞400个。在检测范围内,MLL探针可见阳性信号,阳性率约为93.0%,见图1。反转录多重巢式聚合酶链反应(RT-PCR)检测:于初诊化疗开始前采集骨髓标本2 mL;用淋巴细胞分离液提取单个核细胞;按Trizol一步法提取细胞总RNA;以禽成髓细胞白血病病毒(AMV)反转录酶合成cDNA;检测的融合基因及引物序列见文献[5]。结果显示融合基因MLL-AF4检测阳性,见图2。实时荧光定量RT-PCR(RQ-PCR)检测:采用RT-PCR的标本,进行RQ-PCR检测,结果显示融合基因MLL-AF4阳性,见图3。按AML方案行柔红霉素+阿糖胞苷联合化疗(DA)方案诱导缓解化疗1个疗程,骨髓完全缓解(CR);随后予柔红霉素+阿糖胞苷+依托泊苷联合化疗方案(DAE)巩固化疗1个疗程;大剂量阿糖胞苷根治性化疗1个疗程;化疗过程中予输注红细胞悬液与血小板支持、防治感染等综合治疗;未出现明显不良反应和并发症。随后监护人放弃治疗自动出院。所有检查及治疗患儿监护人均知情同意并签署知情同意书,本研究经医院医学伦理委员会批准[穗妇儿伦审批第(2016103101)号]。
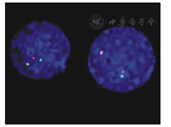

注:MLL:混合谱系白血病;MLL分离信号阳性,显示1个红色、1个绿色及1个黄色融合信号(1R1G1Y) MLL:mixed lineage leukemia;positive signal mode of MLL gene rearrangement,display 1 red,1 green and 1 yellow signals(1R1G1Y)
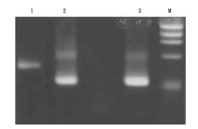

注:M:Marker;1:患儿;2:阴性对照;3:MLL-AF4融合基因阳性对照(420 bp) M:Marker;1:patient;2:negative control;3:positive control of MLL-AF4 fusion gene


注:蓝色曲线:患儿MLL-AF4融合基因曲线;红色曲线:阳性对照;绿色曲线:阴性对照。当反应Ct值≤ 33时,判定为阳性反应 Blue curve:patient′s MLL-AF4 fusion gene;red curve:positive control;green curve:negative control.Ct value for positive reaction of MLL-AF4 fusion gene is equal to or less than 33
AMKL是巨核系造血细胞被阻滞在某一分化阶段并异常增殖所致的AL。国内诊断标准:外周血中有巨核(小巨核)细胞;骨髓中原巨核细胞≥0.3,该原巨核细胞应有单克隆抗体或电镜证实;骨髓细胞少,往往干抽(取材失败),活检有原始细胞和巨核细胞增多,网状纤维增加[6]。该病的临床表现与其他类型AL类似,常有发热、贫血、出血等;AMKL的原始巨核细胞形态常发生变异,有时难以与ALL 2型淋巴细胞区别,易造成AMKL漏诊和误诊。AMKL的临床表现与白血病性原始巨核细胞有其自身特点:患儿一般无肝、脾、淋巴结大,如果存在也仅为轻度;AMKL原始巨核细胞的外形不规则、边缘不整齐、有指状突起或泡状突起;胞质可见空泡并伴伪足、部分细胞还可见到血小板生成。同时,根据AMKL的诊断标准,原始细胞单克隆抗体免疫分型检查对AMKL的诊断非常重要。有文献报道,抗血小板单克隆抗体CD41与CD61在幼稚及分化较差的巨核细胞内多见,CD42多见于较成熟的巨核细胞,故CD41、CD42及CD61单抗阳性对AMKL有确诊价值;除此之外,在AMKL中单抗CD36也特征性阳性[7]。本例患儿骨髓细胞形态学及细胞免疫分型均符合上述诊断标准,故AMKL诊断明确。
伴MLL基因重排的AL发病年龄低、恶性程度高、对常规化疗不敏感、缓解率低、缓解后易复发、易发生中枢神经系统白血病。WHO已将伴11q23(MLL)的AL单独列出分为一类,作为AL预后不良的独立指标[8]。MLL基因重排包括易位、自身重复、倒位及缺失等,其中又以易位最为常见,可导致MLL与各伙伴基因融合形成融合基因。目前已报道,且在分子水平已被证实的MLL伙伴基因约有79个,包括AF4(4q21)、AF9(9p22)、AF10(10p12)及AF19(19p13.3)等;其中t(9; 11)(p22; q23)生成的MLL-AF9及t(10; 11)(p12;q23)生成的MLL-AF10是儿童AML中较常见的涉及MLL易位的融合基因,二者分别占到儿童AML涉及MLL易位形成融合基因的36.1%和19.8%;t(4; 11 )(q21; q23 )生成的MLL-AF4融合基因常见于儿童ALL,占儿童ALL涉及MLL易位形成融合基因的47.3%;其在儿童AML较为少见,只占儿童AML中涉及MLL易位形成融合基因的0.9%[9]。对于儿童AMKL,Inaba等[10]研究结果表明,儿童AMKL中最常见的染色体易位为t(1; 22 )(p13; q13);涉及MLL易位形成的融合基因中最常见的是t(9;11)(p22;q23 )生成的MLL-AF9及t(10; 11)(p12;q23)生成的MLL-AF10;与FAB分型中其他类型的AML比较无明显差异。而MLL-AF4融合基因在儿童AMKL中仅有极个别病例报道[11]。目前国内有关儿童AMKL融合基因的研究报道较少,本例患儿为中国人AMKL中首次检测到同时伴MLL-AF4融合基因的病例。
在治疗方面,由于本病进展快、预后差、联合化疗效果常常不佳,AMKL被认为是一种高度危险亚型的AL。特别是对于那些伴MLL易位的AMKL,5年无事件生存(EFS)率及总生存(OS)率仅为28.5%、32.4%[10]。有文献报道,对non-DS-AMKL患者予强化疗为诱导缓解治疗,在初次缓解后采用HLA配型相合的异基因造血干细胞移植,3年OS率达到82.0 %,预后较传统化疗明显提高[12]。Yang等[13]以异基因外周血造血干细胞移植(allo-HSCT)来治疗MLL基因重排阳性AML患者,也取得了不错的疗效。可见,对于本例AMKL患儿,接受allo-HSCT或许是其治疗的最佳手段。HOX基因在胚胎发育及细胞分化过程中发挥重要作用,野生型MLL蛋白可通过调节HOX基因表达来决定细胞的存活。MLL易位导致MLL基因和来自"伙伴"染色体的配体基因融合,从而转录出融合基因转录本,编码嵌合蛋白;这些融合蛋白可通过DNA甲基化使野生型MLL基因沉默,影响其对下游HOX基因表达的调节,细胞增殖不受抑制,导致AL的发生。目前国外已有学者研究针对这些融合蛋白的靶向治疗药物,阻断其对野生型MLL基因的影响[14]。希望将来研究能取得突破性的进展,为该亚型AL治疗提供新策略,显著改善MLL融合基因阳性AML患者的预后。


























