
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Blau综合征(Blau syndrome,BS)是一种罕见的肉芽肿性自身炎症综合征,致病基因多由CARD15/NOD2突变所致,该位点精氨酸被色氨酸取代而致其发病[1]。其临床三联征包括皮炎、关节炎和复发性葡萄膜炎。皮肤和关节受累最常见,眼睛症状常较晚出现,但最具诊断意义[2]。由于其罕见性,BS目前无最佳治疗方法。如激素治疗效果不佳,可应用免疫抑制剂和生物制剂,特别是存在眼部症状后。BS极易被误诊。现分析1例BS患儿临床、实验室、病历资料和基因检测结果,以期提高临床医师对该病的认识。
患儿,女,3岁9个月,患儿1岁时因"四肢关节肿胀6月余,反复发热3个月余"收住重庆医科大学附属儿童医院。患儿出生后6月余出现双手、足及双下肢关节附近肿胀,并有下肢皮肤干燥伴黑棕色鳞屑。3个月后无明显诱因出现发热,多为中高热,伴四肢肿胀明显。入院诊断:幼年特发性关节炎(全身型)?给予注射用甲泼尼龙琥珀酸钠40 mg,1次/d,静脉滴注6 d,后给予泼尼松5 mg,3次/d,口服3周,之后调整为5 mg,2次/d,口服,半年后逐渐减量至2.5 mg,1次/d,期间发热及关节症状仍有反复。于2岁时行第1次环磷酰胺冲击(0.1 g×2 d),后每个月进行1次,累计8次(累积剂量1.6 g),同时口服泼尼松等药物,发热好转,但关节症状仍存在。于3岁时行生物制剂托珠单抗注射液(雅美罗)160 mg静脉滴注,后每半个月进行1次,累计5次(累积剂量800 mg),诉关节症状无明显改善,现患儿双侧踝关节、腕关节包块较前有所增加。门诊以"幼年特发性关节炎(全身型)?"收入。患儿系第1胎,第1产,足月顺产,出生体质量3.35 kg,产时无异常。生长发育史:活动量差于同龄儿童。按计划预防接种,无过敏史。否认家族中有类似疾病史。
体质量15 kg,体温36.6 ℃,脉搏97次/min,呼吸26次/min,发育正常。双手、双下肢皮肤干燥伴黑棕色鳞屑样皮疹(图1)。右踝、右腕关节附近各有一囊性包块,压之不痛。双腕、指间及双膝关节有触痛,心肺腹查体未见异常。
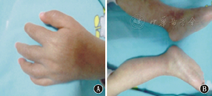

注:A:手部陈旧性皮疹;B:双下肢皮肤鱼鳞样变 A:old scaly rash of hand;B:skin scaly rash in surfaces of the legs
血常规、红细胞沉降率(ESR)、C反应蛋白(CRP)均正常。免疫球蛋白及补体正常,自身抗体、抗中性粒细胞胞质抗体阴性,骨髓学检查正常。关节彩超:双膝关节髌上囊少量积液。双手、双下肢平片未见异常。心脏彩超、胸腹部CT平扫+增强:未见异常。眼底检查:双眼视网膜渗出,玻璃体浑浊。右腕关节囊性包块活检:肉芽肿样变(图1、图2)。
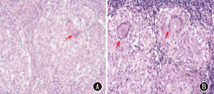

注:A:真皮浅层局灶肉芽肿(HE染色,×100);B:多核巨细胞浸润(HE染色,×400) A:focal granuloma in dermal superficial (HE staining,×100);B:multinucleated giant cells infiltration(HE staining,×400)
入院后行NOD2/CARD15基因检测,显示一杂合突变。修正诊断:BS。给予肿瘤坏死因子(TNF-α)拮抗剂益赛普12.5 mg(0.8 mg/kg)肌内注射,第6天关节症状好转出院,嘱其益赛普肌注1次/周。4周后门诊随访未诉关节疼痛,复查眼底正常。
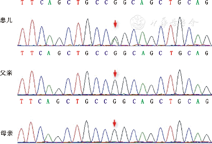
经充分告知后,患儿家长签署知情同意书,并经医院医学伦理委员会批准。提取外周血DNA,将纯化PCR产物与GenCap™探针作用,使用DNA测序仪对捕获DNA文库进行测序,GATK软件分析,Sanger测序法对候选变异基因验证,同样方法检测其父母基因型。结果显示:一杂合突变(c.1001G>A,p.Arg334Gln),导致第334号氨基酸由精氨酸变异为谷氨酰胺,为错义突变(图3)。经家系验证分析,此变异为自发突变。

BS多由NOD2(核苷酸结合低聚化结构域2)基因突变引起,该基因位于染色体16q12.1-13,R334Q和R334W占所有突变体50%左右[3]。NOD2基因属于NOD样受体家族(NLR)成员,是先天性免疫的组成部分,可在巨噬细胞、树突状细胞和上皮细胞中表达。NOD2存在于细胞质中,其羧基端由富含亮氨酸的重复区域(LRR)组成(图4),LRR结构域可与NOD2配体胞壁酰二肽(MDP)(细菌细胞壁肽聚糖的降解产物)结合,介导病原体和宿主分子间相互作用;中心结构域由NOD/NACHT组成,可介导自身低聚化,是NLR活化必需的结构域;其N端由富含半胱天冬酶的效应区(CARD)组成,可触发核转录因子(NF)-κB活化[4],启动炎性基因转录过程,最终引起肉芽肿性炎[5]。迄今为止,已报道的突变位点多位于NOD/NACHT结构域附近的NOD2蛋白,但也发现有延伸到LRR结构区域[6]。


BS通常于儿童时期起病,皮肤、关节和眼部受累为其主要特征,炎性标志物ESR和CRP可正常。皮肤首发表现多为斑丘疹,后期融合成片,四肢和躯干常对称出现。由于皮疹形态缺乏特异性,且患儿多有关节肿胀表现,因此极易被误诊为幼年特发性关节炎。关节炎和关节附近囊肿是BS常见的临床表现,手指、掌指、跖趾、踝关节及肘关节最常受累,囊肿部位活检为肉芽肿性浸润。确诊BS中约90%活检阳性,因此,活检对该病诊断具有重要参考价值[7]。本例后期有关节附近囊肿,行病理活检呈阳性。关节附近囊肿可破坏手足动脉而导致慢性关节炎,重者甚至发生关节强直。BS最重要的是存在眼睛受累,葡萄膜炎常频繁发生,其特征是眼痛、视力模糊和畏光。本例在托珠单抗注射液(雅美罗)治疗过程中出现视力模糊,眼睛受累表现常有助于BS诊断。眼部并发症包括白内障、青光眼和视网膜炎,因此眼科随访至关重要。
由于临床表现和病情罕见,BS至今无最佳治疗方案。糖皮质激素为一线用药,如激素治疗效果不佳或存在眼部症状,或泼尼松剂量≥10 mg/(kg·d),则应考虑使用免疫抑制剂和/或生物制剂,如英夫利昔单抗、TNF-α抑制剂、白细胞介素-1受体拮抗剂等[8]。最近,国外关于生物制剂治疗BS的随访发现,TNF-α抑制剂可明显改善关节及眼部症状[9]。此外,2例散发BS的研究发现,沙利度胺可通过抑制NF-κB活化以及介导单核细胞增殖、分化过程[6],因此可抑制肉芽肿性炎进展,也有望成为治疗BS的一种有效药物。


























