
评估儿童经逆行途径、前向途径或有无右心室起搏行经皮球囊主动脉瓣成形(PBAV)术的安全性及有效性。
回顾性分析2008年1月至2017年6月在广东省心血管病研究所接受PBAV术的32例先天性主动脉瓣狭窄患儿的临床资料,术后随访主动脉瓣残余狭窄与再狭窄、动脉损伤、主动脉瓣反流程度等并发症的发生情况。
32例患儿中男27例,女5例;年龄(55.8±52.0)个月(20 d~15岁);体质量(18.2±14.0) kg(3.5~59.0 kg)。其中2例经股静脉顺行途径左心导管检查,1例有介入指征通过未闭卵圆孔行PBAV术,其余均为股动脉途径,24例右心室快速起搏。导管所测得的收缩期跨瓣压差由术前(81.6±28.0) mmHg(1 mmHg=0.133 kPa)下降至(41.4±19.0) mmHg,差异有统计学意义(t=9.543,P=0.000);术后次日多普勒超声测量收缩期主动脉瓣跨瓣峰值压差由术前(82.7±23.0) mmHg下降至(44.6±18.0) mmHg,差异有统计学意义(t=11.732,P=0.000)。术中测量主动脉瓣环直径(13.8±3.0) mm(6.5~21.0 mm),选择球囊直径(14.1±4.0) mm (6~23 mm)。术后随访1~72个月,术后次日多普勒超声测量收缩期主动脉瓣跨瓣峰值压差与随访比较差异有统计学意义[(44.6±18.0) mmHg比(58.6±30.0) mmHg,t=-2.549,P=0.016]。5例(14.7%)患儿PBAV术后因再狭窄或合并中至重度反流行外科手术。术后即刻新增轻度反流7例。1例术后第2天死亡,1例股动脉栓塞。
随着PBAV术的步骤规范、多样化及介入器械的不断改良,PBAV术对于儿童先天性主动脉瓣狭窄可起到很好的缓解作用,并且安全性不断提高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
主动脉瓣狭窄(aortic stenosis,AS)占所有先天性心脏病的2%~5%,是一个潜在威胁生命的疾病[1,2]。新生儿发生危重AS时体循环常依赖动脉导管维持,动脉导管自行关闭可导致循环衰竭,甚至死亡。1984年Lababidi等[3]首次报道应用经皮球囊主动脉瓣成形(PBAV)术治疗先天性AS。现多种插管途径被用于PBAV术[4,5]经动脉的逆行性途径:通常采用经股动脉插管,新生儿和小婴儿也可采用经脐动脉、颈动脉、锁骨下动脉插管;经静脉的前向途径:通常采用经股静脉插管,也可采用经颈静脉、锁骨下静脉、脐静脉插管,然后通过卵圆孔或经房间隔穿刺进入左心房、左心室达升主动脉进行球囊扩张术。国内能开展儿童PBAV术的中心少,常规经股动脉行PBAV术。本研究回顾性总结了广东省心血管病研究所接受PBAV治疗的32例先天性AS患儿的临床资料,并国内首例经股静脉前向途径行PBAV术治疗1例新生儿AS,旨在探讨儿童经动脉逆行途径、经静脉前向途径或有无右心室起搏行PBAV术的安全性及有效性。
选择2008年1月至2017年6月广东省心血管病研究所AS住院患儿32例。其中男27例,女5例;年龄(55.8±52.0)个月(20 d~15岁);体质量(18.2±14.0) kg(3.5~59.0 kg)。32例患儿中<1岁9例,1例因晕厥就诊,1例因活动耐量下降就诊,余因发现心脏杂音、超声心动图提示AS就诊。术前超声心动图检查显示,27例主动脉瓣为三叶瓣,5例为二叶瓣,2例合并存在动脉导管未闭,1例合并小房间隔缺损,1例行外科主动脉瓣成形术5个月后再狭窄,其他患儿未伴其他心内结构畸形。
中国2015版《儿童常见先天性心脏病介入治疗专家共识》[6]中指出,经导管检查跨主动脉瓣压差≥50 mmHg(1 mmHg=0.133 kPa)或跨主动脉瓣压差≥40 mmHg,同时并静息或运动时有心绞痛、晕厥等症状,或心电图上有缺血性ST-T改变为PBAV术的明确适应证;依赖于动脉导管开放的新生儿单纯性重症AS及并左心室收缩功能减退的儿童单纯性AS,无论跨瓣收缩期压差如何,均推荐进行球囊扩张术。
前向途径:复合麻醉后,消毒铺巾,穿刺股静脉,置入5F动脉鞘管,穿刺桡动脉监测动脉血压,通过股静脉肝素化。4F右冠状动脉造影导管(JR3.5)在0.032 inch×260 cm超滑导丝引导下,经右心房-卵圆孔-左心房进入左心室,超滑导丝经左心室-主动脉瓣-升主动脉-降主动脉,并测左心室及升主动脉压力计算跨瓣压差。交换4F猪尾导管于左心室,在正侧位投照体位下,手推造影剂行左心室造影,显示瓣口的位置及瓣环径,根据瓣环径选择合适的球囊。在超滑导丝引导下,交换4F右冠状动脉冠脉导管经左心室-主动脉瓣置于升主动脉。交换0.018 inch×300 cm亲水涂层导丝,将导丝送入降主动脉。使用美敦力冠状动脉扩张球囊导管在0.018 inch×300 cm亲水层导丝引导下置于主动脉瓣,调节球囊中央位于主动脉瓣口,用压力泵压力7 bar下快速充盈球囊(图1),直至"腰凹"消失(充盈压力参照厂家标注),随着迅速抽空球囊,重复扩张主动脉瓣2~3次。重复测压及造影,拔除动脉鞘管,压迫止血。
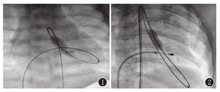

注:PBAV:经皮球囊主动脉瓣成形 PBAV:percutaneous balloon artic valvuloplasty
逆行途径及右心室起搏:复合麻醉后,消毒铺巾,穿刺右侧股静动脉,分别置入适合动脉鞘管,肝素化,必要时穿刺桡动脉监测动脉血压。经股静脉置入临时起搏导线至右心室心尖,调整起搏器参数,测试起搏效果良好。用猪尾造影导管在0.035 inch×260 cm超滑导丝或普通J型导管引导下经股动脉逆行置于主动脉根部造影,观察主动脉瓣有无反流及反流程度、瓣口负性射流显示的瓣口位置并测量主动脉瓣环径。通常选用右冠状动脉导管或端侧孔导管在0.035 inch×260 cm超滑导丝辅助下通过主动脉瓣后,送入左心室,并测量跨瓣压力阶差。然后将交换超滑导丝经主动脉-主动脉瓣口-左心室(绕圈)-主动脉瓣口-升主动脉-降主动脉建立轨道或更换J形加硬交换导丝送至左心室心尖部,并沿导丝导入合适的球囊导管。调节球囊中央骑跨于主动脉瓣口,充盈球囊(图2),直至"腰凹"消失(充盈压力参照厂家标注),随即迅速抽空球囊。在球囊充盈前即刻开始以VVI模式起搏,起搏频率为160~180次/min,球囊抽空后立刻停止起搏。扩张后重复造影及测压,评估主动脉瓣开放以及主动脉瓣关闭不全的程度。术中球囊直径选择一般为瓣环直径0.9~1.0 cm,球囊长度通常新生儿与小婴儿为2~3 cm,儿童为4 cm。本研究征得患儿监护人知情同意,并通过医院医学伦理委员会批准(批准文号:2016427A)。
分别于术后次日、3、12个月及之后每年进行随访。随访内容包括超声心动图评估主动脉瓣有无残余狭窄与再狭窄以及是否需外科干预。并发症包括穿刺动脉损伤(动脉穿刺侧搏动减弱或消失)及有无主动脉瓣、二尖瓣反流及程度。
应用SPSS 19.0软件进行数据处理,符合正态分布的计量资料用 ±s表示,同一患儿球囊扩张术跨主动脉瓣压力阶差的前后变化比较采用配对t检验,P<0.05为差异有统计学意义。
±s表示,同一患儿球囊扩张术跨主动脉瓣压力阶差的前后变化比较采用配对t检验,P<0.05为差异有统计学意义。
1例20 d的新生儿选择股静脉顺行PBAV术;1例1个月20 d小婴儿通过股静脉顺行行左心造影及导管检查,测跨瓣压差19 mmHg,未行介入治疗(未纳入本组32例内);1例3个月的婴儿通过4F桡动脉鞘置入美敦力7 mm×20 mm冠状动脉球囊逆行PBAV术,余选择BALT或NUMED球囊进行逆行PBAV术,其中9例因第1次选择球囊成形后跨瓣压力下降不理想,先后用2个球囊扩张,24例有右心室快速起搏。
2例合并动脉导管未闭患儿,1例堵闭治疗,随后评估主动脉瓣跨瓣压差并行PBAV术;1例为极细小未闭动脉导管,无需处理。瓣膜成形术后,32例患儿的跨瓣压力阶差明显下降:导管所测得的收缩期跨瓣压差由术前(81.6±28.0) mmHg下降至(41.4±19.0) mmHg,差异有统计学意义(t=9.543,P=0.000);术后次日多普勒超声测量收缩期主动脉瓣跨瓣峰值压差由术前(82.7±23.0) mmHg下降至(44.6±18.0) mmHg,差异有统计学意义(t=11.732,P=0.000)。本组有2例患儿均穿刺股静脉,并通过卵圆孔行左心导管检查,其中1例有扩瓣指征,并开展国内首例经股静脉前向途径对新生儿行PBAV术,术前压差为75 mmHg,瓣环径为6.5 mm,选择美敦力的6 mm×20 mm冠脉球囊导管扩张主动脉瓣,压差降至45 mmHg。术后次日复查为53 mmHg合并二尖瓣反流面积为0.4 cm2,1个月随访为58 mmHg。术中测量主动脉瓣环直径(13.8±3.0) mm(6.5~21.0 mm),选择球囊直径(14.1±4.0) mm (6~23 mm),球囊与瓣环直径比值为1.00±0.14(0.64~1.28)。
本组患儿随访时间为(23.0±23.4)个月(1~75个月)。残余狭窄或再狭窄:随访终点多普勒超声测量收缩期主动脉瓣跨瓣峰值压差由术后次日(44.6±18.0) mmHg上升至(58.6±30.0) mmHg,差异有统计学意义(t=-2.549,P=0.016)。5例(14.7%)患儿PBAV术后因再狭窄或合并中至重度反流外科手术(表1)。3例接受主动脉瓣机械瓣膜置换术,1例接受主动脉瓣环心包补片扩大术(Konno术),1例接受Nicks主动脉根部扩大术。其中1例患儿5岁时行PBAV术,导管测量跨瓣压差由术前96 mmHg下降至66 mmHg;超声心动图测跨瓣压差由术前133 mmHg下降至77 mmHg,目前随访5年压差升至139 mmHg,拒绝接受治疗。
PBAV术后再狭窄或合并严重AR患儿行外科治疗
PBAV postoperative restenosis or combined with severe AR to surgical treatment
PBAV术后再狭窄或合并严重AR患儿行外科治疗
PBAV postoperative restenosis or combined with severe AR to surgical treatment
| 病例 | 年龄(岁) | 术前PG(mmHg) | 瓣环径(mm) | 球囊直径(mm) | 球囊/瓣环径 | 有无右心室起搏 | 术后次日PG(mmHg) | 术前AR(cm2) | 术后造影AR(cm2) | 次日AR(cm2) | 随访时间(年) | 随访PG(mmHg) | 随访AR(cm2) | 手术名称 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 5 | 82 | 12.5 | 12 | 0.96 | 有 | 71 | 0 | 无 | 0 | 0.5 | 78 | 0 | 主动脉瓣环心包补片扩大术/Konno术 |
| 2 | 5 | 97 | 18.0 | 18 | 1 | 有 | 42 | 0 | 少量 | 2.1 | 3.0 | 54 | 6.7 | 机械瓣置换术 |
| 3 | 9 | 62 | 15.0 | 15/18a | 1.00/1.20 | 有 | 22 | 0 | 少量 | 0.8 | 3.0 | 47 | 3.5 | 机械瓣置换术 |
| 4 | 10 | 154 | 16.0 | 15/18a | 0.94/1.12 | 有 | 74 | 0 | 0 | 0 | 5.1 | 157 | 4.8 | 机械瓣置换术 |
| 5 | 9 | 101 | 15.0 | 15 | 1 | 有 | 50 | 0 | 少量 | 1.6 | 5.5 | 83 | 8.8 | Nicks主动脉根部扩大术 |
注:PBAV:经皮球囊主动脉瓣成形;AR:主动脉瓣反流;PG:超声心动图检测跨收缩期跨主动脉瓣峰值压差;a15/18为先后所用球囊直径,1 mmHg=0.133 kPa PBAV:percutaneous balloon artic valvuloplasty;AR:aortic regurgitation;PG:the peak systolic aortic valve gradient measured by Doppler echocardiography;a15/18 successively with the balloon diameter
术前超声心动图检查显示并轻度主动脉瓣反流3例;术后即刻主动脉瓣上造影出现微量主动脉瓣反流3例,轻度反流7例。随访超声心动图6例轻度反流,5例中度反流,2例重度反流。除外1例术后出现蛛网膜下腔出血抢救无效死亡,1例出现二尖瓣裂并轻度反流,1例8个月婴儿经股动脉逆行PBAV术后出现股动脉栓塞,家属拒绝进一步治疗,办理出院。2例通过股静脉途径术中均出现心率减慢,其中1例球囊扩张过程中出现心率由150次/min减慢至70次/min,并出现血氧饱和度下降,撤出球囊及静脉推注肾上腺素恢复;另外1例行左心导管检查中出现心率逐渐减慢,撤出导管后恢复。其他患儿均未出现心律失常、心脏穿孔等并发症。
轻度AS患者通常是无症状的,这种疾病的症状发生与有效代偿机制消失有关,低心排出量综合征主要表现为晕厥、头晕、缺血性疼痛、运动不耐受,心律失常导致心源性猝死的风险、心脏衰竭。一旦症状发生预后差,与高死亡风险有关。AS的诊断:典型的收缩期最大杂音定位在胸骨右缘第二或第三肋间隙,心电图显示左室肥厚,AS的术前诊断主要基于超声心动图检查。一位经验丰富的超声心动图医师能够精确地确定主动脉瓣的解剖是纤维化或钙化,评估疾病的解剖和血流动力学。2011年度美国心脏协会(AHA)制定的《儿童心脏疾病心导管检查与介入治疗适应证》[7]明确指出,心导管证实静息状态下跨主动脉瓣峰值压差>50 mmHg或跨主动脉瓣峰值压差≥40 mmHg同时伴心绞痛、晕厥或心电图缺血性ST-T变化者;或无论压差高低,AS患儿为依赖PDA存活或出现左心室收缩功能不全是PBAV术的Ⅰ类适应证。
PBAV术对于儿童AS可起到过渡作用。本组32例患儿行PBAV术后跨主动脉瓣收缩峰压差明显下降,并为最终行外科手术治疗的5例AS患儿争取时间。Ewert等[4]多中心回顾性分析1 004例接受PBAV的患者,PBAV术可有效延缓儿童AS的外科手术治疗时间,50%在介入治疗10年内无需外科干预。随着介入器械不断改良、精细程度不断提高,操作步骤也越来越规范,多种插管方式可供选择,并且PBAV操作简便、手术时间短、创伤小,术后患儿生活质量有明显提高,介入和外科治疗先天性AS病死率和远期生存率无明显差别[8]。尤其对于一些不能耐受外科手术的急、重症患儿,达到过渡或姑息治疗,为主动脉瓣置换术争取时间及暂时解除或缓解血流动力学对左心室的影响。
行PBAV术有血管损伤的风险[9],对于年龄小的患儿,特别是新生儿,PBAV术需要的动脉鞘相对患儿血管直径会偏大,股动脉较股静脉管腔小,如逆行PBAV术会导致严重动脉损伤,甚至闭塞。本组中有1例8个月婴儿经股动脉逆行PBAV术后出现股动脉栓塞。Balmer等[10]报道通过股动脉行PBAV术,年龄越小越容易出现动脉血管损伤,甚至闭塞。而新生儿及小婴儿经动脉除有股动脉损伤风险,其主动脉瓣反流出现或加重、动脉损伤概率均较经股静脉途径高[11,12]。顺行途径导丝及导管可顺着血流由左心室通过主动脉瓣,减少主动脉瓣穿孔或破裂的风险[13]。对于新生儿及小婴儿可穿刺静脉,经过未闭的卵圆孔或房间隔缺损行PBAV术。如无卵圆孔未闭,对于小婴儿尽可能选择直径小的动脉鞘。顺行途径或通过动脉途径可选用小球囊进行扩瓣,达到暂时的姑息治疗,不损伤动脉同时可以为将来进一步介入治疗争取时间,如胎儿肺动脉闭锁行球囊扩张,出生后可再次扩张。经股静脉前向途径操作时间会偏长及操作步骤偏多,可能会导致二尖瓣腱索的损伤,该方法是否利大于弊,仍需大样本及长期的随访疗效说明。
本组24例PBAV术采用快速右心室起搏,明显减少球囊的移位及扩张的时间,术中无心律失常发生。有文献报道同步右心室快速起搏可使心脏处于暂时低心排状态,动脉血压降低至50%,从而使球囊稳定于主动脉瓣口;另一方面,右心室起搏还可以保护性防止扩张时恶性心律失常和扩张后一过性心动过缓的发生[14]。同时心室快速起搏并不会因为心室射血分数低下、左心室发育不良,增加心肌耗氧而增加介入治疗风险,如心室颤动[15]。右心室快速起搏对年龄小的儿童作用较小(年龄越小自主心率越快),用于年龄大的患儿作用更显著[4]。本组1例新生儿经股静脉前向途径行球囊扩张主动脉瓣,自主心率为150~160次/min,术中无右心室快速起搏,球囊扩张时稳定性较好。但新生儿或小婴儿瓣膜球囊扩张时容易出现心率减慢甚至停跳的风险,本研究中2例新生儿无右心室起搏而顺行途径行左心导管检查或PBAV术均出现心率减慢。
本组术后新增7例轻度瓣膜反流,随访过程迟发3例并其中7例进展为中至重度瓣膜反流,最终进行换瓣的5例中4例合并中至重度瓣膜反流。这与Sullivan等[16]报道相符,113例新生儿接受球囊扩张主动脉瓣,12%出现急性中至重度主动脉瓣反流,随访过程中局限和轻度反流可逐渐发展到中至重度。目前考虑为主动脉瓣行球囊扩张术时是球囊将狭窄的瓣膜撕裂,达到打开瓣膜的目的,术后由于瓣膜会长时间接收高压力的血流冲击更加容易出现瓣膜反流或反流面积逐渐增加,如心脏收缩期左心室压力及舒张期主动脉的压力。在一定条件下选择合适大小的球囊导管,可减少反流的发生,球囊导管选择的共识[6]是:球囊与瓣环直径比值<0.9是PBAV术后再狭窄的独立危险因素,球囊与瓣环直径比值>1.1则会使主动脉瓣反流的发生率显著增加,目前推荐的最佳球囊与瓣环直径比值为0.9~1.0。此外球囊长度选择[17]也是重要的,理想的球囊长度是能够安全地跨过主动脉瓣而不触及到二尖瓣腱索,球囊长度与直径的合适比例为≥3。
主动脉瓣反流中度以上被认为是PBAV术的禁忌证,Saia等[18]报道73例伴中、重度主动脉瓣反流的AS患者实施PBAV术,术后主动脉瓣反流面积仅少量增加,在此类患者中实施PBAV术并非绝对禁忌,但需要做好紧急主动脉瓣置换术(AVR)或经导管主动脉瓣植入术(TAVR)的准备工作。
PBAV术对于儿童AS的治疗起到一个很好的桥梁作用,暂时缓解其左心室后负荷,为将来外科换瓣手术争取时间。随着PBAV术的步骤规范及介入器械的不断改良,安全性不断提高。但本组样本量少,随访时间不长,同时这是一个回顾性的单中心研究,PBAV术的疗效及安全性仍需多中心协作、大样本、长期、规范的治疗及随访数据来证明。
所有作者均声明不存在利益冲突



























