
探讨抗生素诱导的菌群紊乱对幼年小鼠结肠黏膜屏障及免疫反应的影响。
20只Balb/c小鼠随机分为实验组和对照组,实验组通过灌胃给予抗生素混合物12 h/次,连续14 d,诱导肠道菌群紊乱,对照组予等量9 g/L盐水。第15天经腹腔注射脂多糖(LPS)诱导炎性反应,通过16SrRNA测序分析肠道菌群结构,HE染色观察结肠黏膜形态结构,甲苯胺蓝染色和免疫组织化学观察结肠黏膜免疫细胞浸润,实时荧光定量PCR(RT-PCR)检测炎性因子及紧密连接蛋白的表达情况,酶联免疫吸附试验检测小鼠粪便清蛋白水平。
抗生素暴露后小鼠肠道微生物构成明显改变,炎性因子白细胞介素(IL)-1β、IL-6、IL-8、IL-10、肿瘤坏死因子(TNF)-α mRNA表达水平分别为0.765±0.062、0.082±0.040、0.442±0.059、0.469±0.079、0.736±0.063,均明显低于对照组(1.738±0.243、1.090±0.104、1.151±0.136、1.066±0.102、1.539±0.218),差异均有统计学意义(均P<0.05)。抗生素暴露后小鼠肠屏障相关基因ZO-1和Occludin mRNA表达水平分别为0.639±0.071、0.770±0.067,均明显低于对照组(1.347±0.224、1.487±0.148),而粪便清蛋白水平高于对照组[(6.419±0.552) mg/L比(6.079±0.011) mg/L],差异均有统计学意义(均P<0.05)。
抗生素暴露导致肠道微生物群构成改变,对幼年小鼠结肠局部免疫及肠屏障功能的建立产生不利影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
人体的胃肠道是一个巨大的微生态系统,健康成人胃肠道菌群有1 000余种,总量达1014个,约10倍于人体细胞数量,编码了近200万个基因[1]。肠道是人体最大的消化器官,同时也是最大的免疫器官和代谢器官。儿童时期肠道菌群的定植与建立对出生后消化系统、免疫系统和代谢等发育和成熟具有重大作用[2],而相较于成人阶段,儿童时期肠道菌群更易受到外界因素的干扰而造成肠道菌群紊乱。近年来,随着抗生素的应用越来越广泛,口服抗生素,特别是青霉素,已成为全世界儿童最常用的药物[3]。人们越来越担心,抗生素早期暴露可能导致菌群紊乱、影响免疫反应、改变肠屏障结构,从而成为一系列感染性疾病、炎症性疾病及功能性胃肠病发生的基础。因此,阐明肠道菌群紊乱后肠黏膜免疫反应及肠屏障功能的改变,对认识肠道菌群功能、防治某些疾病具有重要意义。现就抗生素诱导菌群紊乱后幼年小鼠结肠屏障功能及免疫反应的变化进行研究,以期为临床抗生素合理应用、预防肠上皮屏障损伤相关胃肠道疾病的发生提供理论依据。
3~4周龄健康雄性Balb/c小鼠20只,体质量(15±1) g,由空军军医大学实验动物中心提供[SCXK(陕)2014-002],饲养于空军军医大学病理与生理学教研室清洁动物房内,给予标准实验室饲料和清洁自来水。饲养环境条件维持在温度(21±1)°C,相对湿度60%~70%,并保持正常的12 h/12 h光/暗周期。
PCR仪(PTC-200美国,Bio-Rad公司),荧光定量PCR仪(CFX96,美国Bio-Rad公司),酶标检测仪(BioTeK公司,美国),盐酸万古霉素、硫酸新霉素、两性霉素B、氨苄西林(MPBio公司,美国),甲硝唑(大连美仑生物技术有限公司),脂多糖(LPS)(上海笛医生物科技有限公司),甲苯胺蓝染液(西安赫特生物有限公司),大鼠单克隆抗体F4/80(Abcam公司,美国),小鼠清蛋白酶联免疫吸附试验(ELISA)试剂盒(GenWay公司,美国),RNAiso Plus、SYBR®Premix Ex Taq™II(Tli RNaseH Plus)和PrimeScript™RT Master Mix (Perfect Real Time)(TaKaRa公司,日本),实时荧光定量(RT)-PCR引物由上海生工生物工程有限公司合成,引物序列见表1,16SrRNA测序分析由上海烈冰生物医药有限公司提供技术服务支持。
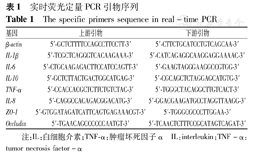
实时荧光定量PCR引物序列
The specific primers sequence in real-time PCR
实时荧光定量PCR引物序列
The specific primers sequence in real-time PCR
| 基因 | 上游引物 | 下游引物 |
|---|---|---|
| β-actin | 5′-GCTCTTTTCCAGCCTTCCTT-3′ | 5′-CTTCTGCATCCTGTCAGCAA-3′ |
| IL-1β | 5′-TCGCTCAGGGTCACAAGAAA-3′ | 5′-CATCAGAGGCAAGGAGGAAAAC-3′ |
| IL-6 | 5′-CTGCAAGAGACTTCCATCCAGTT-3′ | 5′-GAAGTAGGGAAGGCCGTGG-3′ |
| IL-10 | 5′-GCTCTTACTGACTGGCATGAG-3′ | 5′-CGCAGCTCTAGGAGCATGTG-3′ |
| TNF-α | 5′-CCACCACGCTCTTCTGTCTAC-3′ | 5′-TGGGCTACAGGCTTGTCACT-3′ |
| IL-8 | 5′-CAGGCCACAGACGGACATG-3′ | 5′-GGACGAAGATGCCTAGGTTAAGG-3′ |
| ZO-1 | 5′-GTGGATAGATCATTCAGTGAGAAACGT-3′ | 5′-TGGGCGCCCTTGGAA-3′ |
| Occludin | 5′-TGAACAGCCCCCCAATGT-3′ | 5′-TCAACTCTTTCCGCATAGTCAGAT-3′ |
注:IL:白细胞介素;TNF-α:肿瘤坏死因子α IL:interleukin;TNF-α:tumor necrosis factor-α
实验动物随机分为实验组和对照组,每组10只。实验组小鼠每12 h给予经口灌胃由广谱抗生素氨苄西林(100 mg/kg)、万古霉素(50 mg/kg)、甲硝唑(100 mg/kg)、新霉素(100 mg/kg)和抗真菌药两性霉素B(1 mg/kg)组成的抗生素混合物,加入了两性霉素B是为了预防真菌过度生长或机会性感染,连续处理14 d诱导小鼠肠道菌群紊乱[4],对照组小鼠给予等量9 g/L盐水。末次灌胃12 h后,超净台下收集2组小鼠粪便于无菌冻存管中,并迅速放入液氮中保存,用于16SrRNA测序分析。2组小鼠收集粪便6 h后分别一次性腹腔注射LPS(10 mg/kg)来诱导炎性反应,12 h后各组小鼠采集粪便于无菌EP管中,液氮速冻后-80 ℃冰箱保存。小鼠粪便采集后经脱颈处死,取出全胃肠道组织,测量全胃肠道及结肠长度,称取阑尾质量。收集结肠组织,预冷的9 g/L盐水将肠腔内容物冲洗干净,部分经40 g/L多聚甲醛固定后制作石蜡切片,剩余部分液氮速冻后-80 ℃冰箱保存用于RT-PCR分析。
2组小鼠经LPS刺激6 h后,每只小鼠收集0.5 mg左右粪便样品于无菌EP管中,每1 mg粪便样品加3 mL无菌蒸馏水充分溶解,4 000 r/min离心10 min(离心半径5 cm)分离上清,样本置-80 ℃冰箱保存备用。应用酶联免疫吸附试验(ELISA)法测定粪便中清蛋白水平,操作按试剂盒说明书进行。
取距离阑尾约2 cm处的近端结肠组织,用9 g/L盐水将肠腔冲洗干净,40 g/L多聚甲醛溶液固定8~12 h,依次经洗涤、脱水、透明、透蜡、包埋、切割、粘片后制成厚度6~10 μm的结肠组织石蜡切片,随后分别行HE和甲苯胺蓝染色,光学显微镜下观察结肠组织形态学特征及肥大细胞浸润情况。
结肠组织石蜡切片首先经室温脱蜡后、蒸馏水水化、热抗原修复,而后取出组织,甩干水分,用免疫组织化学笔在玻片上画圈围住组织。将切片放入湿盒中,滴加991 g/L过氧化氢,灭活内源性过氧化物酶,加牛血清清蛋白(BSA)封闭液,室温封闭后滴加一抗,湿盒4 ℃过夜。第2天,磷酸盐缓冲液(PBS)、蒸馏水洗涤后,滴加二抗,室温孵育10 min,洗涤,加抗生物素-过氧化物酶溶液,室温孵育10 min,洗涤,滴加DAB显色液,显微镜下观察3~10 min。染色合适即可终止染色,自来水冲洗。苏木精复染1~2 min,细胞核变蓝色即可终止,PBS冲洗反蓝。10 mL/L盐酸乙醇分化3 s,自来水冲洗3 min。梯度乙醇及二甲苯脱水。晾干后中性树胶封片,显微镜下拍照。
取出约100 mg冻存结肠组织,室温解冻后,加入适量RNAiso Plus后匀浆,依次加入氯仿、异丙醇、750 mL/L乙醇提取总RNA,然后使用PrimeScript™RT Master Mix (Perfect Real Time)将RNA反转录成cDNA。以反转录得到的cDNA作为RT-PCR反应的模板,在SYBR®Premix Ex Taq™II体系中进行扩增反应。采用二步法PCR反应程序(预变性:95 ℃,30 s;变性:95 ℃,5 s;退火/延伸60 ℃,30 s;循环数40),反应在CFX96仪器中进行。将数据标准化为内源对照β-actin分析目的基因相对表达量。
实验数据处理采用SPSS 20.0统计分析,结果以 ±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
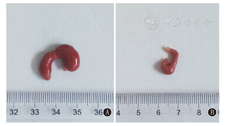
灌胃期间小鼠生长、摄食、饮水、呼吸和排泄等方面正常,干预2周后2组小鼠体质量增加无明显差别,灌胃后期实验组小鼠精神状况较对照组稍差。LPS诱导12 h后2组小鼠精神萎靡,活动能力减弱,伴腹泻等症状;抗生素暴露组小鼠结肠体积明显增大,阑尾及其内容物相对质量明显增高,差异有统计学意义(P<0.05),但2组小鼠全胃肠道长度及结肠长度无明显差异,差异有统计学意义(P>0.05)(图1、表2)。
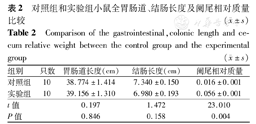
对照组和实验组小鼠全胃肠道、结肠长度及阑尾相对质量比较( ±s)
±s)
Comparison of the gastrointestinal,colonic length and cecum relative weight between the control group and the experimental group( ±s)
±s)
对照组和实验组小鼠全胃肠道、结肠长度及阑尾相对质量比较( ±s)
±s)
Comparison of the gastrointestinal,colonic length and cecum relative weight between the control group and the experimental group( ±s)
±s)
| 组别 | 只数 | 胃肠道长度(cm) | 结肠长度(cm) | 阑尾相对质量 |
|---|---|---|---|---|
| 对照组 | 10 | 38.774±1.414 | 7.340±0.150 | 0.016±0.001 |
| 实验组 | 10 | 39.156±1.310 | 6.980±0.193 | 0.056±0.001 |
| t值 | 0.197 | 1.472 | 23.010 | |
| P值 | 0.846 | 0.158 | 0.004 |

抗生素诱导的小鼠肠道菌群组成变化通过16SrRNA分析得到。为了评估抗生素暴露对小鼠的影响,本实验首先分析了α多样性,Shannon指数显示对照组小鼠菌群多样性明显高于实验组(6.965±0.128比4.691±0.392),差异有统计学意义(t=5.507,P<0.001)。具体到门水平,抗生素暴露后小鼠肠道菌群相对丰度发生了显著变化,具体表现为对照组小鼠肠道菌群主要由拟杆菌(53.4%)、厚壁菌(40.9%)、变形杆菌(4.0%)、无壁菌(1.4%)构成,而实验组小鼠肠道菌群主要由变形杆菌(38.3%)、蓝细菌(35.1%)、厚壁菌(22.8%)、放线菌(2.2%)、拟杆菌(1.4%)构成,二者比较实验组小鼠放线菌门、蓝细菌门相对丰度明显升高,拟杆菌门丰度明显降低(图2A, 图2B, 图2C),同时厚壁菌门相对丰度也降低(0.208 9±0.101 8比0.410 4±0.0419 7),差异有统计学意义(t=2.324,P<0.05)。当观察β多样性时(图2D),抗生素暴露组小鼠微生物群分布与对照组幼鼠比较差异有统计学意义。


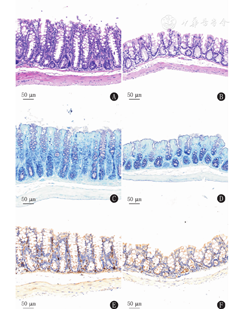
对照组小鼠结肠绒毛结构发达,隐窝明显,反映杯状细胞的空泡结构分布丰富,上皮细胞排列整齐,有明显炎性细胞浸润及肠黏膜上皮细胞脱落现象(图3A);实验组小鼠结肠绒毛结构发育落后,隐窝不明显,杯状细胞分布少于对照组,未见明显炎性细胞浸润及肠黏膜上皮细胞脱落(图3B);甲苯胺蓝染色显示对照组小鼠结肠黏膜组织内可见明显肥大细胞浸润(图3C);而实验组小鼠结肠组织未见明显肥大细胞浸润(图3D);免疫组织化学显示对照组小鼠结肠黏膜组织内有大量F4/80标记的(深棕色信号)巨噬细胞的浸润(图3E),而实验组小鼠结肠黏膜组织内仅见个别F4/80阳性细胞(图3F)。

抗生素暴露使小鼠肠道微生物定植障碍,从而导致小鼠固有免疫发育障碍,经LPS诱导后实验组小鼠结肠组织多种炎性因子(IL-1β、IL-6、IL-8、IL-10和TNF-α) mRNA相对表达水平均低于对照组,差异有统计学意义(P<0.05),见表3。
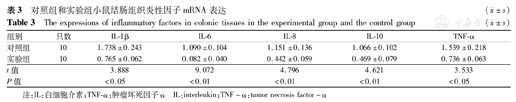
对照组和实验组小鼠结肠组织炎性因子mRNA表达( ±s)
±s)
The expressions of inflammatory factors in colonic tissues in the experimental group and the control group( ±s)
±s)
对照组和实验组小鼠结肠组织炎性因子mRNA表达( ±s)
±s)
The expressions of inflammatory factors in colonic tissues in the experimental group and the control group( ±s)
±s)
| 组别 | 只数 | IL-1β | IL-6 | IL-8 | IL-10 | TNF-α |
|---|---|---|---|---|---|---|
| 对照组 | 10 | 1.738±0.243 | 1.090±0.104 | 1.151±0.136 | 1.066±0.102 | 1.539±0.218 |
| 实验组 | 10 | 0.765±0.062 | 0.082±0.040 | 0.442±0.059 | 0.469±0.079 | 0.736±0.063 |
| t值 | 3.888 | 9.072 | 4.796 | 4.621 | 3.533 | |
| P值 | <0.05 | <0.01 | <0.01 | <0.01 | <0.05 |
注:IL:白细胞介素;TNF-α:肿瘤坏死因子α IL:interleukin;TNF-α:tumor necrosis factor-α
小鼠结肠组织紧密连接蛋白Occludin、ZO-1 mRNA相对表达量和粪便清蛋白水平见表4。经LPS诱导后,实验组小鼠紧密连接蛋白Occludin、ZO-1 mRNA表达水平低于对照组,而粪便清蛋白水平高于对照组。
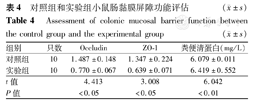
对照组和实验组小鼠肠黏膜屏障功能评估( ±s)
±s)
Assessment of colonic mucosal barrier function between the control group and the experimental group( ±s)
±s)
对照组和实验组小鼠肠黏膜屏障功能评估( ±s)
±s)
Assessment of colonic mucosal barrier function between the control group and the experimental group( ±s)
±s)
| 组别 | 只数 | Occludin | ZO-1 | 粪便清蛋白(mg/L) |
|---|---|---|---|---|
| 对照组 | 10 | 1.487±0.148 | 1.347±0.224 | 6.079±0.011 |
| 实验组 | 10 | 0.770±0.067 | 0.639±0.071 | 6.419±0.552 |
| t值 | 4.413 | 3.008 | 6.042 | |
| P值 | <0.05 | <0.05 | <0.01 |
抗生素是新生儿和儿科人群中常见的处方药物[3],约占所有处方药的25%。抗生素在防治各种感染性疾病的同时,也干扰了婴幼儿肠道正常微生物群的定植,导致微生物组发育延迟和耐药基因的产生[5,6],对婴幼儿健康产生短期或长期不良影响,如哮喘、肥胖、自闭症、变应性疾病、炎症性肠病等[7,8,9,10]。本研究发现,幼鼠暴露抗生素后菌群多样性显著降低,菌群结构明显改变,对照组小鼠肠道菌群主要由拟杆菌(53.4%)、厚壁菌(40.9%)、变形杆菌(4%)、无壁菌(1.4%)构成,而抗生素暴露后小鼠肠道菌群主要包括变形杆菌(38.3%)、蓝细菌(35.1%)、厚壁菌(22.8%)、放线菌(2.2%)、拟杆菌(1.4%),表明抗生素强烈的生物效应导致了小鼠肠道微生物结构发生改变。因此,抗生素应用尤其是生命早期阶段的抗生素应用可明显影响宿主菌群结构。
肠黏膜屏障由机械屏障、生物屏障、化学屏障和免疫屏障组成。其中,机械屏障作为肠黏膜屏障的最后一道防线,主要由黏膜上皮细胞及环绕黏膜上皮细胞顶侧的紧密连接蛋白构成,是决定肠上皮细胞间通透性的重要因素[11]。肠上皮机械屏障一旦受损,上皮细胞间隙通透性就会增加,细菌、内毒素及大分子物质就暴露于机体免疫系统下,导致一系列感染性疾病,炎症性疾病及功能性胃肠病发生。既往多项研究表明肠道益生菌可通过调节紧密连接蛋白表达改善肠道的通透性。体外研究表明婴儿双歧杆菌和嗜酸乳杆菌可通过抑制IL-1β诱导的核因子(NF)-κB激活和维持紧密连接蛋白正常表达而对肠上皮屏障起到保护作用[12];体内研究发现益生菌植物乳杆菌或鼠李糖乳杆菌GG株(LGG)或乳酸杆菌、双歧杆菌和链球菌的混合物可增加紧密连接蛋白ZO-1和闭合蛋白的表达来保护上皮屏障的完整性[13,14,15]。此外,有研究表明肠道微生物可通过胞外多糖分子,如肽聚糖、脂磷壁酸激活Toll样受体2(TLR)-2影响肠屏障相关紧密连接蛋白的表达[16],微生物也通过其代谢物产物来塑造肠屏障,如丁酸盐可促进黏液分泌,为上皮细胞提供能量,促进紧密连接蛋白的表达并增强炎症性肠病患者肠上皮屏障的完整性[17,18]。紧密连接蛋白Occludin、ZO-1是反映结肠和回肠细胞旁通透性的2个主要标志,而粪便清蛋白是肠屏障功能受损的良好指标,且已被证实与口服异硫氰酸荧光素(FITC)-葡聚糖法效果相当[19]。本研究发现抗生素暴露后小鼠结肠黏膜结构发育落后(绒毛低矮、隐窝不明显、杯状细胞分布减少);LPS诱导刺激后,免疫反应低下,表现为固有免疫细胞浸润不明显,炎性因子表达水平降低,但肠屏障受损更加严重,表现为紧密连接蛋白ZO-1、Occludin mRNA表达水平降低,粪便清蛋白水平升高。虽然既往研究表明炎性介质水平升高会导致紧密连接相关蛋白表达降低,进而导致肠道通透性增加[20],而在本研究中,实验组小鼠炎性因子表达下降,但肠黏膜屏障功能受损更加严重,可能是因为抗生素暴露虽然一定程度上抑制了肠道固有免疫应答,但也大大降低了肠道微生物及相关微生物因子水平,而肠道微生物及微生物相关因子可促进肠屏障建立和功能完善,且与低水平炎性因子相比,其在维持肠屏障稳态过程中扮演更加重要的作用,因此实验组小鼠肠黏膜屏障受损更加严重。
综上,本研究通过抗生素暴露造成幼年小鼠肠道菌群紊乱,证实了生命早期暴露抗生素可影响肠道免疫反应,对肠屏障结构产生不良影响,为临床上全面认识肠道菌群功能、合理应用抗生素提供了有力依据。
所有作者均声明不存在利益冲突



























