
近年来,血液系统恶性肿瘤的发病率逐年增高,虽然随着化疗、靶向治疗及造血干细胞移植的进展,部分类型淋巴瘤和白血病的疗效已经有了很大的提高,但其预后仍然较差、病死率高,寻找新的治疗方法提高疗效已成为当前亟须解决的问题。溶瘤病毒可通过选择性破坏肿瘤细胞并诱导机体发挥特异性抗肿瘤免疫的双重作用机制来促进抗肿瘤效应。目前溶瘤病毒已成为治疗多种恶性肿瘤的有效手段,在血液系统恶性肿瘤的治疗中也取得了许多突破性进展,现就近年来溶瘤病毒用于血液系统恶性肿瘤治疗中研究的最新进展进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血液系统恶性肿瘤是一类起源于造血系统的恶性克隆性疾病,在临床上,恶性血液肿瘤主要包括白血病、多发性骨髓瘤和恶性淋巴瘤。到目前为止,这3类血液恶性肿瘤的发病率都已排在恶性肿瘤的前10位。虽然随着化疗、靶向治疗及造血干细胞移植的进展,部分类型淋巴瘤和白血病的疗效已经有了很大的提高,但其预后仍然较差、病死率高,因而寻找新的治疗方法提高疗效成为当前亟须解决的问题。近年来,溶瘤病毒(oncolytic virus,OV)已成为肿瘤治疗研究中的热点。然而,OV在肿瘤治疗中的潜力才刚刚开始被发掘,根据其在临床试验研究中展示出的显著疗效以及可与多种抗肿瘤免疫治疗制剂联合使用的策略,使得OV在未来肿瘤治疗中占据重要的一席之地,现围绕几类已广泛用于血液系统恶性肿瘤研究的溶瘤病毒进行综述,并探讨提高溶瘤病毒疗效的策略及所面临的的挑战。
OV是指一类能够特异性感染肿瘤细胞,并在肿瘤细胞内大量复制增殖并最终破坏肿瘤细胞,而对正常细胞无杀伤作用的一类病毒。距人类认识到某些病毒具有破坏肿瘤细胞的能力已近一个世纪,随着对OV研究的不断深入,人们已可对多种病毒进行定向操作和改造从而改变和控制病毒的行为和功能。1991年首次成功对1型单纯疱疹病毒进行基因改造,之后如腺病毒及牛痘病毒等多种基因重组的OV相继研制成功,OV作为肿瘤治疗的新策略逐渐成为当前的研究热点。
已进入临床研究的OV主要有腺病毒(adenovirus,Ad)、牛痘病毒(vaccinia virus,VV)、单纯疱疹病毒(herpes simplex virus,HSV)、麻疹病毒(measles virus,MV)、水泡性口炎病毒(vesicular stomatitis virus,VSV),新城疫病毒(newcastle disease virus,NDV)和呼肠孤病毒(reovirus,RV)等(图1)[1]。至今,在全球范围内注册开展OV的临床试验已有百余项,有基因改造的OV,也有野生型或自然变异的弱毒株,涉及大多数常见的肿瘤类型。一系列的临床试验已完成,OV治疗肿瘤的安全性和有效性得以证实,取得了许多令人鼓舞的成果。2005年,我国食品和药品监督管理局(FDA)批准了Ad改造的H101 (安柯瑞)用于治疗难治性晚期鼻咽癌,从而成为全球第1个投入市场的OV类药物。2015年,携带粒细胞-巨噬细胞集落刺激因子(GM-CSF)基因HSV-1的Talimogene laherparepvec(T-VEC)通过美国FDA批准用于治疗复发难治的晚期黑色素瘤患者[2]。T-VEC的成功极大地刺激了OV的进一步开发。目前有望很快应用于临床的OVs还包括携带GM-CSF的溶瘤痘苗病毒JX.594、表达GM-CSF的溶瘤腺病毒CG0070以及野生型的RV等。
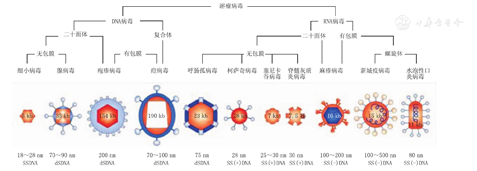

注:dsDNA:双链DNA; ssDNA:单链DNA;dsRNA:双链RNA; ss(+)RNA:单股正链RNA;ss(-)RNA:单股负链RNA dsDNA: double stranded DNA; ssDNA: single stranded DNA; dsRNA: double stranded RNA; ss (+) RNA: single stranded positive strand RNA; ss (-) RNA: single stranded negative strand RNA
在已知的近100万种脊椎动物病毒中,约有32万种被认为能感染哺乳动物细胞。
这些病毒有几个共同的特性,包括由单链或双链DNA或RNA组成的遗传物质以及具有在适当条件下感染宿主细胞并进行复制的能力。与标准的基于病毒的"疫苗"不同,OV是通过选择性破坏肿瘤细胞并诱导机体的特异性抗肿瘤免疫应答的双重作用机制来发挥抗肿瘤作用,目前OV杀伤肿瘤细胞的作用机制尚未完全阐明,但可能依赖于病毒在转化细胞内的大量复制、诱导凋亡等有关[2,3]。
虽然OV可同时感染正常细胞和肿瘤细胞,但正常的宿主细胞具有的抗病毒感染机制可检测到病毒入侵并及时清除,而肿瘤细胞常存在着抗病毒感染的缺陷。例如,蛋白激酶R(PKR)是帮助清除胞内病毒感染的关键因素,PKR在某些肿瘤细胞中的缺失从而导致病毒复制增加,而在低度恶性的肿瘤中PKR可具有正常活性,这些差异可影响OV的疗效。机体对OV的免疫反应似乎是抗肿瘤作用的重要组成部分,但它也可能是一把双刃剑。一方面,病毒可通过促进肿瘤抗原释放从而增强机体对肿瘤细胞的免疫应答,另一方面,中和抗体的产生可阻止病毒的感染及复制。在正常细胞中,多种信号通路参与了对病毒感染的识别并清除病毒,这些信号通路可由干扰素(IFN)或胞内Toll样受体(TLRs)的刺激而活化。TLRs是一类存在于细胞表面和胞内的模式识别受体,可被病原体相关分子模式(PAMPs),如病毒衣壳、DNA、RNA和病毒蛋白产物等激活。TLR信号通路的激活后可启动宿主细胞的抗病毒反应和机体的固有免疫应答。此外,OV诱导机体发挥的固有以及适应性抗肿瘤应答也被认为在OV清除肿瘤中发挥关键作用[4]。在肿瘤细胞死亡后,肿瘤细胞释放肿瘤相关抗原,这些抗原可促进适应性免疫反应,从而可导致远端肿瘤的消退。此外,病毒相关的PAMPs及损伤相关的分子模式(DAMPs)如热休克蛋白、高迁移率族蛋白B1(HMGB1)、钙网蛋白、三磷酸腺苷和Ⅰ型IFN、肿瘤坏死因子-α(TNF-α)和白细胞介素(IL)-12等细胞因子可促进树突状细胞等抗原呈递TNF-α细胞的成熟。这些细胞激活抗原特异性的CD4+和CD8+T淋巴细胞反应,从而发挥特异性抗肿瘤应答。
大量研究发现,某些OV可选择性地感染并破坏血液系统恶性肿瘤细胞,如多发性骨髓瘤和白血病细胞,而对正常造血干细胞无损害。因而OV在血液系统恶性肿瘤中的治疗越来越受到重视,一些OV已进入临床前研究甚至是临床试验阶段。目前,如MV、RV及VSV等已成为在血液系统恶性肿瘤中研究最广泛的几类OV[5]。
MV为单股负链RNA病毒,分类上属于副黏病毒科麻疹病毒属。野生型MV对淋巴细胞、巨噬细胞和树突状细胞表现出天然的嗜性并与之结合。MV在血液系统恶性肿瘤的治疗潜力已在20世纪70年代被首次确认,当时一系列的病例研究记录了白血病、Burkitt淋巴瘤和何杰金氏病患者合并有MV感染后出现了病情的缓解[6,7,8]。多发性骨髓瘤(MM)的首个临床前研究表明,MV-Edm株可选择性在多种MM细胞株及从6例患者体内中分离得到原代MM细胞中大量复制,在瘤内或静脉注射MV治疗也可显著缩小荷瘤鼠的肿瘤体积[9]。钠-碘同向转运体(NIS)是甲状腺滤泡细胞表达的糖蛋白,可利用跨膜的钠离子浓度将碘逆浓度梯度转运至细胞内,这是放射性碘治疗分化型甲状腺癌的基础。因而,构建的MV-NIS溶瘤病毒具有向肿瘤部位提供靶向放射治疗的潜力,在MV耐药的MM的肿瘤模型中,MV-NIS联合I131放疗显著增强抗肿瘤效应。在MV-NIS联合使用或不联合使用环磷酰胺治疗复发/难治性骨髓瘤患者的Ⅰ/Ⅱ期试验(NCT00450814)中,MV-NIS可优先感染CD138+细胞,1例患者持续9个月完全缓解,另外4例患者的游离轻链血清水平出现短暂下降[10]。此外尚有2项有关MV的临床试验正在进行中(NCT02192775及NCT03456908)。
RV属于呼肠孤病毒科的无包膜双链RNA病毒,直径为75 nm左右。RV一词来源于该病毒可感染呼吸道和肠以及病原性不明等特性。虽然RV广泛存在于人类呼吸道和消化道中,但绝大多数人在感染病毒后无症状,目前未发现该病毒与任何严重的人类疾病相关[11]。Alain等[12]发现多种淋巴瘤细胞株对RV易感,动物实验显示RV能有效抑制Raji细胞株(Burkitt′s淋巴瘤细胞)在免疫缺陷小鼠体内生长。RV可在体外直接杀伤急性髓细胞白血病(acute myeloid leukemia,AML)细胞株[13],当联合靶向药物,如利妥昔单抗后可显著提高对慢性淋巴细胞白血病(CLL)肿瘤细胞的杀伤效应[14]。
多项临床前研究已证明了RV在MM治疗中的疗效,RV可通过诱导内质网应激、凋亡及自噬来破坏MM细胞株,并可显著降低荷瘤鼠的肿瘤负荷。此外,当RV与硼替佐米或来那度胺联合使用可增强对MM细胞的杀伤以进一步增强抗肿瘤疗效。2014年报告了RV治疗复发性MM患者的Ⅰ期单剂试验(NCT01533194)[15]。该治疗耐受良好,但既使在大多数样本中检测到了病毒的RNA,而胞内仅检测到较低水平的病毒蛋白,因而建议在以后的研究中将RV与其他抗肿瘤治疗方案联合使用。目前有3项RV联合其他抗肿瘤药物如来那度胺或泊马度胺(NCT03015922)、硼替佐米及地塞米松(NCT02514382)、卡非佐米加地塞米松(NCT02101944)治疗MM的Ⅰ期临床试验正在进行中[16]。
与正常细胞相比,大多数MM细胞及CD138+细胞上PD-L1的表达并不高,使得MM对抗PD-L1的治疗不敏感,但研究发现,RV处理后可促进RPMI-8226及U266等MM细胞株上CD274(PDL-1)的表达增高,因而RV可增强MM细胞对PDL-1抗体治疗的敏感性,从而为RV与PDL-1抗体联合治疗奠定了基础[17,18]。
高剂量的放化疗联合自体造血干细胞移植治疗血液恶性肿瘤失败的主要原因是疾病的复发。目前认为,肿瘤细胞随移植物的再次输入是导致复发的重要因素。由于RV感染可不损伤正常的造血干/祖细胞(HSPC)存活及功能,因此有研究将RV用于在干细胞移植前清除其中混有的肿瘤细胞,以提高移植后的生存率[19]。
VSV是单股负链RNA病毒,VSV通常感染牛、马和猪,而极少感染人类,感染后也通常无症状或仅表现为流感样症状。由于VSV未在人群中普遍存在,大多数患者体内没有预存抗体,从而使得VSV有望成为一种理想的OV。
虽然VSV可以感染多种类型的细胞,但在正常细胞中,PKR的激活和IFN-Ⅰ的产生能有效地抑制VSV的复制。然而,VSV很容易在存在PKR激活缺陷或IFN-I信号转导障碍的多种类型的肿瘤中复制。野生型VSV由于所表现出的神经毒性而在临床转化中受阻,Stojdl等通过在VSV基质蛋白(VSV△M51)中删除蛋氨酸51建立了一株减毒株。这种突变保证了病毒感染的安全性,并可增强病毒的干扰素敏感性,以及肿瘤趋向性。VSV△M51是目前正在开发的大多数VSV溶瘤病毒的基础。此外还有多种策略用于提高VSV的安全性,表达干扰素β(IFN-β)的VSV已进入Ⅰ期临床试验(NCT03017820和NCT01628640)。与MV类似,构建的VSV-NIS可通过放射性碘进行成像和治疗。目前正在开展的Ⅰ期临床试验(NCT03017820)旨在评价VSV-IFN-β-NIS在MM、AML或T淋巴细胞淋巴瘤治疗中的耐受性和安全性。
柯萨奇病毒(coxsackie virus,CV)是一类无包膜的正链RNA病毒,目前已鉴定出至少29株CV。CVA21可引起人类轻度呼吸道疾病,目前已对其溶瘤效应开展了大量的研究,研究发现CVA21能有效地杀伤MM细胞株以及从MM患者体内分离的CD138+细胞[20]。但CVA21使用导致的肌炎成为该病毒临床应用的障碍,为解决该问题,肌肉特异的miRNAs被插入到CVA21基因组的3′非翻译区。荷瘤小鼠瘤内注射CVA21,肿瘤体积缩小,生存期延长,野生型CVA21处理的小鼠出现了明显的肌肉炎症和坏死,但用肌肉特异性miRNAs CVA21处理的小鼠却没有出现这些不良反应。
由于VV与天花病毒存在类似的免疫原性,因此人类通过接种VV来预防天花已使得该病毒在世界范围内的绝迹,全世界已有超过2亿多人接种了牛痘痘苗,证明了VV使用具有极好的安全性,为VV应用于肿瘤治疗奠定了基础。早在1987年就报道了第1例使用VV治疗MM的研究,当时一位IgA多发性骨髓瘤患者静脉注射VV后,IgA水平显著下降,自然杀伤细胞活性增强[21]。随后使用删除了胸苷激酶(TK)和牛痘病毒生长因子(VGF)的VV进行的体外研究表明,MM细胞株对VV的杀伤作用敏感,仅在原代MM细胞中观察到病毒复制,双缺除株还能缩小MM小鼠移植瘤的体积,延长存活期。JX-594是由VV惠氏(Wyeth)株删除了胸苷激酶基因并插入GM-CSF改造而来,从已完成的临床试验数据来看,JX-594具有很好的肿瘤靶向选择性,因此在体内治疗恶性血液病方面具有很大的发展潜力[22]。
OV在临床应用中的主要限制之一是机体免疫反应产生的抗体对病毒的中和作用,中和抗体在宿主清除病毒的过程中起关键作用。从已开展的OV临床试验中已证实,瘤体内注射OV具有良好的安全性和耐受性,且疗效明显,如RV介入给药治疗头颈部肿瘤的研究已经进入了Ⅲ期临床试验。而单独静脉使用RV的疗效有限,推测与RV吸附到免疫细胞或进入无关组织,或是中和抗体的作用阻碍了RV到达肿瘤组织有关[23]。目前在临床研究中已发现,即使患者体内存在有高效价的中和抗体,仍有少量RV病毒可有效到达肿瘤部位而发挥溶瘤作用,推测病毒可通过"搭便车"到血细胞上来保护其免受中和抗体的作用[24]。因此,近年来为克服OV静脉给药方法的不足,人们逐渐开发出以细胞为运载工具的新型给药方式,即将OV吸附于具有肿瘤识别能力的细胞上,利用细胞对肿瘤组织的趋向性,帮助病毒越过复杂的血液环境而将病毒带至肿瘤部位。目前报道的细胞载体主要有肿瘤特异性T淋巴细胞、树突状细胞、间充质干细胞,甚至是近年来研究的热点嵌合抗原受体T淋巴细胞(CAR-T)等[25,26,27]。如使用照射处理的MM细胞可将MV-NIS运送至骨髓瘤小鼠模型的肿瘤部位,即使在抗MV中和抗体存在的情况下,负载MV的MM细胞也能延长荷瘤鼠存活率[28]。此外,Melzer等[29]发现,CD8+T淋巴细胞能够有效地负载VSV并将VSV传递给肿瘤细胞而不影响其自身的生存及抗肿瘤活性,CD8+T淋巴细胞负载VSV后可更有效的进行体内病毒运输并显著延长AML荷瘤鼠的生存期。这些结果表明,使用运载细胞来运载并传递OV可提高OV在肿瘤治疗中的疗效。但目前仍需通过大量的研究来比较并评价这些细胞载体的临床应用价值。此外,还需深入研究如何增强细胞载体的肿瘤靶向性、摸索OV装载到细胞载体的最适条件以及研究如何确保运载细胞准确的运载并释放OV等内容。
OV感染后机体的保护性免疫应答可限制病毒的体内传播,而病毒传递所诱导的细胞因子风暴反应可能导致全身炎症反应综合征(SIRS)、多器官功能衰竭,甚至死亡。正因为如此,实体瘤的直接瘤内OV治疗疗效显著,而OV在用于血液系统恶性肿瘤的治疗时需综合考虑以上因素来制定安全有效地治疗策略。联合化疗和造血干细胞移植是治疗恶性血液系统恶性肿瘤病的有效方法,早期的OV在血液系统恶性肿瘤中的应用主要是在自体干细胞移植前"清除"残余肿瘤。此外,环磷酰胺由于具有抑制抗病毒免疫反应的潜力,在与OV的联合治疗中也具有很大的吸引力。环磷酰胺是一种公认的治疗MM的药物。因此,OV与环磷酰胺联合治疗可通过下调机体抗病毒免疫反应来提高OV的疗效[30],还能特异性地减少抗MV和抗VSV中和抗体的产生。近年来,免疫检查点抑制剂也显示了与OV联合治疗的巨大潜力,在动物实验中就发现,VSV-IFN-β-NIS与PD-L1抑制剂联合使用可增强抗肿瘤免疫应答,延长AML小鼠的生存期[31]。
尽管对OV杀伤肿瘤细胞以及OV与宿主间的相互关系有了一定的了解,但还有许多机制仍然存在空白。而在保证OV溶瘤效应的同时还需考虑如何提高OV的肿瘤靶向性,使用细胞载体以及联合其他抗肿瘤治疗策略将是未来的发展方向。此外,应进一步探讨OV如何在改变了的肿瘤微环境中发挥有效的溶瘤作用,从而完善现有的OV治疗方案并开发出新的以OV为基础的肿瘤联合治疗方案。
所有作者均声明不存在利益冲突



























