
探讨Majeed综合征的临床特征、基因突变特点和诊治经验。
分析1例在中山大学孙逸仙纪念医院就诊的Majeed综合征患儿的临床表现、基因检测结果及诊治经过,并以"Majeed综合征"或"Majeed syndrome"在万方数据知识服务平台、维普中文科技期刊数据库、中国期刊全文数据库及PubMed数据库中检索,结合国内外的报道进行文献复习。
女,汉族,双胎之一,5月龄发病;以反复发热、四肢拒碰、贫血和生长发育落后为表现;基因检测发现LPIN2有2个杂合突变,c.1794-2A>G和c.469C>T;使用重组人白细胞介素(IL)-1受体拮抗剂疗效良好。
Majeed综合征可在汉族人群中发生,基因检测有助于早期诊断,IL-1受体拮抗剂可能使患者获益。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Majeed综合征是一种罕见的遗传病,以反复发热、慢性复发性多病灶性骨髓炎(CRMO)、先天性红细胞生成不良性贫血(CDA)为主要特征,可伴皮肤的炎症表现,如Sweet综合征[1]。生长迟缓、关节挛缩等并发症也可发生[2]。目前仅有4个中东和1个印度家系被报道[3,4,5,6,7,8,9],国内尚未见报道。本研究拟分析1例Majeed综合征患儿的临床资料并结合已有报道进行文献复习。
女,8月龄,因"反复发热伴四肢拒碰3个月余"入院,G1P1,孕32+5周早产,出生体质量1 500 g,有窒息抢救史,有新生儿胆红素脑病病史。双胞胎姐姐体健,父母非近亲结婚。查体:体质量7 kg(-1~-2 SD),身长66.5 cm(-1~-2 SD),头围:39 cm(<-3 SD),慢性病容,面色苍白,无皮疹,心肺无特殊,肝右肋下1.5 cm,边清,质软。四肢拒碰、拒按,关节无红肿。
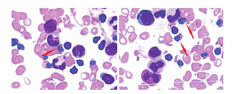
外院磁共振成像(MRI):右胫骨中下段、左胫骨全程髓腔内异常强化信号。入院:白细胞21.24×109/L,中性粒细胞0.125,淋巴细胞0.799,血红蛋白(Hb)81 g/L,血小板733×109/L,红细胞平均体积62.1 fL,红细胞平均血红蛋白水平18.7 pg,红细胞平均血红蛋白水平301 g/L,网织红细胞0.012 5。红细胞沉降率(ESR)81 mm/1 h,C反应蛋白(CRP) 86.3 mg/L,血清淀粉样蛋白A 334.0 mg/L。可溶性白细胞介素(IL)-2受体910.0 U/mL,肿瘤坏死因子-α 14.4 ng/L,IL-6 41.4 ng/L,IL-1β、IL-8、IL-10正常。血细菌培养、真菌抗原、真菌D-葡聚糖阴性。骨髓象(图1):红系增生活跃,晚幼红比值偏高,部分晚幼红可见花瓣核(多核)。B超:肝、脾形态、大小正常。

抽取患儿及其父母外周血2 mL,行包含LPIN2的基因检测,并采用Sanger法对突变位点进行测序验证。
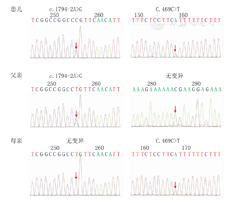
LPIN2发现2个杂合突变:c.1794-2A>G(剪接突变);c.469C>T p.R157X(无义突变)(图2),分别来源于父、母亲,该突变在人类基因突变数据库(HGMD)中未见报道,考虑为疑似致病性变异。

结合患儿临床表现及MRI、骨髓象,考虑该LPIN2基因变异具有致病性,明确诊断Majeed综合征。
予布洛芬抗炎,早期由于国内无法获得人IL-1受体拮抗剂,于12月龄起使用托珠单抗8 mg/(kg·次),每月1次,治疗6个月,症状改善,但四肢触痛反复。20月龄时至中国香港就诊,改用阿那白滞素30 mg/24 h,治疗2个月后症状完全缓解,复查ESR、CRP、Hb正常,炎性因子下降。因为经济原因,阿那白滞素于治疗8个月后改为30 mg/36 h,目前无不适,但体温37.1~37.2 ℃,监测ESR、CRP、Hb正常,门诊密切随访中。
本研究以"Majeed综合征"或"Majeed syndrome"为检索词,对万方数据知识服务平台、维普中文科技期刊数据库、中国期刊全文数据库及PubMed数据库进行检索,国内尚未见报道,对PubMed的报道总结见表1。
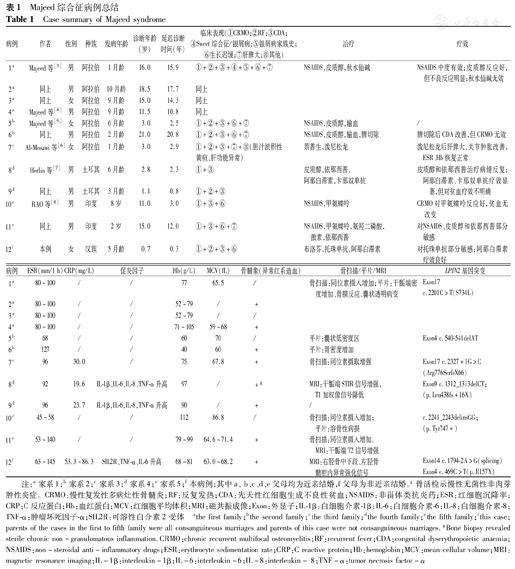
Majeed综合征病例总结
Case summary of Majeed syndrome
Majeed综合征病例总结
Case summary of Majeed syndrome
| 病例 | 作者 | 性别 | 种族 | 发病年龄 | 诊断年龄(岁) | 延迟诊断时间(年) | 临床表现(①CRMO;②RF;③CDA;④Sweet综合征/银屑病;⑤银屑病家族史;⑥生长迟缓;⑦肝脾大;⑧其他) | 治疗 | 疗效 |
|---|---|---|---|---|---|---|---|---|---|
| 1a | Majeed等[3] | 男 | 阿拉伯 | 1月龄 | 16.0 | 15.9 | ①+②+③+④+⑤+⑥+⑦ | NSAIDS,皮质醇,秋水仙碱 | NSAIDS中度有效;皮质醇反应好,但不良反应明显;秋水仙碱无效 |
| 2a | 同上 | 男 | 阿拉伯 | 10月龄 | 18.5 | 17.7 | 同上 | ||
| 3a | 同上 | 女 | 阿拉伯 | 9月龄 | 15.0 | 14.3 | 同上 | ||
| 4a | Majeed等[4] | 男 | 阿拉伯 | 9月龄 | 11.5 | 10.8 | 同上 | ||
| 5b | Majeed等[5] | 女 | 阿拉伯 | 6月龄 | 3.0 | 2.5 | ①+②+③+⑥+⑦ | NSAIDS,皮质醇,输血 | / |
| 6b | 同上 | 男 | 阿拉伯 | 2月龄 | 21.0 | 20.8 | ①+②+③+⑥+⑦ | NSAIDS,皮质醇,输血,脾切除 | 脾切除后CDA改善,但CRMO无效 |
| 7c | Al-Mosawi等[6] | 女 | 阿拉伯 | 1月龄 | 3.0 | 2.9 | ①+②+③+⑦+⑧(胆汁淤积性黄疸、肝功能异常) | 萘普生,泼尼松龙 | 泼尼松龙后肝脾大、关节肿胀改善,ESR、Hb恢复正常 |
| 8d | Herlin等[7] | 男 | 土耳其 | 6月龄 | 2.8 | 2.3 | ①+③ | 皮质醇,依那西普,阿那白滞素,卡那奴单抗 | 皮质醇和依那西普治疗病情反复;阿那白滞素、卡那奴单抗疗效显 著,但对贫血疗效不明确 |
| 9d | 同上 | 男 | 土耳其 | 3月龄 | 1.1 | 0.8 | ①+②+③ | ||
| 10e | RAO等[8] | 男 | 印度 | 8岁 | 11.0 | 3.0 | ①+③+⑥ | NSAIDS,甲氨蝶呤 | CRMO对甲氨蝶呤反应好,贫血无改变 |
| 11e | 同上 | 男 | 印度 | 2岁 | 15.0 | 12.0 | ①+③+⑥+⑦ | NSAIDS,甲氨蝶呤,氨羟二磷酸,激素,依那西普 | 对NSAIDS、皮质醇和依那西普部分敏感 |
| 12f | 本例 | 女 | 汉族 | 5月龄 | 0.7 | 0.3 | ①+②+③+⑥ | 布洛芬,托珠单抗,阿那白滞素 | 对托珠单抗部分敏感;阿那白滞素疗效良好 |
| 病例 | ESR(mm/1 h) | CRP(mg/L) | 促炎因子 | Hb(g/L) | MCV(fL) | 骨髓象(异常红系造血) | 骨扫描/平片/MRI | LPIN2基因突变 |
|---|---|---|---|---|---|---|---|---|
| 1a | 80~100 | / | / | 77 | 65.5 | / | 骨扫描:同位素摄入增加;平片:干骺端密度增加、骨膜反应、囊状透明病变 | Exon17 |
| c.2201C>T(S734L) | ||||||||
| 2a | 80~100 | / | / | 52~79 | / | + | ||
| 3a | 80~100 | / | / | 52~79 | / | / | ||
| 4a | 80~100 | / | / | 71~105 | 59~68 | + | ||
| 5b | 68 | / | / | 60 | 70 | / | 平片:囊状低密度区 | Exon4 c.540-541delAT |
| 6b | 127 | / | / | 40 | 60 | + | 平片:骨密度增加 | |
| 7c | 96 | 30.0 | / | 75 | 67.8 | + | 骨扫描:同位素摄取增强 | Exon17 c.2327+1G>C(Arg776SerfsX66) |
| 8d | 92 | 19.6 | IL-1β、IL-6、IL-8、TNF-α升高 | 97 | / | +g | MRI:干骺端STIR信号增强,T1加权像信号降低 | Exon9 c.1312_1313delCT;(p.Leu438fs+16X) |
| 9d | 96 | 23.7 | IL-1β,IL-6,IL-8,TNF-α升高 | 90 | / | + | / | |
| 10e | 45~58 | / | / | 112 | 86.8 | / | 骨扫描:同位素摄入增加;平片:溶骨性病损 | c.2241_2243delinsGG;(p.Tyr747*) |
| 11e | 53~140 | / | / | 79~99 | 64.6~71.4 | + | 骨扫描:同位素摄入增加。MRI:干骺端T2信号增强 | |
| 12f | 63~145 | 53.3~86.3 | SIL2R、TNF-α、IL-6升高 | 68~81 | 63.0~68.2 | + | MRI:右胫骨中下段、左胫骨髓腔内异常强化信号 | Exon14 c.1794-2A>G(splicing) |
| Exon4 c.469C>T(p.R157X) |
注:a家系1;b家系2;c家系3;d家系4;e家系5;f本病例;其中a、b、c、d、e父母均为近亲结婚,f父母为非近亲结婚。g骨活检示慢性无菌性非肉芽肿性炎症。CRMO:慢性复发性多病灶性骨髓炎;RF:反复发热;CDA:先天性红细胞生成不良性贫血;NSAIDS:非甾体类抗炎药;ESR:红细胞沉降率;CRP:C反应蛋白;Hb:血红蛋白;MCV:红细胞平均体积;MRI:磁共振成像;Exon:外显子;IL-1β:白细胞介素-1β;IL-6:白细胞介素-6;IL-8:白细胞介素-8;TNF-α:肿瘤坏死因子-α;SIL2R:可溶性白介素2受体 athe first family;bthe second family;cthe third family;dthe fourth family;ethe fifth family;fthis case;parents of the cases in the first to fifth family were all consanguineous marriages and parents of this case were not consanguineous marriages.gBone biopsy revealed sterile chronic non-granulomatous inflammation.CRMO:chronic recurrent multifocal osteomyelitis;RF:recurrent fever;CDA:congenital dyserythropoietic anaemia;NSAIDS:non-steroidal anti-inflammatory drugs;ESR:erythrocyte sedimentation rate;CRP:C reactive protein;Hb:hemoglobin;MCV:mean cellular volume;MRI:magnetic resonance imaging;IL-1β:interleukin-1β;IL-6:interleukin-6;IL-8:interleukin- 8;TNF-α:tumor necrosis factor-α
Majeed综合征于1989年首次由Majeed等[3]描述,作者报道了一个患有CDA、CRMO、Sweet综合征、生长迟缓和肝脾大的中东家系,并明确该病为常染色体隐性遗传。2000年、2001年Majeed等[4,5]补充了上述家系的另1例患者和1个新家系。2005年Ferguson等[9]对上述家系进行基因检测,鉴定出LPIN2为致病基因。LPIN2定位在18p11.31,大小约1.8 Mb,包含23个外显子。
CRMO和CDA是必备表现,多伴有周期性发热,生长迟缓也不少见。本例具备上述4个重要表现:反复发热、CRMO、CDA和生长发育落后。文献报道CDA为小细胞低色素性贫血,可伴有粒细胞减少、肝脾大,骨髓象示红系明显增生,见较多双核及多核幼红细胞,提示异常红系造血[10]。本例骨髓象见花瓣形(多核)晚幼红细胞,与上述报道一致。
基因检测是诊断的重要依据,本病例c.1794-2A>G突变位于外显子14,编码区第1794-2号核苷酸由腺嘌呤变异为鸟嘌呤,导致氨基酸剪接突变;c.469C>T突变位于外显子4,编码区第469号核苷酸由胞嘧啶变异为胸腺嘧啶,导致氨基酸无义突变。该突变涉及蛋白的剪接并导致蛋白合成提前终止,为复合杂合突变,结合临床表现,考虑为致病性突变。文献报道本病诊断延迟多见,但本例诊断时间短,得益于早期行免疫相关基因筛查。
LPIN2的基因产物lipin-2蛋白是一种Mg2+依赖的磷脂酸磷脂酶(phosphatidate phosphatase,PAP),在甘油酯类合成反应中起关键作用,在肝、肾、胃肠道、淋巴组织和骨髓中均有表达[11,12]。Donkor等[12]证实S734L不改变lipin-2的甘油酯类合成作用,但消除其PAP活性,提示PAP活性缺乏在Majeed综合征发病中有重要作用。研究发现lipin-2是NLRP3炎症小体(inflammasome)负调控的主要参与者,可调控炎症小体的活化程度[13]:降低IL-1β前体的水平;负调控Caspase-1前体的加工及IL-1β、IL-18的成熟过程。此外,lipin-2可减轻由饱和脂肪酸诱导的巨噬细胞的促炎信号[14]。
Majeed综合征属于自身炎症性疾病(AIDS),AIDS的发病多与炎症小体有关,炎症小体是Caspase-1、IL-1β和IL-18活化与成熟的平台[15]。阻断IL-1的治疗策略可改善Majeed综合征的临床症状[7],证明了IL-1在发病中起重要作用。该病以经验治疗为主,NSAIDS、皮质醇、双氯酸盐、甲氨蝶呤及生物制剂均有报道。有研究使用IL-1受体拮抗剂成功治疗3例患者[7,16]。本例治疗包括布洛芬抗炎和托珠单抗、阿那白滞素阻断炎性通路。托珠单抗和阿那白滞素疗效的差异也佐证了Majeed综合征为IL-1介导疾病的可能性。
综上,lipin-2对NLRP3炎症小体起负调控作用,LPIN2基因突变可能导致炎症小体活化失控,而针对IL-1及其受体的治疗临床证实有效,提示炎症小体异常活化并产生过多的促炎因子可能是Majeed综合征发病中重要的一环。本例为复合杂合突变,突变分别来自父母,而父母为非近亲结婚,考虑为散发病例,此为我国首次报道,扩展了Majeed综合征可累及的地域和人种。Majeed综合征临床罕见,发病年龄小,具有表型变异性,临床遇CRMO并反复发热、贫血、生长迟缓或皮肤表现者需注意该病的可能,行LPIN2基因检测可早期诊断,减少误诊。
所有作者均声明不存在利益冲突































