
回顾性分析儿童髓母细胞瘤(MB)的预后影响因素和生存状况。
2011年2月至2017年12月在首都医科大学附属北京世纪坛医院儿科接受治疗的MB患儿共224例,采用Kaplan-Meier法计算总体生存(OS)率和无进展生存(PFS)率,采用Log-rank比较不同组间的差异性,采用COX回归模型研究影响生存的多种因素。
截至2018年12月30日,224例患儿中位生存时间为4.1年,存活率为74.6%,完全缓解率为60.3%,复发率为31.7%,5年PFS率和OS率分别为(58.2±3.6)%和(72.5±3.3)%。高危、术后转移、年龄<3岁、脑脊液肿瘤细胞阳性患儿的5年OS率分别为(54.8±5.3)%、(57.7±5.9)%、(41.6±8.7)%和(53.0±7.3)%;MB大细胞/间变型患儿5年OS率为(35.3±13.6)%;MB 3型患儿5年OS率仅为(25.0±13.0)%。标危组、术后无转移、非大细胞/间变型、年龄≥3岁、脑脊液肿瘤细胞阴性患儿预后较好,5年OS率达70.0%以上,分别为(87.5±3.5)%、(80.3±3.7)%、(70.6±5.5)%、(78.3±3.3)%和(78.4±3.5)%。WNT分子亚型患儿预后最好,5年OS率为100.0%,而SHH分子亚型患儿5年OS率逊于4型患儿,差异有统计学意义[(64.8±5.8)%比(83.5±3.8)%,χ2=5.417,P=0.015]。年龄和脑脊液肿瘤细胞是影响患儿PFS和OS的独立危险因素(PFS:Wald=8.485、11.702,P=0.004、0.001;OS:Wald=16.274、7.191,P=0.000、0.007)。
3岁及3岁以上MB患儿的疗效已达较高水平,年龄和脑脊液存在肿瘤细胞是影响患儿OS率的独立危险因素,MB大细胞/间变型、脑脊液肿瘤细胞阳性、MB 3型和<3岁患儿的预后较差,需给予强化治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
髓母细胞瘤(medulloblastoma,MB)是儿童期最常见的恶性实体肿瘤之一,其发病率仅次于白血病,是儿童肿瘤相关死亡最常见的病因之一[1]。目前MB通过综合治疗(手术后联合放疗、化疗),5年无进展生存(progre-ssion-free survival,PFS)率已达70%~80%以上[2]。但MB极易出现脑脊液(CSF)播散,约30%的患儿在确诊时已出现颅内或脊髓转移[2],且规范治疗后约30%的患儿原位或脊髓复发[3],播散和复发患儿的预后极差[4,5]。本研究回顾性分析初次诊断MB患儿的临床特点,探讨预后相关危险因素,了解国内MB患儿的生存状况。
2011年2月至2017年12月初次诊断MB患儿共224例,均经磁共振成像(MRI)和病理学明确诊断,手术切除肿瘤后就诊于首都医科大学附属北京世纪坛医院儿科。患儿监护人均自愿接受治疗,并签署知情同意书,本研究通过医院医学伦理委员会批准(批准文号:2015伦审其他12号)。
根据患儿手术切除情况、肿瘤分期、组织病理学及分子生物学等进行分层治疗。肿瘤完全切除(gross total resection,GTR)指肿瘤全部切除;近全切除(near total resection,NTR)指肿瘤全部切除,仅留不易切除的薄层基底部,且残瘤<1.5 cm2;次全切除(subtotal resection,STR)指肿瘤大部分切除,但残瘤>1.5 cm2[6]。根据Chang′s分期标准分为4期[7],其中无转移为M0,CSF中找到肿瘤细胞为M1,小脑、第三脑室、侧脑室或蛛网膜下结节性种植为M2,脊髓蛛网膜下腔转移为M3,脑脊髓轴外转移为M4。根据组织病理学分为经典型、促纤维增生/结节型、广泛结节型和大细胞/间变型。根据分子生物学分为WNT型(wingless)、SHH型(sonic hedgehog)、3型(Group 3)和4型(Group 4)4个不同的亚群[8]。至少1次腰椎穿刺检查CSF找到肿瘤细胞即为CSF肿瘤细胞阳性。满足以下任何一项者为高危组:年龄<3岁;肿瘤转移(M1~M4);残瘤>1.5 cm2;大细胞/间变型;MYC基因阳性。否则即为标危组[9]。
根据欧洲血液肿瘤协作组HIT-SKK 2000方案治疗,<3岁和3~18岁患儿治疗方案不同[10,11]。
组织病理学为促纤维增生/结节型或广泛结节型行3个周期HIT-SKK 2000方案化疗。(1)环磷酰胺(CTX,800 mg/m2,第1-3天)+长春新碱(VCR,1.5 mg/m2,第1天);(2)甲氨蝶呤(MTX,5.0 g/m2,第1天,同时四氢叶酸解救)+VCR;(3)MTX+VCR;(4)伯尔定(200 mg/m2,第1-3天)+依托泊苷(150 mg/m2,第1-3天),同时予腰椎穿刺鞘内注射甲氨蝶呤(intrathecal injection of methotrexate,IT-MTX,10 mg/次),3个周期后改为(1)(4)交替化疗4次,无放射治疗;经典型和转移患儿先行HIT-SKK 2000方案化疗和IT-MTX,待年龄≥3岁或疾病进展时行放射治疗。
M0患儿行改良1轮HIT-SKK 2000化疗[(1)(4)交替化疗2次],无明显脑水肿表现则尽快颅脑照射治疗(craniospinal irradiation,CSI,剂量为23.4~26.0 Gy)和后颅窝增强照射(posterior fossa boost,PB)至54~58 Gy,随后接受巩固化疗8个疗程(顺铂70 mg/m2,第1天;VCR 1.5 mg/m2,第1、8、15天;洛莫司汀75 mg/m2,第1天,每42 d为1个疗程)。M0~M3患儿先行1~2周期HIT-SKK 2000方案化疗,同时IT-MTX(12.5 mg/次),肿瘤控制后CSI 36 Gy,后继续巩固化疗4个疗程。
治疗期间每2个疗程复查全脑全脊髓MRI,治疗结束2年内每3个月复查头颅MRI,每6个月复查头颅和脊髓MRI;治疗结束后2~5年,每6个月复查头颅和脊髓MRI;5年后每年复查1次头颅和脊髓MRI。疗效标准:(1)完全缓解(complete response,CR):肿瘤灶完全消失,CSF肿瘤细胞阴性;(2)进展(progressive disease,PD):瘤灶增加≥25%和/或CSF肿瘤细胞阳性;(3)复发:肿瘤达CR至少1个月后再次出现新发病灶[14]。
根据国家癌症研究所(3.0版)常见毒性指标及分级标准评定[15]。血液学不良反应分级:Ⅰ级:粒细胞>1.5×109/L,血红蛋白>10.0 g/L,血小板>75.0×109/L;Ⅱ级:粒细胞(1.0~1.5)×109/L,血红蛋白8~10 g/L,血小板(50~75)×109/L;Ⅲ级:粒细胞(0.5~1.0)×109/L,血红蛋白(6.5~8.0) g/L,血小板(25.0~50.0)×109/L;Ⅳ级:粒细胞<0.5×109/L,血红蛋白<6.5 g/L,血小板<25.0×109/L。
采用SPSS 20.0软件分析。存活率为随访截止点存活例数占总体随访患儿的百分比,采用Kaplan-Meier法计算患儿的总体生存(OS)率(随机入组至任何原因引起死亡的时间)和PFS率(随机入组至第1次发生疾病进展或任何原因引起死亡的时间),采用COX回归模型研究影响生存的多种因素,2组间生存比较采用Log-rank检验,P<0.05为差异有统计学意义。
224例患儿中位年龄为6.6岁(0.8~15.9岁),男142例,女82例(1.7:1.0);其中<3岁33例,≥3岁191例。GTR/NTR 220例,次全切除者4例;M0 149例,M0~M3 75例(M1 3例,M2 21例,M3 51例);经典型123例,促纤维增生/结节型74例,广泛结节型10例,大细胞/间变型17例;分子分型:WNT 8例,SHH 96例,3型16例,4型104例;脑脊液肿瘤细胞阴性173例,阳性51例;高危组患儿103例,标危组121例。
截至2018年12月30日,224例患儿中位生存时间为4.1年(0.3~7.0年),167例患儿存活(存活率为74.6%),其中CR 135例(60.3%),PD 18例(8.0%),复发71例(31.7%)。
患儿5年PFS率和OS率分别为(58.2±3.6)%和(72.5±3.3)%。高危组和标危组患儿的5年PFS率分别为(37.9±5.1)%和(75.5±4.4)%;5年OS率分别为(54.8±5.3)%和(87.5±3.5)%,二者比较差异均有统计学意义(χ2=33.340、29.984,均P=0.000)。<3岁和≥3岁患儿5年PFS率分别为(33.1±8.2)%和(62.4±3.9)%,5年OS率分别为(41.6±8.7)%和(78.3±3.3)%,差异均有统计学意义(χ2=11.725、21.059,均P=0.000)。M0和M1~M3患儿5年PFS率分别为(68.3±4.2)%和(31.5±7.7)%,5年OS率分别为(80.3±3.7)%和(57.7±5.9)%,二者比较差异均有统计学意义(χ2=21.725、21.059,均P<0.05),见图1A~1C。
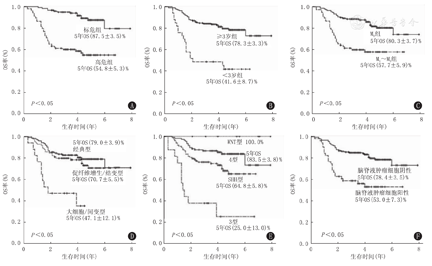

注:OS:总体生存 OS: overall survival
大细胞/间变型患儿3年PFS率和OS率分别为(27.5±11.2)%和(47.1±12.1)%,5年OS率为(35.3±13.6)%;非大细胞/间变型患儿3年PFS率和OS率分别为(69.8±3.2)%和(81.5±2.7)%,5年OS率为(70.6±5.5)%,二者比较差异均有统计学意义(χ2=7.314、10.803,均P<0.05);促纤维增生/结节型和广泛结节型5年PFS率和OS率分别为(64.6±5.3)%和(70.7±5.5)%,经典型患儿5年PFS率和OS率分别为(58.0±5.1)%和(79.0±3.9)%。WNT型患儿预后最好,5年PFS率和OS率均为100.0%,而3型患儿预后最差,5年PFS率和OS率分别为(25.0±10.8)%和(25.0±13.0)%;SHH型和4型患儿5年PFS率分别为(53.4±5.3)%和(65.1±5.3)%,5年OS率分别为(64.8±5.8)%和(83.5±3.8)%,二者比较差异均有统计学意义(χ2=7.641、10.803,均P<0.05)。CSF中肿瘤细胞阳性和阴性患儿的5年PFS率分别为(25.6±7.1)%和(67.5±3.9)%,5年OS率分别为(53.0±7.3)%和(78.4±3.5)%,二者比较差异均有统计学意义(χ2=23.025、13.442,均P=0.000),见图1D~1F。
COX回归分析结果显示,年龄、危险度分层和脑脊液肿瘤细胞对患儿的PFS有影响(均P<0.05);而年龄、病理分型和CSF肿瘤细胞同时影响患儿的OS(均P<0.05),见表1。
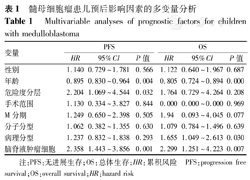
髓母细胞瘤患儿预后影响因素的多变量分析
Multivariable analyses of prognostic factors for children with medulloblastoma
髓母细胞瘤患儿预后影响因素的多变量分析
Multivariable analyses of prognostic factors for children with medulloblastoma
| 变量 | PFS | OS | ||||
|---|---|---|---|---|---|---|
| HR | 95%CI | P值 | HR | 95%CI | P值 | |
| 性别 | 1.140 | 0.729~1.781 | 0.566 | 1.122 | 0.640~1.967 | 0.687 |
| 年龄 | 0.895 | 0.830~0.964 | 0.004 | 0.805 | 0.724~0.894 | 0.000 |
| 危险度分层 | 2.204 | 1.069~4.544 | 0.032 | 1.764 | 0.729~4.264 | 0.208 |
| 手术范围 | 1.130 | 0.334~3.827 | 0.844 | 0.000 | 0.000~0.000 | 0.969 |
| M分期 | 1.249 | 0.650~2.398 | 0.505 | 1.94 | 0.093~4.045 | 0.077 |
| 分子分型 | 1.062 | 0.382~1.355 | 0.630 | 1.079 | 0.784~1.496 | 0.639 |
| 病理分型 | 1.237 | 0.832~1.838 | 0.293 | 1.655 | 1.049~2.613 | 0.030 |
| 脑脊液肿瘤细胞 | 2.358 | 1.443~3.856 | 0.001 | 2.299 | 1.251~4.223 | 0.007 |
注:PFS:无进展生存;OS:总体生存;HR:累积风险 PFS:progression free survival;OS:overall survival;HR:hazard risk
胃肠道不良反应主要表现为食欲下降(83.0%)和便秘(77.2%),其次为恶心(71.9%)、呕吐(72.8%),而腹痛、腹泻的发生率较低;肝损害程度均较轻,仅表现为轻度转氨酶升高(表2)。患儿均出现不同程度的血液学不良反应,主要表现为Ⅰ级和Ⅱ级,以粒细胞和血小板下降最为明显;少数患儿出现Ⅳ级不良反应,其中11例患儿输注单采血小板,5例输注悬浮红细胞(表2)。IT-MTX患儿无中枢神经系统不良反应,偶有患儿出现腰椎穿刺部位疼痛,予止痛及理疗后恢复。
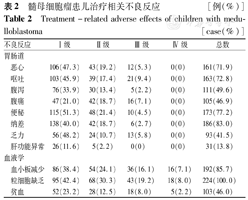
髓母细胞瘤患儿治疗相关不良反应[例(%)]
Treatment-related adverse effects of children with medu-lloblastoma[case(%)]
髓母细胞瘤患儿治疗相关不良反应[例(%)]
Treatment-related adverse effects of children with medu-lloblastoma[case(%)]
| 不良反应 | Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | 总数 | |
|---|---|---|---|---|---|---|
| 胃肠道 | ||||||
| 恶心 | 106(47.3) | 43(19.2) | 12(5.3) | 0(0) | 161(71.9) | |
| 呕吐 | 103(45.9) | 39(17.4) | 21(9.4) | 0(0) | 163(72.8) | |
| 腹泻 | 76(33.9) | 30(13.4) | 5(2.2) | 0(0) | 111(49.6) | |
| 腹痛 | 47(21.0) | 42(18.7) | 16(7.1) | 0(0) | 105(46.9) | |
| 便秘 | 115(51.3) | 48(21.4) | 10(4.5) | 0(0) | 173(77.2) | |
| 纳差 | 138(40.0) | 42(18.7) | 6(2.7) | 0(0) | 186(83.0) | |
| 乏力 | 56(48.2) | 24(10.7) | 13(5.8) | 0(0) | 93(41.5) | |
| 肝功能异常 | 26(11.6) | 5(2.2) | 0(0) | 0(0) | 31(13.8) | |
| 血液学 | ||||||
| 血小板减少 | 86(38.4) | 54(24.1) | 36(16.1) | 16(7.1) | 192(85.7) | |
| 粒细胞缺乏 | 95(42.4) | 68(30.3) | 43(19.2) | 18(8.0) | 224(100.0) | |
| 贫血 | 52(23.2) | 28(12.5) | 18(8.0) | 5(2.2) | 103(46.0) | |
71例患儿复发,占31.7%,其中颅内复发30例,脊髓复发9例,颅内和脊髓同时受累28例,髓外转移4例(骨髓转移3例,盆腔转移1例)。对复发患儿予强化治疗,5年OS率为(40.6±6.8)%。
MB是儿童时期常见的恶性脑肿瘤,对放疗、化疗均相对敏感,随着手术、放疗、化疗等综合治疗的实施,其预后得到了很大改善[16,17]。但各国MB的生存率存在较大差异,欧洲脑瘤患儿的5年OS已达70%以上[2],WNT亚型的5年OS率为95%~100%,SHH和4型的预后中等,5年OS率约为75%,而3型的预后最差,低于50%。德国von Bueren等[11]对123例术后转移的MB患儿予诱导化疗、放疗、巩固化疗的综合治疗,5年OS率为74%,其中促纤维增生/结节型为89%,经典型为75%,大细胞/间变型为40%。泰国Nalita等[18]随访45例髓母患儿,病死率为49.1%,5年OS率仅为53.8%,朝鲜Yoon等[19]对42例标危MB患儿放疗后化疗,5年OS率为(76.8±6.9)%。中国台湾学者Huang等[20]随访114例髓母患儿,其5年OS率为73%,其中大细胞/间变型极易复发,5年无复发率(relapse-free survival,RFS)为34%,5年OS率为56%;而经典型5年RFS率为76%,5年OS率为76%。美国Weil等[21]随访1 735例年龄4~11岁MB患儿,5年存活率为70%,手术和放疗模式是影响患儿生存的独立因素。
本研究结果显示,患儿中位生存时间为4.1年,截至随访结束仍有167例患儿存活,存活率为74.6%,CR率60.3%,复发率31.7%,5年OS率为(72.5±3.3)%,较本课题组既往报道(68.0%)有所提高[22]。高危组、术后转移、年龄<3岁、脑脊液肿瘤细胞阳性患儿的5年OS率较低,分别为(37.9±5.1)%、(57.7±5.9)%、(33.1±8.2)%和(25.6±7.1)%,而大细胞/间变型和3型患儿预后极差,5年OS率和3年OS率分别为(35.3±13.6)%和(25.0±13.0)%。标危组、术后无转移、非大细胞/间变型、年龄>3岁、脑脊液肿瘤细胞阴性患儿预后较好,5年OS率均达70.0%以上,分别为(87.5±3.5)%、(80.3±3.7)%、(70.6±5.5)%、(78.3±3.3)%和(78.4±3.5)%。分子分型WNT型患儿预后最好,5年OS率为100.0%,而4型患儿的预后优于SHH型患儿[(83.5±3.8)%比(64.8±5.8)%]。
Kirkman等[4]报道术后转移是影响患儿远期生存的危险因素,肿瘤NTR会导致短期内复发或进展,但对OS无明显影响,提示化疗和放疗可显著改善OS。本研究中220例患儿为肿瘤GTR/NTR,对患儿远期生存无明显影响,而年龄、病理分型和CSF肿瘤细胞是影响患儿OS的独立危险因素。Lafay-Cousin等[23]随访53例婴幼儿MB,5年OS率为(76.1±6.5)%,其中促纤维增生/结节型预后较好,5年OS率为(86.2±7.4)%,3型患儿的5年OS率为(49.1±14.0)%,且未接受放疗的经典型和3型患儿预后较差,其5年PFS率分别为58.0%和46.4%。本研究中<3岁患儿的5年PFS率和OS率分别为(33.1±8.2)%和(41.6±8.7)%,远低于上述报道,提示影响国内婴幼儿MB疗效的因素比较复杂,其治疗措施有待加强。
本研究中31.7%的患儿复发,以颅内和脊髓复发为主,髓外转移4例。复发患儿再次予强化化疗后5年OS率为(40.6±6.8)%。Koschmann等[5]随访55例复发患儿,复发后中位生存时间为10.3个月,3年OS率为18%。Sabel等[3]对338标危患儿随访,10年无事件生存(event free survival,EFS)率为(76±2)%,10年OS率为(78±2)%,72例复发(21.3%),3例继发恶性肿瘤,复发患儿给予再次手术、局部放疗、干细胞支持下大剂量化疗,其5年OS率仅为(6.0±4.0)%。本研究患儿均能耐受化疗,主要不良反应为胃肠道反应和不同程度的血液学不良反应,予对症处理均能恢复。IT-MTX患儿未见明显中枢神经不良反应。
综上,本研究治疗方案3岁及3岁以上MB患儿的疗效已达国际水平,年龄、组织病理学类型和CSF存在肿瘤细胞是影响患儿OS的独立危险因素,大细胞/间变型、CSF肿瘤细胞阳性和3型患儿的预后较差,复发率高,需予强化治疗;3岁以下患儿疗效欠佳,需进一步加强和规范其治疗方案。
所有作者均声明不存在利益冲突



























