
芳香族L-氨基酸脱羧酶缺乏症(AADCD)是一种早发性、具有靶向治疗的常染色体隐性遗传罕见疾病,早发现、早诊断、早治疗对改善预后极其重要。2017年国际神经递质相关疾病工作组(iNTD)制定了《芳香族L-氨基酸脱羧酶缺乏症的诊断和治疗共识指南》,给出了基于共识指南的推荐意见,便于指导该类患者的诊疗和长程管理。现主要根据该共识对AADCD的临床症状及治疗进行解读和总结,便于儿科临床医师认识和了解该病。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
芳香族L-氨基酸脱羧酶缺乏症(aromatic L-amino acid decarboxylase deficiency,AADCD)是一种罕见常染色体隐性遗传神经代谢性疾病[1],男女发病比例为4∶3,亚洲人好发[2],尤其是中国及日本。AADCD是一种早发性疾病,最早可在新生儿期出现临床症状,且AADCD是临床上少数有靶向治疗的遗传罕见病,早发现、早诊断并给予有效的治疗非常重要。国际神经递质相关疾病工作组(iNTD)于2017年在国际罕见病学术期刊在线发表了《芳香族L-氨基酸脱羧酶缺乏的诊断和治疗共识指南》,给出了基于共识指南的推荐意见,便于指导该类患者的诊疗和长程管理。现主要根据该共识对由于芳香族L-氨基酸脱羧酶(AADC)缺乏所导致的临床症状及治疗进行解读。
单胺类神经递质包括血清素和儿茶酚胺(多巴胺、肾上腺素和去甲肾上腺素),这些化合物具有多种功能,包括对神经运动功能的调节,心血管、呼吸和胃肠道功能的控制,对睡眠、激素分泌、体温和疼痛也有调节作用[2]。而AADC在单胺类神经递质的合成中起重要作用(图1),其是一种依赖吡哆醛磷酸盐的酶,能将左旋多巴转化为多巴胺、5-羟色胺转化为血清素。单胺类神经递质的分解代谢促使血清素生成5-羟基吲哚乙酸(5-HIAA),多巴胺生成高钒酸(HVA),去甲肾上腺素生成3-甲氧基-4-羟基苯乙炔乙二醇(MHPG)。
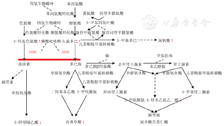

注:辅酶或辅基(BH4,PLP,Cu)和甲基供体(SAM)用虚线连接到各自的酶上;虚线箭头表示省略了中间步骤;芳香族L-氨基酸脱羧酶缺乏引起的代谢阻滞用红色条形图标识;红色箭头向上的代表代谢物增加,向下的代表代谢物减少 Coenzyme or coradical (BH4,PLP,Cu) and methyl donor (SAM) are connected to each enzyme with dotted lines.Dotted arrows do not show intermediate steps;metabolic block caused by aromatic L-amino acid decarboxylase deficiency is indicated by a red bar chart.The red arrow up represents an increase in metabolites,and the red arrow down represents a decrease
AADC活性降低导致单胺类神经递质的产生减少,并导致其前体5-羟色氨酸和左旋多巴的沉积,同时也导致了左旋多巴甲基化的产物3-甲基多巴的沉积。单胺类物质的分解代谢障碍导致5-HIAA的生成受到干扰,鉴于单胺类化合物在激素分泌功能中的作用,可导致内分泌功能障碍。
AADCD的临床表现由大脑和周围神经系统中单胺类神经递质缺乏所致。多巴胺水平降低导致运动障碍[3],去甲肾上腺素和肾上腺素缺乏导致自主交感神经功能障碍,而血清素缺乏则与睡眠障碍有关。然而,有些表现不能归因于特定的神经递质缺陷,如认知障碍和行为发育迟缓等。
AADCD主要是由于AADC缺乏引起血清素、多巴胺、去甲肾上腺素及肾上腺素等神经递质的代谢紊乱所致,临床上主要表现为肌张力低下、运动障碍(眼周危象、肌张力障碍、运动减退)、发育迟缓(运动发育、认知发育及语言发育迟缓)和自主神经症状(上睑下垂、出汗过多、鼻塞)[4](表1)。根据发育迟缓及运动障碍的严重程度,AADCD可以分为轻度、中度及重度[5]。
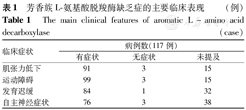
芳香族L-氨基酸脱羧酶缺乏症的主要临床表现 (例)
The main clinical features of aromatic L-amino acid decarboxylase (case)
芳香族L-氨基酸脱羧酶缺乏症的主要临床表现 (例)
The main clinical features of aromatic L-amino acid decarboxylase (case)
| 临床症状 | 病例数(117例) | ||
|---|---|---|---|
| 有症状 | 无症状 | 未提及 | |
| 肌张力低下 | 91 | 3 | 15 |
| 运动障碍 | 99 | 3 | 15 |
| 发育迟缓 | 84 | 1 | 32 |
| 自主神经症状 | 76 | 3 | 38 |
部分AADCD患者可以出现癫痫发作[1]、行为异常(主要表现为易怒、过度哭泣、烦躁不安[6]、自闭症特征[7])及睡眠障碍(失眠、嗜睡及严重的睡眠呼吸暂停)。
据研究报道,AADCD患者可以出现胃肠道症状,主要表现为腹泻、便秘、胃食管反流和进食困难。部分患者还可出现间歇性低血糖症状[8]。
AADCD是由于DDC基因纯合突变或复合杂合突变所致的一种罕见的常染色体隐性遗传的遗传代谢性疾病,DDC基因位于7p12.2-p12.1(OMIM 107930 #)。到目前为止,已报道50多种引起该病的DDC基因变异:39种替代变异、2种无义变异、5种缺失变异、1种插入变异和4种剪接变异[6]。但仍不能建立明确的基因型/临床表型相关性,其中发现以下几种变异体与临床表现有关:(1)剪切位点突变:基因组DNA测序显示,在第6外显子的30个外显子-内含子交界处发生了突变,导致患者及其母亲的供体剪接位点DDC基因发生剪接错误(IVS6+4A>T)。在这种预测程序中发现的内含子剪接位点突变,可能导致潜在的DDC基因发生异常剪接和蛋白产量下降或蛋白异常生产。(2)复合杂合突变:变异p.(IVS6+4A>T),变异p.(R285W),c.(853C>T)[9]。有证据表明,在2个具有不同L-Dopa结合位点变异的家族中,基因型与治疗反应存在相关性,如纯合子p.(G102S),c.(304G>A)的患者在使用左旋多巴治疗后肌张力低下和运动障碍得到改善[10];p.(R347Q):(R160W),c.(1040G>A);(478C>T)的患者对左旋多巴治疗的反应良好。
遗传学检测发现DDC基因突变是诊断AADCD的金标准。因此,在临床工作中发现肌张力低下、运动障碍、发育迟缓的患儿应尽早进行遗传学检测,以便早期诊断,并给予有效治疗,这对改善AADCD患儿的预后极其重要。
根据AADC在血清素和儿茶酚胺的生物合成和分解中的作用机制及基因表型可以通过以下实验室检查来协助诊断,即脑脊液检测[其中5-HIAA、高香草酸、苯乙醇水平降低[5,11],3-甲基多巴(3-OMD)、左旋多巴、5-羟基色氨酸水平升高具有诊断价值](图1)、血浆中AADC活性测定[12](血浆中AADC酶活性水平下降对AADCD有诊断价值)和杂合子遗传诊断或导致DDC变异的纯合子疾病基因的检测[6](绝大多数AADCD患者中可以通过基因确认)。
血液中儿茶酚胺代谢物的测定在常规临床实践中并不实用,因为其既不能用于诊断,也不能用于排除诊断,但其中3-OMD水平的测定可进一步用于新生儿筛查[13],做到早期诊断。尿中尿钒酸(VLA)水平升高,可以考虑诊断AADCD。但结果正常也不能完全排除诊断,因为肾脏内的AADC活性非常高,足以形成多巴胺及其代谢产物[13,14,15]。褪黑素是由血清素形成的,预计在AADCD中会减少。从理论上讲,这可以作为AADCD诊断的指标之一。
头颅磁共振成像(MRI)和脑电图均不作为AADCD患者常规检查手段,但是针对神经发育迟缓患者,以及在AADCD患者出现意外偏差时应考虑行头颅MRI检查;怀疑存在癫痫时也应考虑行脑电图检查[7]。
AADCD治疗总的原则是循序渐进,剂量先低后慢,停药/逐步停药。常采取多种药物治疗,选择性多巴胺受体激动剂、单胺氧化酶抑制剂为一线治疗药物,可加用抗胆碱能药物、褪黑素、苯二氮 类药物和肾上腺受体阻滞剂对症支持治疗。多学科团队的参与是AADCD患者治疗中必不可少的。
类药物和肾上腺受体阻滞剂对症支持治疗。多学科团队的参与是AADCD患者治疗中必不可少的。
根据AADCD的发病机制及病因,目前主要的一线治疗药物主要有维生素B6类吡哆醇、5-磷酸吡哆醛及多巴胺受体激动剂多巴丝肼、罗匹尼罗、罗替戈汀等,具体药物、使用方法及剂量见表2。
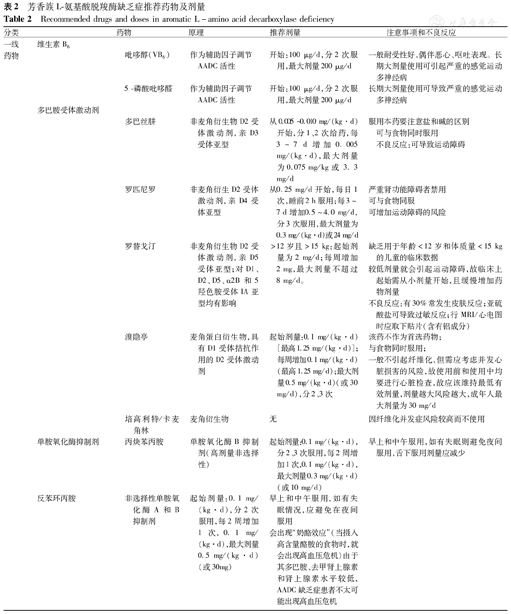
芳香族L-氨基酸脱羧酶缺乏症推荐药物及剂量
Recommended drugs and doses in aromatic L-amino acid decarboxylase deficiency
芳香族L-氨基酸脱羧酶缺乏症推荐药物及剂量
Recommended drugs and doses in aromatic L-amino acid decarboxylase deficiency
| 分类 | 药物 | 原理 | 推荐剂量 | 注意事项和不良反应 | ||
|---|---|---|---|---|---|---|
| 一线药物 | 维生素B6 | |||||
| 吡哆醇(VB6) | 作为辅助因子调节AADC活性 | 开始:100 μg/d,分2次服用,最大剂量200 μg/d | 一般耐受性好,偶伴恶心、呕吐表现。长期大剂量使用可引起严重的感觉运动多神经病 | |||
| 5 -磷酸吡哆醛 | 作为辅助因子调节AADC活性 | 开始:100 μg/d,分2次服用,最大剂量200 μg/d | 长期大剂量使用可导致严重的感觉运动多神经病 | |||
| 多巴胺受体激动剂 | ||||||
| 多巴丝肼 | 非麦角衍生物D2受体激动剂,亲D3受体亚型 | 从0.005 ~ 0.010 mg/(kg·d)开始,分1、2次给药,每3~7 d增加0.005 mg/(kg·d),最大剂量为0.075 mg/kg或3.3 mg/d | 服用本药要注意盐和碱的区别 | |||
| 可与食物同时服用 | ||||||
| 不良反应:可导致运动障碍 | ||||||
| 罗匹尼罗 | 非麦角衍生D2受体激动剂,亲D4受体亚型 | 从0.25 mg/d开始,每日1次,睡前2 h服用;每3~7 d增加0.5~4.0 mg/d,分3次服用,最大剂量为0.3 mg/(kg·d)或24 mg/d | 严重肾功能障碍者禁用 | |||
| 可与食物同服 | ||||||
| 可增加运动障碍的风险 | ||||||
| 罗替戈汀 | 非麦角衍生物D2受体激动剂,亲D5受体亚型;对D1、D2、D5、α2B和5羟色胺受体IA亚型均有影响 | >12岁且>15 kg:起始剂量为2 mg/d;每周增加2 mg,最大剂量不超过8 mg/d。 | 缺乏用于年龄<12岁和体质量<15 kg的儿童的临床数据 | |||
| 较低剂量就会引起运动障碍,故临床上起始需从小剂量开始,且缓慢增加药物剂量 | ||||||
| 不良反应:有30%常发生皮肤反应;亚硫酸盐可导致过敏反应;行MRI/心电图时应取下贴片(含有铝成分) | ||||||
| 溴隐亭 | 麦角蛋白衍生物,具有D1受体拮抗作用的D2受体激动剂 | 起始剂量:0.1 mg/(kg·d)[最高1.25 mg/(kg·d)];每周增加0.1 mg/(kg·d)(最高1.25 mg/d);最大剂量0.5 mg/(kg·d)(或30 mg/d),分2、3次 | 该药不作为首选药物; | |||
| 与食物同时服用; | ||||||
| 一般不引起纤维化,但需应考虑并发心脏损害的风险,故使用前和使用中均要进行心脏检查,故应该维持最低有效剂量,剂量越大风险越大,成年人最大剂量为30 mg/d | ||||||
| 培高利特/卡麦角林 | 麦角衍生物 | 无 | 因纤维化并发症风险较高而不使用 | |||
| 单胺氧化酶抑制剂 | 丙炔苯丙胺 | 单胺氧化酶B抑制剂(高剂量非选择性) | 起始剂量:0.1 mg/(kg·d),分2、3次服用,每2周增加1次,0.1 mg/(kg·d),最大剂量0.3 mg/(kg·d)(或10 mg/d) | 早上和中午服用,如有失眠则避免夜间服用,舌下服用剂量应减少 | ||
| 反苯环丙胺 | 非选择性单胺氧化酶A和B抑制剂 | 起始剂量:0.1 mg/(kg·d),分2次服用,每2周增加1次,0.1 mg/(kg·d),最大剂量0.5 mg/(kg·d)(或30mg) | 早上和中午服用,如有失眠情况,应避免在夜间服用 | |||
| 会出现"奶酪效应"(当摄入高含量酪胺的食物时,就会出现高血压危机)由于其多巴胺、去甲肾上腺素和肾上腺素水平较低,AADC缺乏症患者不太可能出现高血压危机 | ||||||
| 额外症状的治疗 | 抗胆碱能类(肌张力障碍/自主症状 | 苯海索 | 抗胆碱能药物 | <15 kg:起始剂量0.5~1.0 mg/d,一次口服,每3~7 d增加1次,1 mg/d,分2~4次服用 | 年龄越小对该药的耐受性越好,最大剂量可达15 mg/d | |
| 大剂量用药有镇静作用 | ||||||
| >15 kg:起始剂量2 mg/d,分2次服用,每3~7 d增加2 mg/d,分2~4次服用 | ||||||
| 有效剂量范围:6~60 mg | ||||||
| 最大剂量:<10 kg 30 mg/d;>10 kg 60 mg/d | ||||||
| 苯托品(抗胆碱碱能药) | 中枢作用的抗胆碱能药 | 起始剂量1 mg,分2次服用,每周增加4 mg/d | 抗胆碱能不良反应:口干,眼干,迷离视力(瞳孔扩大),尿潴留,便秘 | |||
| 大剂量有镇静作用 | ||||||
| 鼻塞 | 羟甲唑啉或羟咪唑啉滴鼻液 | 肾上腺素α受体激动剂导致局部血管收缩 | 药物使用剂量遵循年龄用药指南,慢性患者尽量从最低剂量开始使用 | 由于AADC缺乏症患者的多巴胺、去甲肾上腺素和肾上腺素水平较高,如果同时使用单胺酶抑制剂,则尽量包括不治疗的间歇周保留药物治疗间歇期,以预防高血压危象发生 | ||
| 睡眠问题 | 褪黑激素;N-乙酰-5-甲氧基色胺 | 调节睡眠和昼夜循环 | 起始剂量3 mg/d,在睡前4 h给药最大剂量5~8 mg/d | 早期治疗时可出现短暂夜惊的表现,存在种族差异 | ||
| 易怒、睡眠障碍 | 可乐定 | 中心作用的降压药,α2受体激动剂 | 起始剂量0.1 mg/d,睡前服用 | 用药期间需监测血压 | ||
| 最大剂量3 mg/d | 大剂量有镇静作用 | |||||
| 特殊情况 | 左旋多巴结合位点变异 | 不含卡比多巴的左旋多巴 | AADC形成多巴胺的底物,对某些结合位点变异有效 | 起始剂量0.5~1.0 mg/(kg·d),分3次服用,每周增加2次1 mg/kg至5 mg/(kg·d);只有在临床有效的情况下,方可进一步增加至最高15 mg/(kg·d) | 只有在已知结合位点变异的情况下,才从一线处理开始。否则,当临床情况稳定时,考虑为期2个月的三线治疗(病情恶化者则少于2个月)。治疗期间需监测脑脊液中5-MTHF的水平 | |
| 低5-MTHF脑脊液 | 叶酸,叶醛酸(钙) | 左旋多巴过量甲基化可引起甲基供体的耗竭 | 1~2 mg/(kg·d),最大剂量20 mg/d | 只有在脑脊液中5-MTHF含量较低时才使用左旋多巴治疗,治疗期间需监测脑脊液5-MTHF水平 | ||
注:AADC:芳香族L-氨基酸脱羧酶;5-MTHF:5-甲基四氢叶酸 AADC:aromatic L-amino acid decarboxylase;5-MTHF:5-Methyltetrahydrofolate
尽管目前还没有关于AADCD辅助医疗方面的相关报道,但多学科的方法包括物理治疗、语言治疗、职业治疗、喂养和营养评估等(神经)心理治疗和支持对促进发育和预防并发症的发生必不可少。
AADCD的基因治疗目前正在研究中。临床试验结果将决定未来是否会进一步实施这种有希望的治疗方法。
从病理生理学角度来看,由于组织胆碱能受体缺乏和自主神经功能紊乱导致AADCD患者出现心脏并发症,如心动过缓[16]、心脏骤停[12]等,所以应在有条件的医疗机构进行定期的心脏筛查(包括心电图和超声心动图)及临床评估。
严重运动损伤的AADCD患者会出现骨骼系统的并发症,少数患者会出现肌肉挛缩[10,17]。专家建议在当地有条件的医疗机构进行多学科的随访及治疗,包括臀部和脊柱的X线片检查及康复锻炼治疗。
由于AADCD患者存在进食、吞咽障碍、活动能力下降及反复住院治疗的情况,该类患者将会发生致命性的感染。鉴于AADCD患者免疫功能降低,专家建议在感染期间对患者进行严密监测,有条件的情况下也可接种疫苗。
AADCD患者应至少每年由有运动障碍或神经代谢疾病治疗经验的儿童神经科医师诊治,最好是有多学科的参与。可以通过测定羊水中的3-OMD、5-羟色氨酸和L-Dopa的含量来进行产前诊断,但最可靠的方法是对绒毛膜绒毛或羊水细胞进行遗传分析。专家建议AADCD患者都要有一张急诊卡,包括关于AADCD的简短信息、可能的并发症及避免这种疾病的药物。
所有作者均声明不存在利益冲突




























表2个别地方翻译错误,更正如下:
1.吡哆醇(VB6)、5-磷酸吡哆醛的推荐剂量单位“ug/d",更正为“mg/d”。
2.“多巴丝肼”更正为“普拉克索”,推荐剂量“分1、2次给药”更正为“分1~3次服用”。
3.罗匹尼罗的原理中“亲D4受体亚型”更正为“亲D3受体亚型”。
4.溴隐亭的推荐剂量中,“起始剂量最高1.25 mg/ (kg·d)”更正为“1.25 mg/d”。
5.“丙炔苯丙胺”更正为“司来吉兰”。
6.“反苯环丙胺”行表格对位有误,整体向右移一列。
7.苯托品的推荐剂量中“每周增加4 mg/d"更正为“每周逐渐加量至4 mg/d"。