
总结儿童颅外恶性生殖细胞瘤(MGCT)的临床特征、治疗效果及预后相关因素,以提高对本病的认识。
回顾性分析2008年1月至2018年12月在首都医科大学附属北京儿童医院血液肿瘤中心诊断并治疗的MGCT患儿的临床资料及治疗效果,分析影响其预后的危险因素。
共收集35例患儿,其中女19例,男16例;中位发病年龄71个月,3岁以内起病占42.4%(14/33例),6岁以上起病占39.3%(13/33例)。原发瘤灶位于性腺9例(卵巢6例,睾丸3例),性腺外26例(盆腹腔8例,纵隔8例,骶尾部10例);Ⅱ期5例,Ⅲ期16例,Ⅳ期14例;中危11例,高危24例。随访时间(25.43±4.82)个月,患儿均予手术联合化疗的规范化治疗,2年总体生存(OS)率及无事件生存(EFS)率分别为87.4%及67.1%。Ⅱ期和Ⅲ期患儿的2年OS率及EFS率(分别为93.8%和80.4%)均显著高于Ⅳ期患儿(分别为66.7%和45.1%),差异均有统计学意义(χ2=0.649、0.739,P=0.021、0.037);病初即伴远处转移的患儿其2年EFS率为43.8%,无转移组患儿为86.9%,2组间差异有统计学意义(χ2=0.694,P=0.028)。病初完整切除瘤灶的中危及高危患儿完全缓解(CR)率分别为100.0%(8/8例)和71.4%(5/7例);穿刺确诊后辅以化疗2~4个疗程后完全切除瘤灶者,持续CR率为72.7%(8/11例);40.0%不全切除的患儿出现肿瘤进展(2/5例)。发生事件的8例患儿病初甲胎蛋白(AFP)均下降缓慢,且在进展时均伴AFP明显升高。
儿童MGCT多于3岁前或6岁后起病,经过规范化的手术联合化疗,总体预后较好;手术切除不完整、治疗过程中AFP下降缓慢是预后不良的因素,肿瘤进展患儿可通过增加化疗疗程、二次手术、自体干细胞移植等手段提高疗效、改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
儿童颅外恶性生殖细胞瘤(MGCT)是指发生在颅外,来源于胚胎性腺的原始生殖细胞具有不同组织学特征的一组肿瘤,主要位于生殖腺(睾丸和卵巢)及中线附近的生殖腺外组织(骶尾部、纵隔、腹膜后等),是一种较为罕见的儿童肿瘤[1]。在15岁以下的儿童中,其发病率仅占儿童肿瘤的3.5%,但在15~19岁的青少年阶段,其发病率则升至13.9%[2],本病发病率有2个明显的高峰,包括幼儿期(0~4岁)及从青春期开始到成年期(11~35岁)[3]。本病治疗方法主要以铂类药物为主的化疗方案联合手术,可获得75%以上的5年生存率[4]。本研究通过回顾性分析近10年单中心诊治的颅外MGCT患儿的临床资料,总结其临床特点、诊治经验及预后,并探讨最佳治疗策略。
收集2008年1月至2018年12月于首都医科大学附属北京儿童医院血液肿瘤中心诊断及治疗的颅外MGCT患儿共35例。组织学诊断参照世界卫生组织(WHO)(2015)生殖细胞肿瘤标准进行分类,并依据美国儿童肿瘤协作组(COG)的术后分期及危险度分组标准进行分期分组[5]。本研究通过医院医学伦理委员会批准(批准文号:2017-k-54),患儿监护人均签署知情同意书。
在第1次手术或活检病理诊断后,高危组患儿予C-PEB(环磷酰胺,C;顺铂,P;依托泊苷,E;博莱霉素,B)方案化疗4个疗程[6],中危组患儿予PEB(顺铂,P;依托泊苷,E;博莱霉素,B)或EP(依托泊苷,E;顺铂,P)/IE(异环磷酰胺,I;依托泊苷,E)方案交替化疗4个疗程,每疗程间隔21 d,完成4个疗程后进行评估,对于肿瘤完全切除者可随访,有残留的患儿可行第2次手术;第2次术后肿瘤完全切除者可随访,有残留病灶者可再行2个疗程化疗,之后再次评估肿瘤情况,必要时可行第3次手术。1例患儿予自体干细胞移植,根据COG-2003方案,予环磷酰胺联合马法兰进行预处理,回输患儿自体造血干细胞CD34阳性细胞1.73×106/kg,回输第11天植入成功。
化疗过程中每2个疗程后进行原发瘤灶评估,4个疗程及治疗结束后进行全身疗效评估。根据国际儿童实体瘤的疗效标准,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)4个等级[7]。生存期为确诊之日起至随访截止时间,或任何原因所致死亡的时间。无事件生存(EFS)时间为确诊之日起至事件发生的时间。该事件是指患儿疾病进展、复发及死亡。本组患儿随访至2019年2月28日。
采用SPSS 20.0软件进行统计学分析。计数资料用率(%)表示,两样本率的比较采用χ2检验或Fisher′s确切概率法。采用Kaplan-Meier法计算2年总生存(OS)率和EFS率。P<0.05为差异有统计学意义。
共35例患儿。其中女19例(54.3%),男16例(45.7%);起病年龄1~197个月,中位发病年龄71个月,3岁以内起病占42.4%(14/33例),6岁以上起病占39.3(13/33例)。临床表现主要以局部占位及压迫症状为主,包括发现局部包块12例、疼痛9例、肢体无力8例、尿便困难7例等。病理类型:混合型生殖细胞瘤14例、卵黄囊瘤11例及未成熟畸胎瘤10例,分别占40.0%、31.4%和28.6%;原发瘤灶位于性腺9例(卵巢6例,睾丸3例),占25.7%,性腺外26例(盆腹腔8例,纵隔8例,骶尾部10例),占74.3%;14例(40.0%)患儿在病初即伴远处转移,其中肺转移9例,远处淋巴结5例,肝3例,骨骼2例;Ⅱ期5例,Ⅲ期16例,Ⅳ期14例;中危11例,高危24例。35例患儿病初甲胎蛋白(AFP)均高于正常(正常值0~0.09 mg/L),其中15例AFP>10 mg/L;3例患儿病初人绒毛膜促性腺激素(HCG)高于正常(正常值0~5.3 IU/L),21例HCG正常,10例未检测HCG。
2例患儿因经济及家庭因素于化疗1个疗程后失访,余33例患儿均规范化治疗及随诊,随访时间4.0~125.5个月[(25.43±4.82)个月]。33例规律治疗的患儿中,23例高危患儿采用C-PEB方案化疗;中危患儿10例,6例采用PEB方案,4例采用EP/IE交替方案化疗。按手术时机分类,20例患儿病初接受肿瘤全切;13例患儿穿刺确诊后,首先予规律化疗,2~4个疗程后接受手术切除;2例患儿病初由于手术或穿刺困难,临床诊断后首先给予化疗2~4个疗程,瘤灶回缩适合手术后再行手术切除。33例患儿中,除1例患儿合并巨大瘤灶,治疗1个疗程后仍有PD,余32例均在化疗2~4个疗程后达到PR或CR,近期疗效明显。有8例患儿出现事件,包括2例死亡,死亡原因分别为多脏器衰竭及合并急性非淋巴细胞白血病(AML)中枢系统受累;3例原发瘤灶进展;1例局部淋巴结进展,1例停药后出现远处转移;1例治疗0.5年合并AML,目前治疗中。此外,1例患儿在经过正规化疗及二次手术,原发瘤灶骶尾部残留病灶仍有进展,遂予自体干细胞移植,目前随访10年持续缓解状态。本组患儿2年OS率为87.4%, EFS率为67.1%,结果见图1。


注:OS:总生存;EFS无事件生存
OS:overall survival;EFS:event free survival
病初完整切除瘤灶的中危组CR为100.0%,而高危组持续CR也可达71.4%,2例患儿因病初手术困难,先予2个疗程化疗后手术完整切除,继续辅以规律化疗,CR率也可达到100.0%;病初仅予穿刺明确诊断的患儿,随后辅以化疗,2~4个疗程后完全切除瘤灶者,持续CR也可达到73.0%;对于瘤灶巨大、解剖条件复杂等因素造成完全切除困难的患儿,即便给予不完全切除及规律化疗,仍有40.0%的患儿出现了PD;需要经过增加化疗疗程、二次手术及自体干细胞移植等手段以控制病情,除1例死亡、1例治疗6个月合并AML外,其余患儿瘤灶均控制。结果见表1。
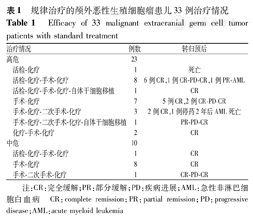
规律治疗的颅外恶性生殖细胞瘤患儿33例治疗情况
Efficacy of 33 malignant extracranial germ cell tumor patients with standard treatment
规律治疗的颅外恶性生殖细胞瘤患儿33例治疗情况
Efficacy of 33 malignant extracranial germ cell tumor patients with standard treatment
| 治疗情况 | 例数 | 转归预后 | |
|---|---|---|---|
| 高危 | 23 | ||
| 活检-化疗 | 1 | 死亡 | |
| 活检-化疗-手术-化疗 | 8 | 6例CR,1例CR-PD-CR,1例PR-AML | |
| 活检-化疗-手术-化疗-自体干细胞移植 | 1 | CR | |
| 手术-化疗 | 7 | 5例CR,2例CR-PD-CR | |
| 手术-化疗-二次手术-化疗 | 3 | 2例CR,1例停药2年后AML死亡 | |
| 手术-化疗-二次手术-化疗-自体干细胞移植 | 1 | PR-PD-CR | |
| 化疗-手术-化疗 | 2 | CR | |
| 中危 | 10 | ||
| 活检-化疗-手术-化疗 | 1 | CR | |
| 手术-化疗 | 8 | CR | |
| 手术-二次手术-化疗 | 1 | CR-PD-CR | |
注:CR:完全缓解;PR:部分缓解;PD:疾病进展;AML:急性非淋巴细胞白血病
CR:complete remission;PR:partial remission;PD:progressive disease;AML:acute myeloid leukemia
单因素分析结果显示:Ⅱ期和Ⅲ期患儿的2年OS率及EFS率均显著高于Ⅳ期患儿,差异有统计学意义(P<0.05);病初即伴远处转移的患儿其2年OS率及EFS率均低于无转移组,但仅EFS率的差异有统计学意义(P<0.05);不同原发瘤灶部位、病理学分型、临床分组和病初不同AFP值患儿2年OS率及EFS率比较,差异均无统计学意义(均P>0.05)。结果见表2。
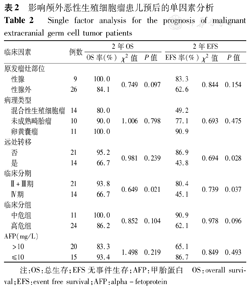
影响颅外恶性生殖细胞瘤患儿预后的单因素分析
Single factor analysis for the prognosis of malignant extracranial germ cell tumor patients
影响颅外恶性生殖细胞瘤患儿预后的单因素分析
Single factor analysis for the prognosis of malignant extracranial germ cell tumor patients
| 临床因素 | 例数 | 2年OS | 2年EFS | |||||
|---|---|---|---|---|---|---|---|---|
| OS率(%) | χ2值 | P值 | EFS率(%) | χ2值 | P值 | |||
| 原发瘤灶部位 | ||||||||
| 性腺 | 9 | 100.0 | 0.749 | 0.097 | 83.3 | 0.844 | 0.154 | |
| 性腺外 | 26 | 84.1 | 62.6 | |||||
| 病理类型 | ||||||||
| 混合性生殖细胞瘤 | 14 | 80.0 | 1.006 | 0.798 | 49.2 | 0.693 | 0.475 | |
| 未成熟畸胎瘤 | 10 | 90.0 | 77.1 | |||||
| 卵黄囊瘤 | 11 | 100.0 | 90.9 | |||||
| 远处转移 | ||||||||
| 否 | 21 | 95.2 | 0.981 | 0.239 | 86.9 | 0.694 | 0.028 | |
| 是 | 14 | 66.7 | 43.8 | |||||
| 临床分期 | ||||||||
| Ⅱ+Ⅲ期 | 21 | 93.8 | 0.649 | 0.021 | 80.4 | 0.739 | 0.037 | |
| Ⅳ期 | 14 | 66.7 | 45.1 | |||||
| 临床分组 | ||||||||
| 中危组 | 11 | 100.0 | 0.852 | 0.104 | 90.9 | 0.978 | 0.096 | |
| 高危组 | 24 | 86.2 | 62.1 | |||||
| AFP(mg/L) | ||||||||
| >10 | 20 | 83.3 | 1.498 | 0.219 | 65.1 | 0.849 | 0.493 | |
| ≤10 | 15 | 93.4 | 86.7 | |||||
注:OS:总生存;EFS无事件生存;AFP:甲胎蛋白
OS:overall survi-val;EFS:event free survival;AFP:alpha-fetoprotein
儿童MGCT的发病率较低,病初AFP越高表达提示肿瘤中存在恶性成分越多,对于肿瘤的恶性程度及肿瘤是否进展有重要意义[8],本组35例患儿在病初均有AFP升高,随着治疗,大部分患儿AFP迅速下降,并在术后逐渐下降至正常,而对于下降不满意的患儿,高度提示PD或切除不完全有残留病灶可能。本组发生事件的8例患儿病初AFP均下降缓慢,且在PD时均伴AFP明显升高,提示在本病中密切监测AFP水平有重要意义。
本病的主要治疗原则为手术、化疗相结合的综合治疗,研究表明手术完整切除是重要预后因素[9]。对于复发难治的MGCT,应在规范化治疗基础上,多次手术以尽量完整切除瘤灶,并予高剂量化疗联合自体干细胞移植改善预后[1,10]。本研究结果显示,病初完整切除瘤灶的中危组患儿CR为100.0%,而高危组持续CR也可达到71.4%,而对于瘤灶巨大、解剖条件复杂等因素造成完全切除困难的患儿,即便给予不完全切除及规律化疗,仍有40.0%的患儿出现了PD;需要经过增加化疗疗程、二次手术及自体干细胞移植等手段以控制病情。国外文献报道,在一线治疗基础上(化疗联合手术),疾病仍未能满意控制,自体干细胞移植是合理的选择,并提倡将干细胞移植作为复发进展的生殖细胞瘤的二线治疗[11],并且国内有研究显示儿童恶性实体瘤干细胞采集和回输是安全可靠的,无远期脏器损害[12]。在欧洲一项对于成人复发进展生殖细胞瘤的研究中,60例经规律治疗仍有复发进展的患者,经大剂量化疗联合干细胞移植后,33%获得CR,26%获得PR,10%获得SD[13]。目前关于干细胞移植治疗复发进展的生殖细胞瘤均为成人的相关报告,在儿童中尚无大宗研究报道,本组患儿中,1例在规律的化疗联合手术基础仍有PD,予自体干细胞移植,目前长期随访处于缓解状态。
本组患儿原发病灶在性腺和性腺外MGCT的2年OS率分别为100.0%和84.1%,2年EFS率分别为83.3%和62.6%,差异无统计学意义,这与李璋琳等[14]的报道结论一致,说明本病的原发部位对预后无明显相关性。但有国外文献报道,儿童原发于纵隔的MGCT的5年EFS率为66.7%,明显低于非纵隔原发瘤灶患儿组(90.9%)[15],而本组8例发生事件患儿中,原发瘤灶位于纵隔者3例,提示纵隔可能是影响患儿预后的因素之一。
本组8例患儿出现事件,通过分析发现,延迟化疗、手术切除不完整是患儿出现PD的重要原因,其次,巨大瘤灶、治疗过程中AFP下降缓慢,都提示预后不良。此外,有2例患儿分别在停药2年和治疗6个月时诊断为AML,具体机制尚不明确,2例患儿均为青春期男童,发病年龄分别为12岁及16岁,原发肿瘤均位于纵隔,病初即伴远处转移,均为Ⅳ期高危组,提示对于MGCT患儿,尤其是青春期患儿,应密切监测血液学相关指标,如外周血细胞数、骨髓穿刺结果等,以尽早发现、诊断及治疗。
综上,MGCT是一种相对罕见的儿童恶性肿瘤,多于2岁前或6岁后起病,主要可以发生于身体纵轴,如纵隔、腹腔、骶尾部及性腺等处,诊断需要依靠病理检查,经过规范化的手术联合化疗,总体预后较好。本病手术完整切除是影响预后的重要因素,若存在残余病灶,高度提示预后不良。此外,治疗过程中AFP下降缓慢也是预后不良的因素,对于青春期患儿应注意监测血液学指标。出现进展的患儿可采取二次手术、增加化疗疗程、自体干细胞移植等手段,以提高疗效、改善预后。
所有作者均声明不存在利益冲突



























