
探讨儿童原发性IgA肾病(IgAN)临床表现和病理改变与免疫荧光之间的相关性。
收集近10年江西省儿童医院肾脏科确诊为原发性IgA肾病222例患儿资料,分析其临床和病理特点及相关性。
1.免疫荧光显示IgA仅伴系膜区沉积的患儿最多[115例(51.8%)],其余为同时伴毛细血管袢沉积[107例(48.2%)];IgA免疫荧光强度++的患儿最多[122例(55.0%)];IgA伴IgM沉积患儿最多[168例(75.7%)],其次为伴C3沉积[160例(72.1%)];伴C4沉积最少[7例(3.2%)]。2.高血压与免疫荧光伴IgM、C3沉积、IgA沉积强度及IgA伴血管袢沉积均呈正相关(均P<0.05);高尿酸血症与伴IgM、IgG、C3沉积及IgA伴血管袢沉积均呈正相关(均P<0.05);低蛋白血症与伴IgM、C3沉积、IgA沉积强度及IgA伴血管袢沉积均呈负相关(均P<0.05);高胆固醇血症与伴C3沉积及IgA伴血管袢沉积均呈正相关(均P<0.05);尿蛋白定量与伴IgM、IgG及IgA伴血管袢沉积均呈正相关(均P<0.05);估算肾小球滤过率(eGFR)与IgA伴血管袢沉积呈负相关(P<0.05)。3.Lee氏分级与免疫荧光伴IgM及C3沉积、IgA沉积强度及IgA伴毛细血管袢沉积呈正相关(均P<0.05)。4.牛津分型中系膜细胞增生(M1)与免疫荧光伴C3沉积、IgA沉积强度均呈正相关(均P<0.001);毛细血管内皮增生(E1)病变与IgA沉积强度及IgA伴毛细血管袢沉积均呈正相关(均P<0.05);节段肾小球硬化或黏连(S1)病变与免疫荧光病理无相关性;肾小管萎缩/间质纤维化(T1)与伴IgG及C3沉积均呈正相关(均P<0.05)。5.球性硬化与免疫荧光病理无相关性;新月体与免疫荧光伴IgM、IgG、C3沉积、IgA沉积强度及IgA毛细血管袢沉积均呈正相关(均P<0.05);肾内动脉增厚与伴IgG沉积及IgA毛细血管袢沉积均呈正相关性(均P<0.05)。
儿童原发性IgAN免疫荧光IgA强度以++为主,伴IgM沉积最多见;IgA伴毛细血管袢沉积或伴C3沉积的临床表现及光镜病理更重。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
IgA肾病(IgAN)是世界上公认最常见导致终末期肾病(ESRD)的肾小球性疾病之一[1],发病机制主要为循环中铰链区O-聚糖的半乳糖缺陷的IgA1增加和抗O-聚糖自身抗体升高所致[2]。既往认为IgAN属良性病变,近年文献报道,有20%~30%的儿童IgAN在20~25年内可进展为ESRD[3]。IgAN临床表现及肾脏病理多样,从单纯镜下血尿至严重的肾炎型肾病综合征,有通过免疫抑制治疗逆转的活动性病理改变或对免疫抑制无反应的慢性病变,且病理与临床不完全一致[4]。目前鲜有关于儿童IgAN免疫荧光病理与光镜病理的相关性研究,系统研究二者之间的关系,有利于疾病的综合防治。本研究基于近10年本中心原发性IgAN患儿的资料,回顾性分析其临床病理特点,探讨IgAN临床和光镜与免疫荧光病理表现的相关性,以期为IgAN发病机制的阐明、预后判断及指导治疗提供更多依据。
回顾性收集2008年1月至2018年10月于江西省儿童医院肾脏科肾穿刺活检确诊为原发性IgAN的222例患儿资料。除外符合以下任何1条的患儿:(1)继发性IgAN,如继发于过敏性紫癜等;(2)合并其他肾脏疾病,如膜增生性肾小球肾炎等;(3)合并影响IgAN自身病理表现;(4)系统性红斑狼疮等将影响后续治疗的系统性疾病;(5)各种遗传性肾炎;(6)肾活检过程中取材不够充分;(7)临床资料不完整。肾活检时年龄为(9.1±3.0)岁(3~14岁),其中男161例(72.5%),女61例(27.5%),男女比例为2.64∶1.00;肾活检前中位数病程为3.6个月(1.2~48.0个月),其中164例(73.9%)患儿在肾活检前有肉眼血尿发作史。临床表现:纳入本研究的IgAN患儿中,88例(39.6%)为肾病综合征,77例(34.7%)为血尿、蛋白尿混合型,48例(21.6%)为单纯血尿,8例(3.6%)为急性肾炎,1例(0.5%)表现为单纯蛋白尿。44例(19.82%)患儿伴高血压;肾活检时24 h尿蛋白定量为(1.45+1.63) g/d,中位值为1.23 g/d;血肌酐水平为(55.09±29.27) μmol/L,估算肾小球滤过率(eGFR)为(155.19± 34.15) mL/(min·1.73m2);低白蛋白血症37例(占16.7%),伴高胆固醇血症61例(占27.5%)及高尿酸血症患儿44例(占19.9%)。本研究通过医院医学伦理委员会批准(批准文号:JXSETYY-YXKY-2019098),患儿监护人均知情同意。
主要包括年龄、性别、体质量指数、肾脏病家族史、病程、起病诱因、血尿、24 h尿蛋白定量、血清肌酐(Scr)、eGFR、慢性肾脏病(CKD)分期、血红蛋白(Hb)、血尿酸(UA)、血清清蛋白(Alb)、总胆固醇(TC)、三酰甘油(TG)、血清lgA、lgG、lgM、补体C3、C4。高血压:参考文献《儿童高血压的临床表现及判断标准》[5]。蛋白尿分层:按照24 h尿蛋白定量水平分为正常、轻度、中度、重度[6]。高胆固醇血症:血总胆固醇>5.7 mmol/L。高尿酸血症:1~12个月血尿酸>500 μmol/L,1~10岁>320 μmol/L;11~15岁(男)>470 μmol/L,11~15岁(女)>350 μmol/L;15岁以上采用成人标准(血尿酸>420 μmol/L)[7]。计算eGFR[8]。
调取所纳入患儿IgAN全部病理信息,由2名肾科医师在不知道患儿临床资料的情况下,严格按照SM Kurt Lee病理分类及牛津分型标准,分别对所纳入患儿重新进行Lee氏分级和牛津分型病理诊断,对诊断有分歧的病例重新观察光镜标本后统一病理诊断。详细记录IgA、IgM、IgG、C3及C4沉积部位和强度及新月体和肾内动脉病变的种类、程度和范围;有无肾小球全球硬化及比例。
应用SPSS 21.0软件进行分析。计量资料采用 ±s表示,计数资料采用百分比表示。相关分析采用Spearman相关分析,采用Kappa一致性检验。P<0.05为差异有统计学意义。
±s表示,计数资料采用百分比表示。相关分析采用Spearman相关分析,采用Kappa一致性检验。P<0.05为差异有统计学意义。
222例IgAN患儿中,Lee氏Ⅲ级最多;Lee氏Ⅱ级次之;Lee氏Ⅴ级最少。牛津病理分型以M0E1S0T0多见,其次为M0E0S0T0、M1E0S0T0及M1E1S0T0;48.2%的患儿表现新月体病变,仅13例患儿新月体病变小球占肾小球总数比≥25%;25.7%患儿表现球性硬化病变,仅4例患儿球性硬化的肾小球总数比≥25%;30.2%的患儿表现肾内动脉增厚病变,结果见表1。

Lee氏分级、牛津分型及其他病理特点分布情况
Distribution of Lee′s classification,Oxford typing and other pathological features
Lee氏分级、牛津分型及其他病理特点分布情况
Distribution of Lee′s classification,Oxford typing and other pathological features
| 病理特点 | 例(%) | |
|---|---|---|
| Lee氏分级 | ||
| Ⅰ级 | 43(19.4) | |
| Ⅱ级 | 45(20.3) | |
| Ⅲ级 | 109(49.1) | |
| Ⅳ级 | 23(10.4) | |
| Ⅴ级 | 2(0.9) | |
| 牛津分型 | ||
| M0 | 163(73.4) | |
| M1 | 59(26.6) | |
| E0 | 90(40.5) | |
| E1 | 132(59.5) | |
| S0 | 155(69.8) | |
| S1 | 67(30.2) | |
| T0 | 201(90.5) | |
| T1 | 21(9.5) | |
| 新月体 | ||
| 新月体总数 | 107(48.2) | |
| 细胞新月体 | 33(30.8) | |
| 细胞纤维新月体 | 73(68.2) | |
| 纤维新月体 | 1(1.0) | |
| 新月体病变小球占肾小球总数比<5% | 21(19.6) | |
| 新月体病变小球占肾小球总数比5%~<10% | 33(30.8) | |
| 新月体病变小球占肾小球总数比10%~<25% | 40(37.4) | |
| 新月体病变小球占肾小球总数比≥25% | 13(12.2) | |
| 球性硬化 | ||
| 球性硬化 | 57(25.7) | |
| 球性硬化占肾小球比例<5% | 11(19.3) | |
| 球性硬化占肾小球比例5%~<10% | 31(54.3) | |
| 球性硬化占肾小球比例10%~<25% | 11(19.3) | |
| 球性硬化占肾小球比例≥25% | 4(7.1) | |
| 肾内动脉增厚 | 67(30.2) | |
注:M0:系膜细胞增生积分≤0.5;M1:系膜细胞增生积分>0.5;E0:毛细血管内皮增生(无);E1:毛细血管内皮增生(有);S0:节段肾小球硬化或黏连(无);S1:节段肾小球硬化或黏连(有);T0:肾小管萎缩/间质纤维化(无);T1:肾小管萎缩/间质纤维化(有) M0: mesangial hypercellu-larity score ≤ 0.5;M1:mesangial hypercellularity score > 0.5;E0:endocapillary hypercellularity (no);E1:endocapillary hypercellularity (yes);S0:segmental glomerulosclerosis (no);S1:segmental glomerulosclerosis (yes);T0:tubular atrophy and interstitial fibrosis (no);T1:tubular atrophy and interstitial fibrosis (yes)
免疫荧光显示,IgA仅在系膜区沉积的患儿115例,其余患儿IgA同时伴毛细血管袢沉积。89例患儿伴IgG沉积,其中51.7%在系膜区沉积;168例伴IgM沉积,其中49.1%在系膜区沉积;160例伴C3沉积,其中48.8%在系膜区沉积;7例伴C4在系膜区沉积。单纯IgA沉积者32例,同时伴其他免疫球蛋白沉积以IgA+IgG+IgM+C3沉积最多,有68例;其次为IgA+IgM+C3者65例,4例表现为"满堂亮"。荧光强度分析显示,IgA ++最多;在所有伴IgG沉积患儿中,IgG +患儿最多;在所有伴IgM沉积患儿中,IgM +患儿最多;在所有伴C3沉积患儿中,C3+最多见,见表2。

免疫荧光沉积情况
Immunofluorescence deposition
免疫荧光沉积情况
Immunofluorescence deposition
| 病理特点 | 例(%) | |
|---|---|---|
| IgA仅在系膜区沉积 | 115(51.8) | |
| IgA同时伴毛细血管袢沉积 | 107(48.2) | |
| 伴IgG沉积 | 89(40.1) | |
| IgG仅系膜区沉积 | 46(51.7) | |
| 伴IgM沉积 | 168(75.7) | |
| IgM仅系膜区沉积 | 83(49.1) | |
| 伴C3沉积 | 160(72.1) | |
| C3仅系膜区沉积 | 78(48.8) | |
| 伴C4沉积 | 7(3.2) | |
| 单纯IgA沉积 | 32(14.4) | |
| IgA+IgM沉积 | 24(10.8) | |
| IgA+C3沉积 | 11(5.0) | |
| IgA+IgM+IgG沉积 | 5(2.3) | |
| IgA+IgG+C3沉积 | 10(4.5) | |
| IgA+IgM+C3沉积 | 65(29.3) | |
| IgA+IgG+IgM+C3沉积 | 68(30.6) | |
| IgA+IgG+C3+C4沉积 | 1(0.5) | |
| IgA+IgM+C3+C4沉积 | 1(0.5) | |
| IgA+IgG+IgM+C4沉积 | 1(0.5) | |
| IgA+IgG+IgM+C3+C4沉积 | 4(1.8) | |
| 免疫荧光强度 | ||
| IgA + | 26(11.7) | |
| IgA ++ | 122(55.0) | |
| IgA +++ | 73(32.9) | |
| IgA ++++ | 1(0.4) | |
| IgG + | 74(83.2) | |
| IgG ++ | 10(11.2) | |
| IgG ± | 5(5.6) | |
| IgM + | 150(89.3) | |
| IgM ++ | 14(8.3) | |
| IgM ± | 4(2.4) | |
| C3 + | 119(74.4) | |
| C3 ++ | 38(23.8) | |
| C3 ± | 3(1.9) | |
| C4 + | 6(85.7) | |
| C4 ± | 1(14.3) | |
高血压与伴IgM、C3沉积、IgA沉积强度及IgA伴血管袢沉积均呈正相关(均P<0.05);高尿酸血症与伴IgM、IgG、C3沉积及IgA伴血管袢沉积均呈正相关(均P<0.05);低蛋白血症与伴IgM、C3沉积、IgA沉积强度及IgA伴血管袢沉积均呈负相关(均P<0.05);高胆固醇血症与伴C3沉积及IgA伴血管袢沉积均呈正相关(均P<0.05);尿蛋白定量与伴IgM、IgG及IgA伴血管袢沉积均呈正相关(均P<0.05); eGFR与IgA伴血管袢沉积呈负相关(P<0.05);年龄与免疫荧光病理无相关性,见表3。
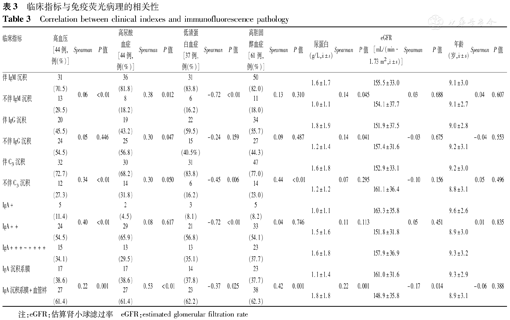
临床指标与免疫荧光病理的相关性
Correlation between clinical indexes and immunofluorescence pathology
临床指标与免疫荧光病理的相关性
Correlation between clinical indexes and immunofluorescence pathology
| 临床指标 | 高血压[44例,例(%)] | Spearman | P值 | 高尿酸血症[44例,例(%)] | Spearman | P值 | 低清蛋白血症[37例,例(%)] | Spearman | P值 | 高胆固醇血症[61例,例(%)] | Spearman | P值 | 尿蛋白(g/L, ±s) ±s) | Spearman | P值 | eGFR[mL/(min·1.73 m2, ±s)] ±s)] | Spearman | P值 | 年龄(岁, ±s) ±s) | Spearman | P值 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 伴IgM沉积 | 31(70.5) | 0.06 | <0.01 | 36(81.8) | 0.38 | 0.012 | 31(83.8) | -0.72 | <0.01 | 50(82.0) | 0.13 | 0.310 | 1.6±1.7 | 0.14 | 0.045 | 155.5±33.0 | 0.03 | 0.688 | 9.1±3.0 | 0.04 | 0.607 |
| 不伴IgM沉积 | 13(29.5) | 8(18.2) | 6(16.2) | 11 (18.0) | 1.0±1.1 | 154.1±37.7 | 9.1±2.7 | ||||||||||||||
| 伴IgG沉积 | 20(45.5) | 0.05 | 0.446 | 19(43.2) | 0.30 | 0.047 | 22(59.5) | -0.24 | 0.159 | 34(55.7) | 0.09 | 0.487 | 1.8±1.9 | 0.14 | 0.041 | 151.9±37.5 | -0.03 | 0.675 | 9.0±2.8 | -0.04 | 0.553 |
| 不伴IgG沉积 | 24(54.5) | 25(56.8) | 15(40.5%) | 27 (44.3) | 1.2±1.4 | 157.4±31.6 | 9.2±3.1 | ||||||||||||||
| 伴C3沉积 | 32(72.7) | 0.34 | <0.01 | 30(68.2) | 0.30 | 0.050 | 31(83.8) | -0.45 | 0.006 | 47(77.0) | 0.44 | <0.01 | 1.6±1.8 | 0.07 | 0.295 | 152.9±33.1 | -0.10 | 0.156 | 9.2±3.0 | 0.05 | 0.496 |
| 不伴C3沉积 | 12(27.3) | 14(31.8) | 6(16.2) | 14 (23.0) | 1.2±1.2 | 161.1±36.4 | 8.8±3.1 | ||||||||||||||
| IgA+ | 5(11.4) | 0.40 | <0.01 | 2(4.5) | 0.08 | 0.617 | 3(8.1) | -0.72 | <0.01 | 5(8.2) | 0.04 | 0.746 | 1.0±1.1 | 0.11 | 0.113 | 163.3±35.8 | 0.05 | 0.451 | 9.6±2.6 | 0.01 | 0.835 |
| IgA++ | 24(54.5) | 29(65.9) | 21(56.8) | 33 (54.1) | 1.5±1.6 | 151.8±31.8 | 8.9±3.0 | ||||||||||||||
| IgA+++~++++ | 15(34.1) | 13(29.5) | 13(35.1) | 23(37.7) | 1.6±1.8 | 157.9±36.9 | 9.3±3.2 | ||||||||||||||
| IgA沉积系膜 | 17(38.6) | 0.22 | 0.001 | 17(38.6) | 0.53 | <0.01 | 14(37.8) | -0.37 | 0.025 | 23(37.7) | 0.42 | 0.001 | 1.1±1.4 | 0.22 | 0.001 | 161.0±31.6 | -0.17 | 0.014 | 9.3±2.9 | -0.06 | 0.388 |
| IgA沉积系膜+血管袢 | 27(61.4) | 27(61.4) | 23(62.2) | 38(62.3) | 1.8±1.8 | 148.9±35.8 | 8.9±3.1 |
注:eGFR:估算肾小球滤过率 eGFR:estimated glomerular filtration rate
Lee氏分级与伴IgM及C3沉积、IgA沉积强度及IgA伴毛细血管袢沉积均呈正相关(均P<0.05);是否伴IgG与Lee氏分级无相关性,见表4。
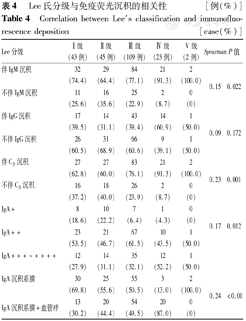
Lee氏分级与免疫荧光沉积的相关性[例(%)]
Correlation between Lee′s classification and immunofluorescence deposition [case(%)]
Lee氏分级与免疫荧光沉积的相关性[例(%)]
Correlation between Lee′s classification and immunofluorescence deposition [case(%)]
| Lee分级 | Ⅰ级(43例) | Ⅱ级(45例) | Ⅲ级(109例) | Ⅳ级(23例) | V级(2例) | Spearman | P值 |
|---|---|---|---|---|---|---|---|
| 伴IgM沉积 | 32(74.4) | 29(64.4) | 84(77.1) | 21(91.3) | 2(100.0) | 0.15 | 0.022 |
| 不伴IgM沉积 | 11(25.6) | 16(35.6) | 25(22.9) | 2(8.7) | 0(0) | ||
| 伴IgG沉积 | 17(39.5) | 14(31.1) | 43(39.4) | 14(60.9) | 1(50.0) | 0.09 | 0.172 |
| 不伴IgG沉积 | 26(60.5) | 31(68.9) | 66(60.6) | 9(39.1) | 1(50.0) | ||
| 伴C3沉积 | 27(62.8) | 27(60.0) | 83(76.1) | 21(91.3) | 2(100.0) | 0.23 | 0.001 |
| 不伴C3沉积 | 16(37.2) | 18(40.0) | 26(23.9) | 2(8.7) | 0(0) | ||
| IgA+ | 8(18.6) | 10(22.2) | 7(6.4) | 1(4.3) | 0(0) | 0.17 | 0.012 |
| IgA++ | 23(53.5) | 21(46.7) | 67(61.5) | 10(43.5) | 1(50.0) | ||
| IgA+++~++++ | 12(27.9) | 14(31.1) | 35(32.1) | 12(52.2) | 1(50.0) | ||
| IgA沉积系膜 | 30(69.8) | 25(55.6) | 55(50.5) | 3(13.0) | 2(100.0) | 0.24 | <0.01 |
| IgA沉积系膜+血管袢 | 13(30.2) | 20(44.4) | 54(49.5) | 20(87.0) | 0(0) |
牛津分型M1与伴C3沉积、IgA沉积强度均呈正相关(均P<0.001); E1与IgA沉积强度及IgA伴毛细血管袢沉积均呈正相关(均P<0.05); S1与免疫荧光病理无相关性;T1与伴IgG及C3沉积均呈正相关(均P<0.05),见表5。
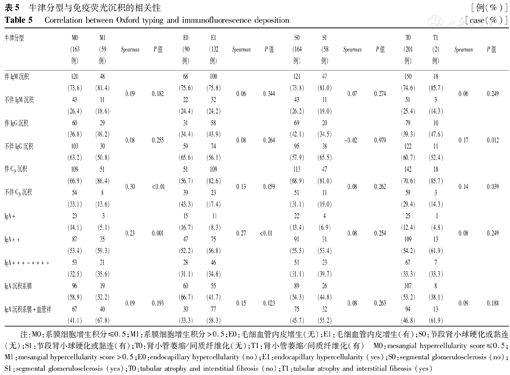
牛津分型与免疫荧光沉积的相关性[例(%)]
Correlation between Oxford typing and immunofluorescence deposition [case(%)]
牛津分型与免疫荧光沉积的相关性[例(%)]
Correlation between Oxford typing and immunofluorescence deposition [case(%)]
| 牛津分型 | M0(163例) | M1(59例) | Spearman | P值 | E0(90例) | E1(132例) | Spearman | P值 | S0(164例) | S1(58例) | Spearman | P值 | T0(201例) | T1(21例) | Spearman | P值 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 伴IgM沉积 | 120(73.6) | 48(81.4) | 0.09 | 0.182 | 68(75.6) | 100(75.8) | 0.06 | 0.344 | 121 (73.8) | 47(81.0) | 0.07 | 0.274 | 150(74.6) | 18(85.7) | 0.06 | 0.249 |
| 不伴IgM沉积 | 43(26.4) | 11(18.6) | 22(24.4) | 32(24.2) | 43(26.2) | 11(19.0) | 51(25.4) | 3(14.3) | ||||||||
| 伴IgG沉积 | 60(36.8) | 29(49.2) | 0.08 | 0.255 | 31(34.4) | 58(43.9) | 0.08 | 0.264 | 69 (42.1) | 20(34.5) | -0.02 | 0.979 | 79(39.3) | 10(47.6) | 0.17 | 0.012 |
| 不伴IgG沉积 | 103(63.2) | 30(50.8) | 59(65.6) | 74(56.1) | 95(57.9) | 38(65.5) | 122(60.7) | 11(52.4) | ||||||||
| 伴C3沉积 | 109(66.9) | 51(86.4) | 0.30 | <0.01 | 51(56.7) | 109(82.6) | 0.13 | 0.059 | 113(68.9) | 47(81.0) | 0.08 | 0.262 | 142 (70.6) | 18(85.7) | 0.14 | 0.039 |
| 不伴C3沉积 | 54(33.1) | 8(13.6) | 39(43.3) | 23(17.4) | 51(31.1) | 11(19.0) | 59(29.4) | 3(14.3) | ||||||||
| IgA+ | 23(14.1) | 3(5.1) | 0.23 | 0.001 | 15(16.7) | 11(8.3) | 0.27 | <0.01 | 22(13.4) | 4(6.9) | 0.08 | 0.254 | 25(12.4) | 1(4.8) | 0.08 | 0.249 |
| IgA++ | 87(53.4) | 35(59.3) | 47(52.2) | 75(56.8) | 91(55.5) | 31(53.4) | 109(54.2) | 13(61.9) | ||||||||
| IgA+++~++++ | 53(32.5) | 21(35.6) | 28(31.1) | 46(34.8) | 51(31.1) | 23(39.7) | 67(33.3) | 7(33.3) | ||||||||
| IgA沉积系膜 | 96(58.9) | 19(32.2) | 0.09 | 0.193 | 60(66.7) | 55(41.7) | 0.15 | 0.023 | 89 (54.3) | 26(44.8) | 0.08 | 0.263 | 107(53.2) | 8(38.1) | 0.09 | 0.188 |
| IgA沉积系膜+血管袢 | 67(41.1) | 40(67.8) | 30(33.3) | 77(58.3) | 75(45.7) | 32(55.2) | 94(46.8) | 13(61.9) |
注:M0:系膜细胞增生积分≤0.5;M1:系膜细胞增生积分>0.5;E0:毛细血管内皮增生(无);E1:毛细血管内皮增生(有);S0:节段肾小球硬化或黏连(无);S1:节段肾小球硬化或黏连(有);T0:肾小管萎缩/间质纤维化(无);T1:肾小管萎缩/间质纤维化(有) M0:mesangial hypercellularity score≤0.5;M1:mesangial hypercellularity score>0.5;E0:endocapillary hypercellularity (no);E1:endocapillary hypercellularity (yes);S0:segmental glomerulosclerosis (no);S1:segmental glomerulosclerosis (yes);T0:tubular atrophy and interstitial fibrosis (no);T1:tubular atrophy and interstitial fibrosis (yes)
球性硬化与免疫荧光无相关性(P>0.05);新月体与伴IgM、IgG、C3沉积、IgA沉积强度及IgA毛细血管袢沉积均呈正相关(均P<0.05);肾内动脉增厚与伴IgG沉积及IgA毛细血管袢沉积均呈正相关性(均P<0.05),见表6。
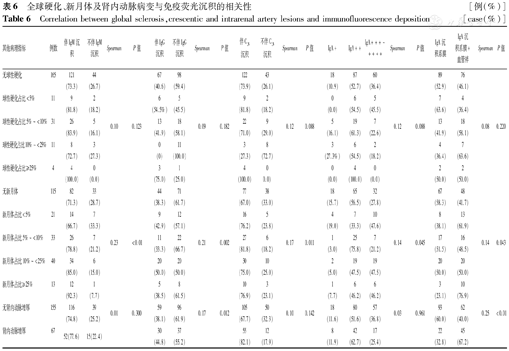
全球硬化、新月体及肾内动脉病变与免疫荧光沉积的相关性[例(%)]
Correlation between global sclerosis,crescentic and intrarenal artery lesions and immunofluorescence deposition[case(%)]
全球硬化、新月体及肾内动脉病变与免疫荧光沉积的相关性[例(%)]
Correlation between global sclerosis,crescentic and intrarenal artery lesions and immunofluorescence deposition[case(%)]
| 其他病理指标 | 例数 | 伴IgM沉积 | 不伴IgM沉积 | Spearman | P值 | 伴IgG沉积 | 不伴IgG沉积 | Spearman | P值 | 伴C3沉积 | 不伴C3沉积 | Spearman | P值 | IgA+ | IgA++ | IgA+++~++++ | Spearman | P值 | IgA沉积系膜 | IgA沉积系膜+血管袢 | Spearman | P值 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 无球性硬化 | 165 | 121(73.3) | 44(26.7) | 0.10 | 0.123 | 67(40.6) | 98(59.4) | 0.09 | 0.182 | 122(73.9) | 43(26.1) | 0.12 | 0.088 | 18(10.9) | 87(52.7) | 60(36.4) | 0.12 | 0.088 | 89(52.9) | 76(46.1) | 0.08 | 0.220 |
| 球性硬化占比<5% | 11 | 9(81.8) | 2(18.2) | 6(54.5%) | 5(45.5) | 9(81.8) | 2(18.2) | 0(0.0) | 6(54.5) | 5(45.5) | 7(63.6) | 4(36.4) | ||||||||||
| 球性硬化占比5%~<10% | 31 | 26(83.9) | 5(16.1) | 13(41.9) | 18(58.1) | 22(71.0) | 9(29.0) | 5(16.1) | 19(61.3) | 7(22.6) | 13(41.9) | 18(58.1) | ||||||||||
| 球性硬化占比10%~<25% | 11 | 8(72.7) | 3(27.3) | 0(0) | 11(100.0) | 3(27.3) | 8(72.7) | 3(27.3%) | 6(54.5) | 2(18.2) | 4(36.4) | 7(63.6) | ||||||||||
| 球性硬化占比≥25% | 4 | 4(100.0) | 0(0.0) | 3(75.0) | 1(25.0) | 4(100.0) | 0 0.0) | 0(0.0) | 4(100.0) | 0(0.0) | 2(50.0) | 2(50.0) | ||||||||||
| 无新月体 | 115 | 82(71.3) | 33(28.7) | 0.23 | <0.01 | 44(38.3) | 71(61.7) | 0.21 | 0.002 | 77(67.0) | 38(33.0) | 0.17 | 0.011 | 18(15.7) | 65(56.5) | 32(27.8) | 0.14 | 0.045 | 67(58.3) | 48(41.7) | 0.14 | 0.043 |
| 新月体占比<5% | 21 | 14(66.7) | 7(33.3) | 9(42.9) | 12(57.1) | 16(76.2) | 5(23.8) | 4(19.0) | 7(33.3) | 10(47.6) | 8(38.1) | 13(61.9) | ||||||||||
| 新月体占比5%~<10% | 33 | 26(78.8) | 7(21.2) | 11(33.3) | 22(66.7) | 27(81.8) | 6(18.2) | 1(3.0) | 25(75.8) | 7(21.2) | 17(51.5) | 16(48.5) | ||||||||||
| 新月体占比10%~<25% | 40 | 34(85.0) | 6(15.0) | 20(50.0) | 20(50.0) | 30(75.0) | 10(25.0) | 2(5.0) | 19(47.5) | 19(47.5) | 20(50.0) | 20(50.0) | ||||||||||
| 新月体占比≥25% | 13 | 12(92.3) | 1(7.7) | 5(38.5) | 8(61.5) | 10(76.9) | 3(23.1) | 1(7.7) | 6(46.2) | 6(46.2) | 3(23.1) | 10(76.9) | ||||||||||
| 无肾内动脉增厚 | 155 | 116(74.8) | 39(25.2) | 0.01 | 0.300 | 59(38.1) | 96(61.9) | 0.17 | 0.012 | 105(67.7) | 50(32.3) | 0.10 | 0.142 | 18(11.6) | 80(51.6) | 57(36.8) | 0.03 | 0.961 | 93(60.0) | 62(40.0) | 0.25 | <0.01 |
| 肾内动脉增厚 | 67 | 52(77.6) | 15(22.4) | 30(44.8) | 37(55.2) | 55(82.1) | 12(17.9) | 8(11.9) | 42(62.7) | 17(25.4) | 22(32.8) | 45(67.2) |
原发性IgAN作为一种免疫性疾病,异常糖基化的IgA与IgG和抗IgA的抗体结合形成大分子复合物并沉积于肾脏,持续或间断多次IgA刺激导致肾损伤的发生。IgAN临床及病理表现多样且不完全一致,但又存在一定联系,目前鲜有关于儿童IgAN免疫荧光病理与光镜病理的相关性研究。本横断面研究基于近10年本中心原发性儿童IgAN临床资料进行分析,免疫荧光病理主要关注IgA免疫荧光强度、IgA是否伴毛细血管袢沉积及是否伴IgM、IgG、C3共沉积,临床指标及病理分型与免疫荧光的相关性。
IgAN诊断依据是以IgA或IgA为主的免疫球蛋白在肾小球系膜区沉积,可同时伴其他免疫球蛋白沉积,但荧光强度低于或至少不强于IgA。本研究显示,IgA沉积强度以++为主(占55.0%),其次为IgA+++(占32.9%),IgA++++仅占0.4%,而文献报道IgA在系膜区沉积强度以+++为主[9]。本研究显示40.1%的患儿同时伴IgG沉积,提示肾脏IgG沉积可能与IgAN发病相关;IgG抗体可与肾小球系膜区异常的O糖基化多聚IgA1分子结合形成循环或原位免疫复合物,沉积于肾脏介导IgAN发生发展[10];在所有伴IgG沉积病例中,IgG免疫荧光强度+最多(占83.1%),IgG免疫荧光强度±及++各占5.6%及11.2%。C3在补体系统中发挥中心作用,其充分激活将导致膜攻击复合物的形成[11],结果显示73.9%的患儿伴补体在肾脏沉积,其中以C3沉积最多见,提示补体活化可能与IgAN发病及疾病进展相关。文献报道IgAN伴C3沉积是不良预后的指标,补体旁路途径和凝集素活化途径在IgAN病情进展中发挥重要作用[12];因此,IgAN伴或不伴补体沉积是否为2种疾病类型及在诊疗方面是否存在差异,有待于进一步研究。本研究发现,儿童IgAN较少出现单纯IgA沉积,多数伴IgM沉积(占72.5%),4例患儿表现为"满堂亮"现象。本研究显示,48.20%的患儿同时伴IgA毛细血管袢沉积,7例患儿伴C4沉积。
研究表明,IgAN免疫病理分型中,单纯IgA沉积者临床表现相对轻,而伴IgG和/或IgM沉积者临床表现则较重[13,14]。目前研究认为,IgAN伴IgG沉积与疾病进展、肾脏预后差有关[15,16]。同时本研究发现,大部分患儿血清IgA、IgG、IgM、C3及C4水平处于正常值范围内,因此血清免疫球蛋白对IgAN的特异性诊断意义较小。
有关IgAN预后的临床指标已达成共识,包括蛋白尿水平、高血压和肾功能异常[17]。临床期望从肾脏病理中获取更多与评估诊治方案及预后的关键信息,因此出现了很多IgAN病理分型方法。由于IgAN病理分型标准混乱,目前国际上关于病理分型标准尚未达成共识,大致可分为3类:即描述性分类、分级分类及半定量评分方法。目前临床以分级分类应用较为广泛,主要有WHO分类法、Lee氏分类法和Hass氏分类法等。各分类法中各有优缺点及偏重点,致其临床应用不同程度受到限制,国内较多采用Lee氏分类法[18]。2004年由全球多位肾脏病临床专家以及肾脏病理学家组成的国际IgAN协作组提出了对IgAN临床病理分型的倡议,并于2009年发表IgAN的牛津病理分型[19],其对判断预后具有较强临床价值。自IgAN牛津分型正式发布后,IgAN预后的独立预测价值得到有效验证和充分肯定[20,21,22],本研究纳入了这一最新分型标准。从患者病历来看,目前很多需要进行透析治疗的IgAN患者,其发病期可追溯至儿童期,而IgAN牛津分型是否能独立预测儿童IgAN的预后,是否与临床指标,特别是免疫荧光之间存在相关性,还需要进一步验证。本研究显示222例IgAN患儿中牛津分型常见的病理类型为M0E1S0T0,其次是M0E0S0T0、M1E0S0T0及M1E1S0T0,M1占26.6%,E1占59.5%,S1占30.2%,T1占9.5%,未见T2病变。本研究在牛津分型基础上,同时将新月体(48.2%)、球性硬化(25.7%)及肾内动脉增厚(30.2%)纳入资料分析,说明IgAN病理表现的多样性,即便表现为轻度系膜增生或轻微病变的基础上亦可伴有其他多种预后不良的病理类型,临床医师需从纷杂的病理指标中挖掘有效信息来评估治疗方案及预后。
关于临床指标与免疫荧光的相关性,本研究发现,高血压与伴IgM、C3沉积、IgA沉积强度及IgA伴血管袢沉积呈正相关;高尿酸血症与伴IgM、IgG、C3沉积及IgA伴血管袢沉积呈正相关;低蛋白血症与伴IgM、C3沉积、IgA沉积强度及IgA伴血管袢沉积呈负相关;高胆固醇血症与伴C3沉积、及IgA伴血管袢沉积呈正相关;尿蛋白定量与伴IgM、IgG及IgA伴血管袢沉积呈正相关;eGFR与IgA伴血管袢沉积呈负相关;年龄与免疫荧光病理无相关性。文献报道,伴IgM沉积的IgAN患者尿蛋白定量明显升高,但Scr及eGFR无差异[13];伴IgG沉积时Scr、尿蛋白定量、血尿酸明显高于单纯IgA沉积组[15];随肾组织C3沉积加重,Scr、尿酸及血IgA水平升高,eGFR降低[23],本研究结果与之基本一致。故应重视IgAN系膜区或毛细血管袢其他免疫球蛋白的沉积,特别IgG和C3在系膜区表达特征。而有研究认为IgA免疫荧光强度与IgAN患者临床表现不相关[24]。
本研究发现,伴IgM及C3沉积、IgA沉积强度增加及IgA伴毛细血管袢沉积与Lee氏分级呈正相关。目前关于IgA免疫荧光强度与牛津病理分型相关性研究甚少。本研究结果显示,伴C3沉积、IgA沉积强度增加的患儿牛津分型M1病变加重;IgA沉积强度增加及IgA伴毛细血管袢沉积与E1病变呈正相关;免疫荧光病理与S1病变无相关性;伴IgG及C3沉积与T1病变呈正相关;与文献报道的IgA伴毛细血管袢沉积与毛细血管内皮细胞增生和系膜细胞增生活跃有关[25]一致,且提示伴C3沉积的患儿肾脏慢性病变更重。本研究发现,免疫荧光与球性硬化无相关性,这与文献[16]报道一致,结果同时显示新月体与伴IgM、IgG、C3沉积、IgA沉积强度及IgA毛细血管袢沉积呈正相关;肾内动脉增厚与伴IgG沉积及IgA毛细血管袢沉积呈正相关性,与伴IgM、C3及IgA沉积强度无相关性,而既往研究认为,IgA伴毛细血管袢沉积与新月体及肾脏慢性损害病变加重有关,预后差[26],但亦有研究不支持IgA在毛细血管袢的沉积是肾脏预后不良的独立危险因素[23]。本研究结果提示,积极有效控制IgAN患儿的血压、尿酸、胆固醇及蛋白尿可减少免疫球蛋白特别C3的沉积及IgA在毛细血管袢的沉积,从而改善系膜及内皮细胞的增生、肾间质及新月体病变,可能有助于这部分IgAN患儿的预后。
综上所述,儿童原发性IgAN免疫荧光IgA强度以++,且伴IgM沉积最多见;IgA伴毛细血管袢沉积或伴C3沉积的临床表现及光镜病理更重。通过对IgAN患儿临床及病理改变与免疫荧光相关性分析,可加强对该类肾脏病临床与病理表现多样性的理解,同时为探讨IgAN发病机制开辟了一条新的思路。
所有作者均声明不存在利益冲突



























