
研究褪黑素(MEL)对缺氧缺血性脑损伤(HIBD)新生大鼠海马区细胞焦亡的影响及机制。
参照改良Rice法建立HIBD动物模型。采用随机数字表法将105只7日龄新生SD大鼠分为7组(每组15只):假手术组、模型(HIBD)组、MEL处理(5、10和20 mg/kg)组、磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)通路抑制剂处理(LY294002)组和MEL+ LY294002组。采用HE染色和尼氏染色分别观察海马病理形态学及尼氏体改变,采用实时荧光定量PCR检测各组大鼠左侧海马组织中Nod样受体家族3(NLRP3)、凋亡相关斑点样蛋白(ASC)、含半胱氨酸的天冬氨酸蛋白水解酶-1(Caspase-1)、消皮素D(GSDMD)、白细胞介素-1β(IL-1β)、白细胞介素-18(IL-18)的mRNA表达水平,采用Western blot检测上述指标的蛋白表达水平及Akt的磷酸化(p-Akt)水平。
与假手术组比较,HIBD组海马CA1区细胞层数减少,排列不规则,尼氏体减少,NLRP3(1.98±0.08比0.86±0.13)、ASC(1.40±0.12比0.81±0.07)、Caspase-1(1.46±0.10比0.75±0.09)、GSDMD(1.35±0.10比0.81±0.10)、IL-18(1.23±0.08比0.23±0.04)、IL-1β(1.83±0.09比0.57±0.08)的mRNA表达水平及p-Akt(1.12±0.12比0.54±0.07)表达水平升高,差异均有统计学意义(均P<0.05)。与HIBD组比较,MEL组(10 mg/kg)海马CA1区细胞层数相对增加,细胞排列较规则,尼氏体增多,NLRP3(1.04±0.10)、ASC(0.91±0.06)、Caspase-1(0.63±0.06)、GSDMD(1.01±0.09)、IL-18(0.65±0.05)、IL-1β(0.63±0.10)的mRNA表达水平降低,差异均具有统计学意义(均P<0.05)。与MEL(10 mg/kg)组比较,MEL+LY294002组海马CA1区细胞细胞排列相对紊乱,尼氏体减少,p-Akt蛋白(0.87±0.09比1.99±0.27)表达明显降低,Caspase-1蛋白表达水平(0.85±0.09比0.58±0.09)增加,差异均有统计学意义(均P<0.05)。
MEL可能通过激活Akt信号通路抑制HIBD新生大鼠海马区神经元焦亡,从而发挥脑保护作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
缺氧缺血性脑损伤(HIBD)由围生期新生儿缺氧和窒息等多种因素引起,常导致脑性瘫痪、癫痫、精神发育迟滞等永久性神经系统后遗症,是新生儿中枢神经系统损伤的常见原因[1,2]。神经元死亡是HIBD后遗症难以恢复的主要原因,而神经炎症与HIBD继发性神经元死亡密切相关。细胞质炎症小体复合物激活被认为是神经炎症的必要步骤,也是神经元焦亡的一个重要触发因素[3]。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路参与调节细胞炎症,其在脑缺血后海马CA1区神经元死亡中起关键作用[4]。近年来,褪黑素(melatonin,MEL)因具有良好的抗炎、抗氧化性能及较好的安全性,越来越受到广大临床研究者的关注。本研究建立HIBD新生大鼠模型,探讨MEL对HIBD海马区细胞焦亡的影响及其与Akt信号通路的关系,旨在为MEL应用于临床防治HIBD提供理论基础。
7日龄新生SD大鼠购于成都达硕实验动物公司,共105只,体质量(15±2) g,雌雄不限,动物合格证号:SCXK(川)2015-030。饲养条件:12 h光暗循环,温度18~22 ℃,湿度为45%~65%,母乳喂养,自由取食。按照随机数字表法将105只SD大鼠分为7组:假手术组、模型(HIBD)组及MEL处理(5、10和20 mg/kg)组、Akt抑制剂处理(LY294002)组和MEL+ LY294002组,排除造模不成功及死亡的大鼠,每组15只。依据改良Rice法[5,6]制备新生HIBD大鼠模型,双重结扎左侧颈总动脉并从中间剪断血管,缝合皮肤,休息0.5 h后于氧体积分数为80 mL/L的透明缺氧舱内缺氧2.5 h。假手术组仅分离左侧颈总动脉,不结扎,也不行缺氧处理。药物处理组于造模成功后立即分别腹腔注射MEL(5、10、20 mg/kg)、LY294002(0.3 mg/kg)和MEL(10 mg/kg)+ LY294002(0.3 mg/kg),连续给药3 d。
Nod样受体家族3(NLRP3)、凋亡相关斑点样蛋白(ASC)、含半胱氨酸的天冬氨酸蛋白水解酶-1(Caspase-1)、消皮素D(GSDMD)、白细胞介素(IL)-1β、IL-18、GAPDH的引物由四川生工科技有限公司设计、合成及生产。NLRP3、ASC、Caspase-1、IL-18、IL-1β、Akt抗体、MEL、LY294002购自上海优宁维生物科技股份有限公司。
术后3 d处死大鼠,经40 g/L多聚甲醛固定后,将海马在内的部分脑组织进行梯度乙醇脱水,二甲苯透明,石蜡包埋,切片备用。用二甲苯脱蜡、梯度乙醇至水后行HE染色和尼氏染色。光镜下观察海马病理形态学及尼氏体改变。
提取海马组织总蛋白,测量蛋白质浓度。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离60 ng组织蛋白,转移至聚偏二氟乙烯膜(美国Sigma公司)。用50 g/L脱脂牛奶封闭2 h,将膜与针对NLRP3(1∶1 000)、ASC(1∶500)、Caspase-1(1∶300)、GSDMD(1∶500),IL-1β(1∶500),IL-18(1∶300)、Akt(1∶500)、p-Akt(1∶500)、GAPDH(1∶2 000)的一抗在4 ℃冰箱孵育过夜,洗膜后二抗室温孵育2 h,漂洗后用电化学发光液显影。用Image Lab 3.0软件(美国BIO-RAD公司)定量印迹强度。
采用qPCR检测NLRP3、ASC、Caspase-1、GSDMD、IL-18和IL-1β的mRNA表达。提取左侧海马组织总RNA。使用1 μg总RNA合成cDNA。10 μL的反应体系:5 μL的SYBR Green SuperMix、3 μL的无酶水、0.5 μL的上下游引物和1 μL的扩增的cDNA。使用CFX96 Real-Time PCR System(BioRad Laboratories,California,USA)进行反应。收集循环阈值并归一化至GAPDH水平。引物序列见表1。

基因引物序列
Gene primer sequence
基因引物序列
Gene primer sequence
| 基因 | 引物序列 |
|---|---|
| NLRP3 | 上游:5′-GAGCTGGACCTCAGTGACAATGC-3′ |
| 下游:5′-ACCAATGCGAGATCCTGACAACAC-3′ | |
| ASC | 上游:5′-GGACCAACACAGGCAAGCACTC-3′ |
| 下游:5′-ACAAGTTCTTGCAGGTCAGGTTCC-3′ | |
| Caspase-1 | 上游:5′-ATGGCCGACAAGGTCCTGAGG-3′ |
| 下游:5′-GACATGATCGCACAGGTCTCGTG-3′ | |
| GSDMD | 上游:5′-GTCTGCTTGCCGTACTCCATTCC-3′ |
| 下游:5′-TGAAGAGCCTGCCTCCACCTC-3′ | |
| IL-1β | 上游:5′-AATCTGTACCTGTCCTGCGTGTTG-3′ |
| 下游:5′-GAGAGGTGCTGATGTACCAGTTGG-3′ | |
| IL-18 | 上游:5′-ATGGCTGCCATGTCAGAAGAAGG-3′ |
| 下游:5′-TGCTCCGTATTACTGCGGTTGTAC-3′ | |
| GAPDH | 上游:5′-ATGACATCAAGAAGGTGGTG-3′ |
| 下游:5′-CATACCAGGAAATGAGCTTG-3′ |
注:NLRP3:NOD样受体家族3;ASC:凋亡相关斑点样蛋白;Caspase-1:含半胱氨酸的天冬氨酸蛋白水解酶-1;GSDMD:消皮素D;IL-1β:白细胞介素-1β;IL-18:白细胞介素-18 NLRP3:Nod-like receptor family 3;ASC:apoptosis-associated speck-like protein containing a card;GSDMD:gasdermin D;IL-1β:interleukin-1β;IL-18:interleukin-18
应用GraphPad Prism 7.0软件进行统计学分析。计量资料经正态及方差齐性检验后,数据用 ±s表示,组间比较采用单因素方差分析,组间两两比较采用Student′s t检验。P<0.05为差异有统计学意义。
±s表示,组间比较采用单因素方差分析,组间两两比较采用Student′s t检验。P<0.05为差异有统计学意义。
HE染色示,假手术组大鼠海马CA1区细胞层数多,排列规则、整齐,细胞轮廓及形态正常,核仁清晰,无偏移现象;HIBD组细胞层数明显减少,细胞排列疏松、散乱,细胞轮廓及形态发生改变,核仁偏移、碎裂、不清晰,膜染色不均匀;而MEL组细胞层数相对减少,排列相对不规则,细胞有丢失现象,但较HIBD组有明显改善,且细胞形态较为正常,核仁较为清晰,尤其是10 mg/kg组和20 mg/kg组(图1)。尼氏染色示,HIBD组尼氏体明显减少,而MEL组尼氏体相对增加(图1)。
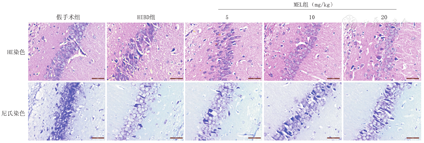

注:HIBD:缺氧缺血性脑损伤;MEL:褪黑素 HIBD:hypoxic-ischemic brain damage;MEL:melatonin
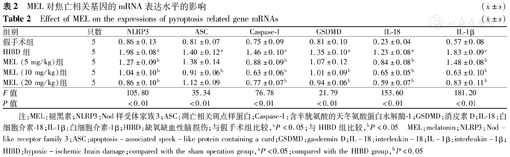
与假手术组比较,HIBD组NLRP3、Caspase-1、GSDMD、IL-18和IL-1β的mRNA水平均升高,差异均有统计学意义(均P<0.05);与HIBD组比较,MEI(10 mg/kg)组和MEL(20 mg/kg)组NLRP3、GSDMD、Caspase-1、IL-18和IL-1β的mRNA水平下降明显,ASC的mRNA水平仅在MEL(10 mg/kg)组下降明显,差异均有统计学意义(均P<0.05)。结果见表2。
MEL对焦亡相关基因的mRNA表达水平的影响 ( ±s)
±s)
Effect of MEL on the expressions of pyroptosis related gene mRNAs ( ±s)
±s)
MEL对焦亡相关基因的mRNA表达水平的影响 ( ±s)
±s)
Effect of MEL on the expressions of pyroptosis related gene mRNAs ( ±s)
±s)
| 组别 | 只数 | NLRP3 | ASC | Caspase-1 | GSDMD | IL-18 | IL-1β |
|---|---|---|---|---|---|---|---|
| 假手术组 | 5 | 0.86±0.13 | 0.81±0.07 | 0.75±0.09 | 0.81±0.10 | 0.23±0.04 | 0.57±0.08 |
| HIBD组 | 5 | 1.98±0.08a | 1.40±0.12a | 1.46±0.10a | 1.35±0.10a | 1.23±0.08a | 1.83±0.09a |
| MEL (5 mg/kg)组 | 5 | 1.27±0.09b | 1.38±0.14 | 0.88±0.09b | 1.07±0.12 | 0.84±0.08b | 1.48±0.08b |
| MEL (10 mg/kg)组 | 5 | 1.04±0.10b | 0.91±0.06b | 0.63±0.06b | 1.01±0.09b | 0.65±0.05b | 0.63±0.10b |
| MEL (20 mg/kg)组 | 5 | 0.86±0.10b | 1.12±0.09 | 0.77±0.07b | 0.94±0.06b | 0.59±0.07b | 0.83±0.11b |
| F值 | 105.80 | 35.34 | 76.78 | 21.79 | 153.60 | 181.20 | |
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 |
注:MEL:褪黑素;NLRP3:Nod样受体家族3;ASC:凋亡相关斑点样蛋白;Caspase-1:含半胱氨酸的天冬氨酸蛋白水解酶-1;GSDMD:消皮素D;IL-18:白细胞介素-18;IL-1β:白细胞介素-1β;HIBD:缺氧缺血性脑损伤;与假手术组比较,aP<0.05;与HIBD组比较,bP<0.05 MEL:melatonin;NLRP3:Nod-like receptor family 3;ASC:apoptosis-associated speck-like protein containing a card;GSDMD:gasdermin D;IL-18:interleukin-18;IL-1β:interleukin-1β;HIBD:hypoxic-ischemic brain damage;compared with the sham operation group,aP<0.05;compared with the HIBD group,bP<0.05
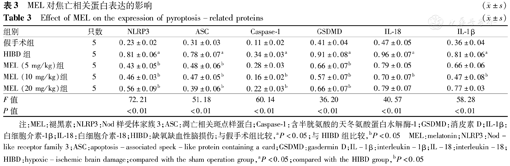
NLRP3、ASC、GSDMD、Caspase-1、IL-18和IL-1β的蛋白表达水平在各组存在差异。Caspase-1蛋白表达水平在HIBD组升高,在MEL组的表达较HIBD组降低,其余蛋白亦有相同趋势,差异均有统计学意义(均P<0.05)。结果见表3,图2。
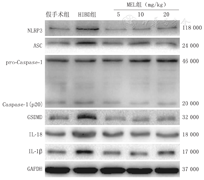

注:NLRP3:Nod样受体家族3;ASC:凋亡相关斑点样蛋白;Caspase-1:含半胱氨酸的天冬氨酸蛋白水解酶-1;GSDMD:消皮素D;IL-18:白细胞介素-18;IL-1β:白细胞介素-1β;HIBD:缺氧缺血性脑损伤;MEL:褪黑素 NLRP3:Nod-like receptor family 3;ASC:apoptosis-associated speck-like protein containing a card;GSDMD:gasdermin D;IL-18:interleukin-18;IL-1β:interleukin-1β;HIBD:hypoxic-ischemic brain damage;MEL:melatonin
MEL对焦亡相关蛋白表达的影响 ( ±s)
±s)
Effect of MEL on the expression of pyroptosis-related proteins ( ±s)
±s)
MEL对焦亡相关蛋白表达的影响 ( ±s)
±s)
Effect of MEL on the expression of pyroptosis-related proteins ( ±s)
±s)
| 组别 | 只数 | NLRP3 | ASC | Caspase-1 | GSDMD | IL-18 | IL-1β |
|---|---|---|---|---|---|---|---|
| 假手术组 | 5 | 0.23±0.02 | 0.31±0.03 | 0.11±0.02 | 0.41±0.04 | 0.47±0.05 | 0.36±0.04 |
| HIBD组 | 5 | 0.81±0.06a | 0.78±0.07a | 0.34±0.03a | 0.91±0.08a | 0.96±0.07a | 0.81±0.06a |
| MEL (5 mg/kg)组 | 5 | 0.43±0.05b | 0.48±0.06b | 0.28±0.03 | 0.66±0.07b | 0.79±0.05 | 0.66±0.06 |
| MEL (10 mg/kg)组 | 5 | 0.46±0.03b | 0.47±0.05b | 0.16±0.02b | 0.57±0.07b | 0.70±0.07b | 0.47±0.08b |
| MEL (20 mg/kg)组 | 5 | 0.56±0.09b | 0.39±0.06b | 0.22±0.03b | 0.66±0.07b | 0.79±0.07 | 0.77±0.03 |
| F值 | 72.21 | 51.18 | 60.14 | 36.20 | 40.57 | 58.28 | |
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 |
注:MEL:褪黑素;NLRP3:Nod样受体家族3;ASC:凋亡相关斑点样蛋白;Caspase-1:含半胱氨酸的天冬氨酸蛋白水解酶-1;GSDMD:消皮素D;IL-1β:白细胞介素-1β;IL-18:白细胞介素-18;HIBD:缺氧缺血性脑损伤;与假手术组比较,aP<0.05;与HIBD组比较,bP<0.05 MEL:melatonin;NLRP3:Nod- like receptor family 3;ASC:apoptosis-associated speck-like protein containing a card;GSDMD:gasdermin D;IL-1β:interleukin-1β;IL-18:interleukin-18;HIBD:hypoxic-ischemic brain damage;compared with the sham operation group,aP<0.05;compared with the HIBD group,bP<0.05
各组Akt的蛋白水平无明显改变。与HIBD组比较,MEL组(10 mg/kg)p-Akt表达水平升高,Caspase-1蛋白表达水平降低,差异均有统计学意义(均P<0.05);与MEL组(10 mg/kg)比较,MEL(10 mg/kg)+LY294002组p-Akt表达水平降低,Caspase-1蛋白水平升高,差异均有统计学意义(均P<0.05)。结果见图3、表4。
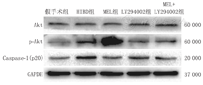

注:Akt:蛋白激酶B;p-Akt:磷酸化的蛋白激酶B;Caspase-1(p20):含半胱氨酸的天冬氨酸蛋白水解酶-1;HIBD:缺氧缺血性脑损伤;MEL:褪黑素;LY294002:磷脂酰肌醇3-激酶/Akt通路抑制剂 Akt:protein kinase B;p-Akt:phosphorylated protein kinase B;Caspase-1(p20):cleaved-Caspase-1;HIBD:hypoxic-ischemic brain damage;MEL:melatonin;LY294002:phosphatidylinositol 3-kinase/Akt pathway inhibitor
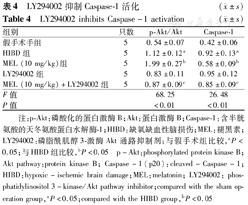
LY294002抑制Caspase-1活化 ( ±s)
±s)
LY294002 inhibits Caspase-1 activation ( ±s)
±s)
LY294002抑制Caspase-1活化 ( ±s)
±s)
LY294002 inhibits Caspase-1 activation ( ±s)
±s)
| 组别 | 只数 | p-Akt/Akt | Caspase-1 |
|---|---|---|---|
| 假手术手组 | 5 | 0.54±0.07 | 0.42±0.06 |
| HIBD组 | 5 | 1.12±0.12a | 0.92±0.13a |
| MEL (10 mg/kg)组 | 5 | 1.99±0.27b | 0.58±0.09b |
| LY294002组 | 5 | 0.83±0.11 | 0.95±0.12 |
| MEL (10 mg/kg)+LY294002组 | 5 | 0.87±0.09c | 0.85±0.09c |
| F值 | 68.25 | 26.48 | |
| P值 | <0.01 | <0.01 |
注:p-Akt:磷酸化的蛋白激酶B;Akt:蛋白激酶B;Caspase-1:含半胱氨酸的天冬氨酸蛋白水解酶-1;HIBD:缺氧缺血性脑损伤;MEL:褪黑素;LY294002:磷脂酰肌醇3-激酶Akt通路抑制剂;与假手术组比较,aP<0.05;与HIBD组比较,bP<0.05 p-Akt:phosphorylated protein kinase B;Akt pathway:protein kinase B; Caspase-1(p20):cleaved-Caspase-1;HIBD:hypoxic-ischemic brain damage;MEL:melatonin; LY294002: phosphatidylinositol 3-kinase/Akt pathway inhibitor;compared with the sham operation group,aP<0.05;compared with the HIBD group,bP<0.05
与HIBD组比较,LY294002组海马神经元核固缩、尼氏体减少,神经元丢失增多;与HIBD组比较,MEL组(10 mg/kg)海马神经元尼氏体相对增多,神经元丢失相对减少;而与MEL组比较,MEL(10 mg/kg)+ LY294002组海马神经元尼氏体减少,神经元丢失增多(图4)。
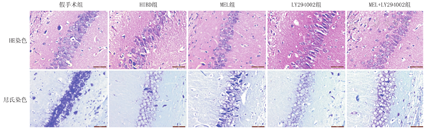

注:HIBD:缺氧缺血性脑损伤;MEL:褪黑素;LY294002:磷脂酰肌醇3-激酶/蛋白激酶B通路抑制剂 HIBD:hypoxic-ischemic brain damage;MEL:melatonin;LY294002:phosphatidylinositol 3-kinase/protein kinase B pathway inhibitor
HIBD是新生儿急性死亡和慢性神经系统损伤的主要原因。我国每年有4万~5万例新增缺氧缺血性脑病(HIE)患儿[7],其中15%~25%急性死亡,另有超过25%留下永久性神经系统后遗症[8]。亚低温是目前唯一有效的治疗手段,但推荐出生6 h内治疗,3 h最佳,且只适用于足月中重度的HIE患儿。同时,即便接受亚低温治疗的HIE患儿仍有近一半留下后遗症[9]。因此,迫切需要安全有效的新型治疗措施。海马是学习记忆功能的重要中枢定位,涉及从外部传递到神经中枢的信息整合[10],但极易受缺氧缺血损害,导致各种神经疾病[11]。研究发现,新生儿HIBD后,海马CA1区锥体细胞的突触功能和电生理特征发生改变[12]。因此,抑制海马神经元死亡和损伤可能是减轻学习记忆功能受损的关键。
目前,细胞死亡的方式主要有凋亡、焦亡和坏死。细胞焦亡作为一种新型的炎性相关的细胞死亡方式,在HIBD中的作用尚不十分清楚。本研究结果显示,缺氧缺血可导致海马区神经元数目减少,Caspase-1、GSDMD和IL-1β等蛋白和mRNA水平升高,提示细胞焦亡可能是HIBD神经元死亡的重要机制。此机制在缺血性中风、蛛网膜下腔出血和创伤性脑损伤等中枢神经系统损伤模型中也得到了肯定[13,14,15]。细胞焦亡是传感器Nod样受体与凋亡相关斑点样蛋白及半胱氨酸蛋白酶1前体构成的炎症小体复合物被激活后,形成活性Caspase-1,从而剪切GSDMD诱发细胞焦亡,释放IL-1β和IL-18等炎性因子[16]。而这一炎性释放过程与HIBD后期持续的炎症反应是否形成恶性循环放大损伤效应,尚有待进一步研究。
MEL是一种主要由松果体分泌的内源性吲哚类激素,脂溶性高、毒性低,具有良好的抗炎、抗氧化性能。本研究发现,腹腔注射MEL可减轻新生HIBD大鼠海马CA1区神经元丢失,降低焦亡指标的表达水平。据报道,线粒体在缺氧缺血状态下产生活性氧增加,而过量的活性氧可导致硫氧还蛋白相互作用蛋白从硫氧还蛋白分离,与NLRP3结合并形成活性炎性小体复合物[17]。褪黑素为线粒体靶向抗氧化剂,可作为对抗自由基的"防火墙"[18]。因此,抑制细胞焦亡可能是MEL脑保护作用的重要机制之一。
在研究进一步探讨MEL抗焦亡机制,结果显示MEL组p-Akt水平升高,活性Caspase-1表达降低;而Akt特异性抑制剂LY294002处理组与MEL组比较,p-Akt水平降低,活性Caspase-1表达升高,提示MEL可能是通过激活Akt信号通路抑制细胞焦亡。PI3K/Akt是调节细胞生长、炎症、代谢和细胞存活的关键信号通路,可通过调节转录因子的激活和基因表达来影响神经形成[19]。研究证实,PI3K/Akt信号通路参与多种中枢神经系统疾病,如蛛网膜下腔出血后早期脑损伤,脑缺血和脑缺血再灌注损伤[20]。作为PI3K的效应因子,Akt在脑缺血后海马CA1区神经元死亡中起关键作用。本研究发现HIBD组p-Akt与活性Caspase-1同时增加,其原因可能是缺氧缺血导致的保护性应激增加。
本研究在证实MEL具有抗焦亡作用时,未能排除凋亡和坏死的作用。有必要深入研究以进一步评估细胞焦亡在HIBD中的作用大小。更加精确的机制研究有望为临床治疗HIBD提供新的靶点,也为MEL应用于临床奠定基础。
所有作者均声明不存在利益冲突



























