
目前,免疫球蛋白E (immunoglobulin E,IgE)的致敏性检测是诊断过敏性疾病的基础,也是管理过敏性疾病(包括过敏原规避、药物治疗及特异性免疫治疗)的关键。2020年,世界过敏组织(World Allergy Organization,WAO)发表了关于IgE介导过敏反应诊断方法(包括体内检测和体外检测)的立场文件。本文旨在解读该文件中的体内检测部分,详细介绍了皮肤点刺试验(skin prick test,SPT)和皮内试验(intradermal test,IDT)的适应证、技术操作要求、结果判定和解读,比较了两种皮肤试验的优缺点,并对个别问题进行了补充说明,以便于理解。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
过敏性疾病又称变态反应性疾病,是由过敏原刺激机体所致的异常免疫反应,包括哮喘、过敏性鼻炎、特应性皮炎、食物过敏和药物过敏等。过敏性疾病是全球最常见的疾病之一,2013年,世界过敏组织(World Allergy Organization,WAO)在发表的《过敏反应白皮书》中指出[1],在全球范围内,过敏性疾病的患病率约为10%~40%,影响了全球约1/4的人口。过敏性疾病不仅影响患者的生活质量,甚至危及生命,并给社会带来沉重的经济负担。
准确诊断过敏性疾病并制订最佳治疗方案需要借助合适的检测方法,以确定过敏原致敏和过敏原的暴露情况。2020年,WAO成员撰写了关于免疫球蛋白E (immunoglobulin E,IgE)介导过敏反应的诊断方法(包括体内检测和体外检测)的共识,并以立场文件的形式发表于World Allergy Organ J[2]。在体内检测中,皮肤点刺试验(skin prick test,SPT)和皮内试验(intradermal test,IDT)是临床上最为常用的两种检测方法,本文就这两个方面进行解读。
最早的皮肤试验是在1865年由英国医师Charles H.Blackley进行的,他用一把柳叶刀擦伤了自己的前臂皮肤,然后涂上花粉颗粒,证实了花粉是导致自己过敏性鼻炎的病因。多年以后,Schloss推出了皮肤划痕试验[3],该试验通过将过敏原滴到前臂一小片未出血的擦伤区域来检测皮肤反应,主要用于诊断儿童的食物过敏。直到1924年,Lewis和Grant首次提出了SPT这一概念,并由Pepys对其操作技术进行了改进[4]。因皮肤划痕试验的敏感性较低、可重复性较差,SPT逐渐取而代之,成为临床上应用最为广泛的皮肤试验方法。
SPT的目的是确定患者体内是否存在过敏原特异性IgE(special IgE,sIgE),其原理是应用点刺针将特定的过敏原刺入患者的皮肤,过敏原IgE与细胞膜受体交联诱发肥大细胞脱颗粒,释放组胺等炎性介质,最终引起患者的皮肤反应,临床上表现为风团(有时为伪足)和周围红晕(潮红)。SPT一般用于检测Ⅰ型过敏反应,即患者在接触过敏原30~120 min内出现过敏表现。SPT具有快速、简便、安全、敏感度高和特异度高等优点,是诊断IgE介导Ⅰ型速发型过敏反应的一线方法。
SPT适用于各年龄段人群,但婴幼儿和老年患者的皮肤反应较为不明显。老年人因皮肤萎缩容易影响检测结果,幼儿前臂的大小会限制检测过敏原的数量,所以必要时可在背部进行试验[5]。一般情况下,患者如果出现以下临床指征,则需进行SPT:(1)哮喘;(2)过敏性鼻炎/鼻窦炎;(3)过敏性结膜炎;(4)湿疹/特应性皮炎;(5)食物过敏(口腔过敏综合征、怀疑由食物诱发的急性荨麻疹或皮疹加重、严重过敏反应等);(6)药物过敏;(7)膜翅目昆虫毒液过敏;(8)职业过敏原暴露诱发的过敏反应;(9)IgE介导的慢性荨麻疹;(10)嗜酸性食管炎、嗜酸性胃肠炎或变应性支气管肺曲霉菌病等较为少见的疾病,然而SPT的应用尚且存在争议。
为降低患者发生严重过敏反应的风险,并确保检测结果的可靠性和可重复性,SPT检测应尽可能使用标准化的过敏原点刺液,同时标注其效力单位。另外,点刺液的稳定性和效力对检测结果也很重要,其生物学效力会随时间的延长而降低,并在稀释和温度升高的情况下加速失效,因此通常使用50%甘油保存点刺液,并将其储存于2~8 ℃的制冷装置中。
目前,在某些国家或地区,重组或高度纯化的蛋白合成的过敏原试剂已被批准用于过敏性疾病。一般来说,天然合成的过敏原特异性高,能通过消除过敏原之间的交叉反应而避免假阳性结果,但目前仍不能确定重组过敏原在体内试验中的价值。
皮肤点刺试验工具种类繁多,最常用的为Morrow Brown标准化针、"Greer Pick®"(DKL)针、Stallerpoint®针和Phazet®针。穿刺试验也可以用分叉的天花疫苗接种针、23G静脉注射针或其他装置进行。为提高点刺效率,目前还开发了多个针头的塑料器械,可同时点刺多种过敏原。不同种类的点刺工具引发的皮肤反应大小不同,造成差异的原因包括点刺针穿透皮肤的深度、携带进入皮肤的过敏原的量、穿透角度及点刺操作人员的技术等。理想情况下,应使用同一种点刺工具以提高检测结果的可靠性和可比性。为避免产生假阳性结果,通常不建议使用导致阴性对照的风团>3 mm和红晕>10 mm的点刺工具或操作技术。
过敏原检测种类应根据患者的病史、居住环境及过敏原的暴露模式(季节性或常年性或散发性)和地区分布情况来确定。全球过敏和哮喘欧洲协作组织(Global Allergy and Asthma European Network ,GA2LEN)推荐欧洲地区采用18种吸入过敏原的检测组合(表1)。患者在不同地区的过敏原暴露情况不同,程晟等[6]发现,相比于西方欧美国家的致敏花粉主要以豚草、梯牧草等种类为主,我国主要致敏花粉植物为松科、蒿属、杨属、禾本科、柳属、柏属、藜科、葎草属、苋科、悬铃木属。我国幅员辽阔,国内不同区域的气传花粉植物种类分布也存在较大的差异,但目前我国仍建议使用标准化的过敏原组合[7],各地可根据当地的情况适度增减过敏原试剂种类。在生物种类繁多、气候温暖的地区,需检测的过敏原种类也更多。在热带国家,建议检测热带无爪螨。

全球过敏和哮喘欧洲协作组织推荐的欧洲地区18种过敏原组合
Global Allergy and Asthma European Network-suggested panel of allergens to be tested in all patients in Europe
全球过敏和哮喘欧洲协作组织推荐的欧洲地区18种过敏原组合
Global Allergy and Asthma European Network-suggested panel of allergens to be tested in all patients in Europe
| 桤木(桤木属,Alnus incana) |
| 桦树(桦木属,Betula alba) |
| 柏树(地中海柏木,Cupressus sempervirens) |
| 榛树(榛属,Corylus avellana) |
| 梧桐(悬铃木,Platanus vulgaris) |
| 草混合物(包括草地早熟禾Poa pratensis、鸡脚草Dactilis glomerata、黑麦草Lolium perenne、猫尾草Phleum pratense、牛尾草Festuca pratensis、草地燕麦草Helictotrichon pratense) |
| 橄榄(油橄榄,Olea europea) |
| 艾蒿(艾蒿,Artemisia vulgaris) |
| 豚草(豚草,Ambrosia artemisiifolia) |
| 链格孢属(Alternaria alternata) |
| 分枝孢子菌属(Cladosporium herbarum) |
| 烟曲霉(Aspergillus fumigatus) |
| 墙草(Parietaria) |
| 猫(家猫,Felis domesticus) |
| 狗(家犬,Canis familiaris) |
| 屋尘螨(Dermatophagoides pteronyssinus) |
| 粉尘螨(Dermatophagoides farinae) |
| 蟑螂(德国小蠊,Blatella germanica) |
通常,婴幼儿(<2岁)对过敏原的敏感性不及年长儿和成人,因此所需检测的过敏原种类应相应减少。婴幼儿的过敏原致敏反映的是在生命早期密切接触和/或长期暴露的过敏原,如食物、屋尘螨、室内霉菌和动物皮屑等。
需要注意的是,过敏原之间可能存在交叉反应,即特定过敏原引起的皮肤反应也可由与其结构同源的其他过敏原引起。花粉的交叉反应在植物分类学相近或蛋白质结构高度保守的物种间很常见。考虑到过敏原之间可能存在交叉反应,并排除与暴露区域无关的过敏原,应限制SPT检测的过敏原种类的数量。必要时,可检测过敏原组分。
IgE介导过敏反应涉及的食物种类相对固定,婴幼儿常见的食物过敏原为牛奶、鸡蛋、花生、坚果、大豆和小麦,而成人常见的食物过敏原为花生、坚果、鱼、甲壳类、贝类、水果和蔬菜。对于蔬菜、水果等过敏原,推荐采用Prick-Prick(PPT)方法,即直接用消毒针尖挑刺新鲜食物后,立即刺入患者的皮肤,可以提高检测的敏感性。职业过敏原(乳胶、啮齿类动物、面粉等)导致的过敏反应是一种特殊的情况,然而由于可靠的标准化过敏原试剂数量有限,限制了皮肤试验在诊断职业过敏中的应用。
在临床上,一般不推荐常规进行多次SPT检测,如果患者的过敏原发生变化、出现了新的过敏表现或过敏表现与已检测的过敏原不相关,以及在评估毒液过敏的免疫治疗方案时,可考虑重复检测。
操作前应评估患者的临床状况并询问近期有无服用会影响检测结果的药物。SPT操作通常选择前臂掌侧皮肤,婴儿首选背部肩胛内侧皮肤,不建议选择距离手腕5 cm和肘窝3 cm以内的部位。皮肤试验有诱发严重过敏反应的风险,因此必须在有专业医护人员监督并配有急救设备的条件下进行。为避免假阴性或假阳性结果,必须同时设置阴性和阳性对照,阳性对照通常使用磷酸组胺溶液(浓度为5.43 mmol/L),阴性对照为生理盐水。
操作要点:清洁受试者皮肤并用酒精消毒后,将点刺液滴在受试者皮肤上,点刺针与皮肤呈45°~60°穿过药液刺入皮肤(或垂直刺入皮肤,轻压皮肤1 s后拔出),使表皮下渗透少量的过敏原提取液。为避免提取液混合或重叠,2个点刺点之间必须间隔2 cm或以上。另外,应严格避免穿刺过深引发出血。
点刺试验操作中常见问题:(1)点刺点之间间隔过近(<2 cm),导致风团重叠无法用肉眼区分;(2)点刺过深导致出血,造成假阳性结果并增加严重过敏反应的风险;(3)点刺过浅导致假阴性,常见于塑料点刺针;(4)擦拭过敏原试剂操作不当造成点刺液混合。
组胺引起的皮肤反应在点刺后8~10 min达到峰值,过敏原在15~20 min达到峰值,因此一般在点刺操作15~20 min后测量风团大小,并计算其平均直径D+d/2(D为风团最大直径,d表示垂直于D的最大直径),也有专家建议使用(D+d)/2公式计算。SPT结果的判定方式有2种:(1)阴性和阳性;(2)0~4+的分级量表。若过敏原风团直径与阴性对照风团直径的差值≥3 mm,则判定SPT阳性;若风团直径<3 mm,且组胺对照组的结果为阳性,则判定SPT阴性。WAO不建议使用分级量表判定皮肤试验结果。目前国内常用的分级量表有两种:(1)同时评估风团和红晕的半定量分级系统[8]:"0"为无反应或与阴性对照无差别;"+"为红晕<21 mm;"++"为风团<3 mm且红晕>21 mm;"+++"为风团>3 mm且周围有红晕;"++++"为风团伴伪足和红晕。(2)基于皮肤指数(skin index,SI)的评价系统[9],即通过计算点刺液风团平均直径与组胺对照风团平均直径的比值,将SPT反应强度分为4个等级(+:0.3≤SI<0.5;++:0.5≤SI<1.0;+++:1.0≤SI<2.0;++++:SI≥2.0)。其他的评估方式还包括测量皮肤反应的最长直径和反应面积等。
导致假阳性结果的原因:皮肤划痕征阳性;过敏原提取液中混有杂质、污染物和非特异性肥大细胞促分泌素;还应考虑穿刺工具和操作技术等方面的影响因素。
导致假阴性最常见的原因:患者应用了抑制组胺活性的药物、操作技术不当(如点刺过浅)、操作到判读的时间过短或过长及由于过敏原试剂老化或原材料质量差而导致效力降低等。
SPT能客观、可靠地证实机体存在过敏原致敏,然而,诊断过敏性疾病除根据SPT结果外,还需仔细考虑患者的病史和临床表现。SPT结果解读与后续过敏原规避以及是否选择免疫治疗密切相关,应由临床专业医师慎重解读。SPT阳性并不能直接代表有过敏表现,据报道,SPT阳性无临床表现的发生率为8%~30%。同样,SPT阴性有时并不能代表患者无过敏性疾病,儿童SPT阴性也并不排除未来出现过敏性疾病的可能性。为更准确地解读SPT结果,GA2LEN研究了风团与临床症状(哮喘、过敏性鼻炎、特应性皮炎和食物过敏)的相关性,结果显示,随着吸入过敏原诱发的风团增大,患者发生过敏症状的风险会显著增加。并且,不同过敏原中有40%(德国小蠊属)至87%~89%(草、屋尘螨)的SPT阳性反应与患者的临床症状相关。
SPT操作要求患者皮肤表面正常,不宜在有活动性皮炎、严重皮肤划痕征和纹身的皮肤部位进行操作。此外,长期遭受日晒损伤及皮肤的老化会降低皮肤的反应性,从而导致假阴性结果。
某些药物,如抗组胺药物、糖皮质激素类及抗抑郁药物等会抑制速发型皮肤反应(表2),从而影响SPT结果,因此在操作前应确认患者近期的用药情况。美国过敏、哮喘和免疫学会(American Academy of Allergy Asthma and Immunology,AAAAI)、美国过敏、哮喘和免疫学院(American College of Allergy Asthma and Immunology,ACAAI)及欧洲过敏和临床免疫学会(European Academy of Allergy and Immunology,EAACI)联合制订的指南建议,对于可能会影响SPT结果的药物应予以停用:H1-抗组胺药一般停用4~5 d,最好停用7 d;H2-抗组胺药停用24 h;H1-抗组胺活性的抗抑郁药停用1周;外用强效糖皮质激素需在点刺部位停用3周。
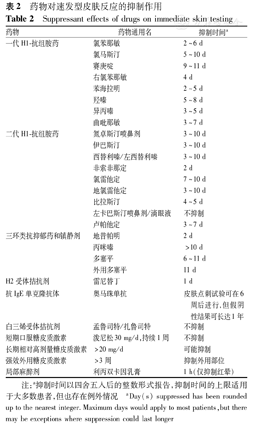
药物对速发型皮肤反应的抑制作用
Suppressant effects of drugs on immediate skin testing
药物对速发型皮肤反应的抑制作用
Suppressant effects of drugs on immediate skin testing
| 药物 | 药物通用名 | 抑制时间a |
|---|---|---|
| 一代H1-抗组胺药 | 氯苯那敏 | 2~6 d |
| 氯马斯汀 | 5~10 d | |
| 赛庚啶 | 9~11 d | |
| 右氯苯那敏 | 4 d | |
| 苯海拉明 | 2~5 d | |
| 羟嗪 | 5~8 d | |
| 异丙嗪 | 3~5 d | |
| 曲吡那敏 | 3~7 d | |
| 二代H1-抗组胺药 | 氮卓斯汀喷鼻剂 | 3~10 d |
| 伊巴斯汀 | 3~10 d | |
| 西替利嗪/左西替利嗪 | 3~10 d | |
| 非索非那定 | 2 d | |
| 氯雷他定 | 7~10 d | |
| 地氯雷他定 | 3~10 d | |
| 比拉斯汀 | 4~5 d | |
| 左卡巴斯汀喷鼻剂/滴眼液 | 不抑制 | |
| 卢帕他定 | 3~7 d | |
| 三环类抗抑郁药和镇静剂 | 地昔帕明 | 2 d |
| 丙咪嗪 | >10 d | |
| 多塞平 | 6~11 d | |
| 外用多塞平 | 11 d | |
| H2受体拮抗剂 | 雷尼替丁 | 1 d |
| 抗IgE单克隆抗体 | 奥马珠单抗 | 皮肤点刺试验可在6周后进行,但假阴性结果可长达1年 |
| 白三烯受体拮抗剂 | 孟鲁司特/扎鲁司特 | 不抑制 |
| 短期口服糖皮质激素 | 泼尼松30 mg/d,持续1周 | 不抑制 |
| 长期相对高剂量糖皮质激素 | >20 mg/d | 可能抑制 |
| 强效外用糖皮质激素 | >3周 | 抑制外用部位 |
| 局部麻醉剂 | 利丙双卡因乳膏 | 1 h(仅抑制红晕) |
注:a抑制时间以四舍五入后的整数形式报告,抑制时间的上限适用于大多数患者,但也存在例外情况 aDay(s) suppressed has been rounded up to the nearest integer.Maximum days would apply to most patients,but there may be exceptions where suppression could last longer
IDT是体内试验中的另一种检测方法,由Mantoux于1908年首次报道,Cooke于1911年将其应用于过敏反应检测[4,10]。当临床上强烈怀疑患者存在IgE介导的过敏性疾病,且SPT阴性时,可以考虑对其进行IDT,以便检测出低敏感性的过敏原。IDT对操作技术的专业要求更高,发生不良反应的风险亦增加,因此仅限于在容易获得急救设备和紧急治疗药物的临床环境中操作。
IDT主要用于诊断药物过敏、膜翅目昆虫毒液过敏及SPT阴性的呼吸道过敏。IDT在诊断β-内酰胺类药物(尤其是青霉素和头孢菌素)过敏方面的作用明确,也可用于其他药物,如胰岛素、阿片类、麻醉剂、肌松药、质子泵抑制剂、酶和化疗药物。IDT也适用某些特殊情况,如食物IDT有时被用于诊断α-半乳糖过敏引起的迟发性食物过敏。
皮试部位选取上臂外侧皮肤,皮肤消毒后,以小型注射器将过敏原皮试液注入皮内,在皮肤表面形成小皮丘,注入量通常为0.02 mL,20 min后观察注射部位的风团和红晕的反应。IDT的敏感性高于SPT,为降低不良反应的发生概率,国外学者[11]建议在IDT前先行SPT,若SPT阳性,表明患者对该过敏原敏感,则无需进行IDT;相反,若SPT阴性,则认为患者可以安全地进行IDT。IDT皮试液是SPT过敏原提取液的稀释剂,稀释倍数一般为10~1 000倍或更多。阳性和阴性对照试验应同时进行,通常分别使用组胺和生理盐水。
皮肤终点滴定(skin endpoint titration,SET),是通过逐渐增加过敏原的浓度进行皮内注射,以定量测定引发过敏反应所需最低过敏原浓度的方法,通常用于检测毒液过敏和药物过敏。为避免严重的过敏反应,该试验通常从过敏原提取液的最大稀释浓度开始。15~20 min后观察注射部位的风团和红晕。滴定终点通常是引起风团增大时的滴定液浓度。还有研究者认为,滴定终点是引起最小红晕的第1剂过敏原浓度。皮肤终点滴定可以粗略地量化患者的皮肤反应及机体对过敏原的敏感程度,并可以用于指导免疫治疗的初始剂量选择,缺点是耗时较长且部分患者会有不适感。目前,IDT的滴定方法尚未统一。
速发型过敏反应的皮内试验结果通常在皮内注射15~20 min后读取,主要阳性反应为风团形成,伴有红晕和伪足形成等反应。一般认为,当风团直径>阴性对照3 mm以上,且红晕>10 mm时可判定为IDT阳性[12]。在国内,IDT结果的等级判定多基于0~4+的Norman评估系统[10]:"-"为风团直径<5 mm,且周围红晕<5 mm;"±"为风团直径5~10 mm,红晕5~10 mm;"+"为风团直径5~10 mm,红晕11~20 mm;"2+"为风团直径5~10 mm,红晕21~30 mm;"3+"为风团直径10~15 mm或有伪足,红晕31~40 mm;"4+"为风团直径>15 mm或有许多伪足,红晕>40 mm。
IDT和SPT各有优势,并相互补充(表3)。IDT在检测sIgE方面具有更高的敏感度和可重复性,但由于SPT具有节省时间、患者的舒适度和安全性高,与临床过敏反应的相关性更好等优势,因此在临床实践中更推荐使用SPT。
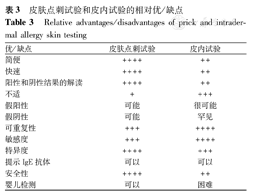
皮肤点刺试验和皮内试验的相对优/缺点
Relative advantages/disadvantages of prick and intradermal allergy skin testing
皮肤点刺试验和皮内试验的相对优/缺点
Relative advantages/disadvantages of prick and intradermal allergy skin testing
| 优/缺点 | 皮肤点刺试验 | 皮内试验 |
|---|---|---|
| 简便 | ++++ | ++ |
| 快速 | ++++ | ++ |
| 阳性和阴性结果的解读 | ++++ | ++ |
| 不适 | + | +++ |
| 假阳性 | 可能 | 很可能 |
| 假阴性 | 可能 | 罕见 |
| 可重复性 | +++ | ++++ |
| 敏感度 | +++ | ++++ |
| 特异度 | ++++ | +++ |
| 提示IgE抗体 | 可以 | 可以 |
| 安全性 | ++++ | ++ |
| 婴儿检测 | 可以 | 困难 |
过敏原检测是诊断和管理过敏性疾病(包括过敏原规避、药物治疗及特异性免疫治疗)的关键。对于IgE介导的Ⅰ型过敏反应,皮肤试验,尤其是SPT,是确定过敏患者的体内存在过敏原sIgE的一线方法。然而,体内检测有诱发严重过敏反应的风险,故应在有抢救条件的医院并在专业人员监测下进行。一般来说,当患者过敏症状严重或皮肤反应明显,则预测此次皮肤试验可能出现严重不良反应。
在临床环境中,体内检测可以与体外检测血清sIgE同时进行,当患者的临床症状与SPT或sIgE结果不相符时,还可以联合嗜碱性粒细胞活化试验及过敏原激发试验等评估过敏原致敏的临床相关性。另外,随着IgE诊断纯化或基因重组技术的发展,过敏原分子组分诊断是过敏性疾病精准诊断的新型发展趋势。然而,无论选用哪种检测方式,过敏原检测结果的临床意义,必须经由专业的临床医师结合患者病史、临床表现和过敏原暴露情况来确定,没有任何一种检测方法可以代替充分评估病史的重要性。
所有作者均声明不存在利益冲突



























