
通过检测程序性死亡分子1(PD-1)、程序性死亡-配体1 (PD-L1)在急性淋巴细胞白血病(ALL)患儿骨髓单个核细胞中的表达水平,探讨PD-1/PD-L1信号通路在儿童ALL中的作用机制以及其作为潜在治疗靶点和预后预测指标的可行性,为儿童ALL的诊疗提供新思路。
收集郑州大学第一附属医院2018年9月至2019年7月收治的59例ALL患儿骨髓标本,应用流式细胞术检测59例ALL患儿(包括初诊ALL 47例,复发ALL 12例)初诊时、诱导治疗后、早期强化治疗后骨髓单个核细胞中PD-1、PD-L1的表达,并收集患儿的相关临床资料,以同期收治的15例非恶性血液疾病患儿骨髓标本为对照组。
PD-1在初诊组、复发组及对照组患儿骨髓单个核细胞中的表达差异无统计学意义(H=2.402,P>0.05),PD-L1在复发组[(7.32±3.60)%]和初诊组[(3.18±2.37)%]的表达率均大于对照组[(0.84±0.39)%],差异有统计学意义(H=28.048,P<0.05)。初诊组患儿骨髓单个核细胞中PD-L1在不同治疗阶段的表达:治疗前(B=1.293)>诱导治疗后(B=0.036)>早期强化治疗后(B=0.000),提示随着治疗的推进呈下降趋势;PD-L1的表达在低危组(B=-3.912)<中危组(B=-3.595)<高危组(B=0.000),提示PD-L1的表达与ALL危险程度分级有关,危险程度分级越高,PD-L1蛋白表达越高。
PD-L1高表达可能参与儿童ALL的发病机制,不仅可作为儿童ALL的不良预测指标,还可作为化疗疗效评价指标;PD-1/PD-L1信号通路可能是儿童ALL的潜在治疗靶点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着肿瘤免疫学的发展,学者研究发现程序性死亡分子1(PD-1)/程序性死亡-配体1(PD-L1)信号通路是肿瘤细胞逃避免疫监视的重要机制[1]。PD-1是一种重要的免疫抑制分子,属CD28超家族成员,表达于活化的T淋巴细胞和B淋巴细胞表面,肿瘤细胞会高表达PD-L1,导致肿瘤微环境中PD-1/PD-L1信号通路持续激活,负反馈地抑制T/B淋巴细胞活性,从而介导肿瘤细胞发生免疫逃逸。目前已证实PD-1/PD-L1信号通路参与多种实体肿瘤的发生发展机制,PD-L1的高表达与不良预后相关[1,2,3],但对儿童急性淋巴细胞白血病(ALL)的相关文献鲜见报道。本研究拟通过检测PD-1、PD-L1在ALL患儿骨髓单个核细胞中的表达情况,探讨PD-1/PD-L1信号通路在儿童ALL发病机制中的作用以及PD-1、PD-L1作为ALL潜在治疗靶点、预后预测指标的可行性,为儿童ALL的治疗提供新思路。
收集郑州大学第一附属医院2018年9月至2019年7月59例ALL患儿的骨髓标本各5 mL,同期收集郑州大学第一附属医院同年龄段的非血液系统恶性疾病患儿的骨髓标本15例作为对照组。纳入标准:(1)患儿均经骨髓细胞形态学、免疫学、细胞遗传学、分子生物学确诊,诊断及分型标准参照儿童ALL诊疗建议(第四次修订版)[4];(2)患儿年龄0~14岁;(3)未合并其他严重内科疾病,重要器官功能尚可;(4)未合并第二原发肿瘤;(5)有完整临床病例资料及随访资料。本研究通过郑州大学第一附属医院医学伦理委员会批准(批准文号:20170205),标本采集监护人均知情同意,并签署知情同意书。
将患儿分为初诊组(47例)、复发组(12例)及对照组(15例)。统计患儿性别、年龄、初诊时外周血白细胞计数、血红蛋白水平、中性粒细胞计数及血小板计数、临床危险度分型。采用流式细胞术检测各组患儿骨髓单个核细胞中PD-1、PD-L1的表达。
将47例初诊患儿根据ALL危险度分级分为低危组、中危组及高危组,依据中国儿童白血病协作组(CCLG)-2008方案[4]规律给予诱导缓解治疗及早期强化治疗。分析化疗前后PD-1、PD-L1的表达差异。
兔抗人PD-1单克隆抗体、兔抗人PD-L1抗体及同型抗体均购自英国Abcam公司。治疗前取受试者用乙二胺四乙酸(EDTA)抗凝的新鲜骨髓2~5 mL,500 g离心20 min收集单个核细胞,磷酸盐缓冲液(PBS)重悬细胞,调整细胞密度为1×109个/L。取1 mL细胞悬液加入荧光标记的抗体,冰上孵育0.5 h,PBS离心(250 g离心10 min)洗涤后,转入流式管中,上机检测PD-1、PD-L1的表达。
随访主要通过电话、患儿住院及门诊复诊等方式来进行。随访截止日期为2019年12月31日。
采用SPSS 21.0软件进行统计学分析。符合正态分布的连续变量采用 ±s表示,不符合正态分布的连续变量采用中位数(M)(P25,P75)表示,分类变量采用百分比表示。2组变量之间的相关性采用Spearman秩检验。多组连续变量间比较采用Kruskal-Wallis检验。重复测量数据采用广义估计方程分析。P<0.05为差异有统计学意义。
±s表示,不符合正态分布的连续变量采用中位数(M)(P25,P75)表示,分类变量采用百分比表示。2组变量之间的相关性采用Spearman秩检验。多组连续变量间比较采用Kruskal-Wallis检验。重复测量数据采用广义估计方程分析。P<0.05为差异有统计学意义。
本研究共纳入59例ALL患儿及15例对照组患儿。59例ALL患儿中包括初诊ALL患儿47例,复发ALL患儿12例,其中男35(59.32%)例,女24(40.68%)例,B-ALL 52例(88.13%),T-ALL 7例(11.86%),中位年龄为6(0,14)岁。
经流式细胞仪检测,PD-1在各研究组患儿骨髓单个核细胞中均有表达,初诊组、复发组、对照组的表达率依次为(27.39±11.94)%、(29.71±4.45)%,(24.07±5.64)%,但各组间差异无统计学意义(H=2.402,P>0.05)。PD-L1在各组患儿骨髓单个核细胞中也均有表达,初诊组、复发组、对照组的表达率依次为(3.18±2.37)%、(7.32±3.60)%、(0.84±0.39)%,复发组表达明显高于初诊组,且2组均高于对照组,差异有统计学意义(H=28.048,P<0.05)。
分别对初诊组、复发组及对照组患儿的骨髓单个核细胞PD-1及PD-L1的表达进行相关性分析,经统计学分析二者均无相关性(均P>0.05)(表1)。
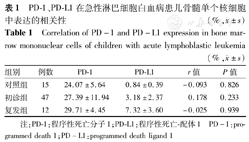
PD-1、PD-L1在急性淋巴细胞白血病患儿骨髓单个核细胞中表达的相关性(%, ±s)
±s)
Correlation of PD-1 and PD-L1 expression in bone marrow mononuclear cells of children with acute lymphoblastic leukemia(%, ±s)
±s)
PD-1、PD-L1在急性淋巴细胞白血病患儿骨髓单个核细胞中表达的相关性(%, ±s)
±s)
Correlation of PD-1 and PD-L1 expression in bone marrow mononuclear cells of children with acute lymphoblastic leukemia(%, ±s)
±s)
| 组别 | 例数 | PD-1 | PD-L1 | r值 | P值 |
|---|---|---|---|---|---|
| 对照组 | 15 | 24.07±5.64 | 0.84±0.39 | -0.093 | 0.826 |
| 初诊组 | 47 | 27.39±11.94 | 3.18±2.37 | 0.178 | 0.233 |
| 复发组 | 12 | 29.71±4.45 | 7.32±3.60 | -0.025 | 0.939 |
注:PD-1:程序性死亡分子1;PD-L1:程序性死亡-配体1 PD-1:programmed death 1;PD-L1:programmed death ligand 1
检测结果发现,PD-1与患儿临床特征均无相关性,PD-L1的表达与患儿的性别、年龄、初诊时血常规(包括白细胞计数、血红蛋白量、血小板计数)无相关性,但与白血病免疫分型有相关性(r=0.293,P=0.046)(表2)。
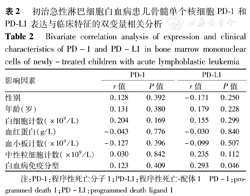
初治急性淋巴细胞白血病患儿骨髓单个核细胞PD-1和PD-L1表达与临床特征的双变量相关分析
Bivariate correlation analysis of expression and clinical characteristics of PD-1 and PD-L1 in bone marrow mononuclear cells of newly-treated children with acute lymphoblastic leukemia
初治急性淋巴细胞白血病患儿骨髓单个核细胞PD-1和PD-L1表达与临床特征的双变量相关分析
Bivariate correlation analysis of expression and clinical characteristics of PD-1 and PD-L1 in bone marrow mononuclear cells of newly-treated children with acute lymphoblastic leukemia
| 影响因素 | PD-1 | PD-L1 | ||
|---|---|---|---|---|
| r值 | P值 | r值 | P值 | |
| 性别 | 0.128 | 0.392 | -0.171 | 0.250 |
| 年龄(岁) | 0.131 | 0.380 | 0.179 | 0.228 |
| 白细胞计数(×109/L) | 0.204 | 0.169 | 0.155 | 0.299 |
| 血红蛋白(g/L) | -0.043 | 0.776 | -0.030 | 0.840 |
| 血小板计数(×109/L) | -0.127 | 0.396 | -0.099 | 0.507 |
| 中性粒细胞计数(×109/L) | 0.030 | 0.842 | 0.235 | 0.112 |
| 白血病免疫分型 | 0.123 | 0.409 | 0.293 | 0.046 |
注:PD-1:程序性死亡分子1;PD-L1:程序性死亡-配体1 PD-1:programmed death 1;PD-L1:programmed death ligand 1
经建立广义估计方程统计分析,PD-1在治疗前、诱导治疗后、早期强化治疗后各阶段的相对表达差异无统计学意义(P>0.05),提示治疗的推进对PD-1的表达无显著影响。据临床危险度分级比较,低危组、中危组与高危组中PD-1的相对表达差异亦无统计学意义(均P>0.05),说明临床危险度也不能显著影响PD-1的表达(表3)。
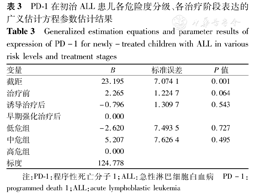
PD-1在初治ALL患儿各危险度分级、各治疗阶段表达的广义估计方程参数估计结果
Generalized estimation equations and parameter results of expression of PD-1 for newly-treated children with ALL in various risk levels and treatment stages
PD-1在初治ALL患儿各危险度分级、各治疗阶段表达的广义估计方程参数估计结果
Generalized estimation equations and parameter results of expression of PD-1 for newly-treated children with ALL in various risk levels and treatment stages
| 变量 | B | 标准误差 | P值 |
|---|---|---|---|
| 截距 | 23.195 | 7.074 1 | 0.001 |
| 治疗前 | 2.265 | 1.224 7 | 0.064 |
| 诱导治疗后 | -0.796 | 1.309 7 | 0.543 |
| 早期强化治疗后 | 0.000 | ||
| 低危组 | -2.620 | 7.493 5 | 0.727 |
| 中危组 | 5.207 | 7.626 4 | 0.495 |
| 高危组 | 0.000 | ||
| 标度 | 124.778 |
注:PD-1:程序性死亡分子1;ALL:急性淋巴细胞白血病 PD-1:programmed death 1;ALL:acute lymphoblastic leukemia
经建立广义估计方程统计分析,PD-L1在治疗前、诱导治疗后、早期强化治疗后阶段的相对表达呈下降趋势,经统计学分析差异均有统计学意义(均P<0.05),说明治疗的推进可显著降低PD-L1的表达。据临床危险度分级比较,PD-L1在低危组、中危组与高危组的相对表达呈上升趋势,差异均有统计学意义(均P<0.05),表明临床危险度越高,PD-L1的表达也越高(表4)。
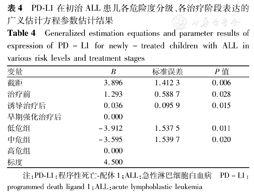
PD-L1在初治ALL患儿各危险度分级、各治疗阶段表达的广义估计方程参数估计结果
Generalized estimation equations and parameter results of expression of PD-L1 for newly-treated children with ALL in various risk levels and treatment stages
PD-L1在初治ALL患儿各危险度分级、各治疗阶段表达的广义估计方程参数估计结果
Generalized estimation equations and parameter results of expression of PD-L1 for newly-treated children with ALL in various risk levels and treatment stages
| 变量 | B | 标准误差 | P值 |
|---|---|---|---|
| 截距 | 3.896 | 1.412 3 | 0.006 |
| 治疗前 | 1.293 | 0.588 7 | 0.028 |
| 诱导治疗后 | 0.036 | 0.095 9 | 0.015 |
| 早期强化治疗后 | 0.000 | ||
| 低危组 | -3.912 | 1.537 5 | 0.011 |
| 中危组 | -3.595 | 1.539 7 | 0.020 |
| 高危组 | 0.000 | ||
| 标度 | 4.500 |
注:PD-L1:程序性死亡-配体1;ALL:急性淋巴细胞白血病 PD-L1:programmed death ligand 1;ALL:acute lymphoblastic leukemia
ALL是儿童最常见的恶性血液肿瘤,随着化疗方案的不断优化,儿童ALL的缓解率大大提高,国外可达95%以上[5],国内一些治疗中心也可达到90%的治愈率[6]。但仍有20%~30%患儿复发难治,预后极差,亟待从发病机制中发现新的靶点,探索新的治疗策略[7,8]。
随着免疫学的发展,肿瘤细胞免疫逃避机制成为临床研究热点。大量研究证实肿瘤微环境(TIME)在肿瘤的发生、发展和转移中起至关重要的作用[3]。目前发现PD-1为肿瘤微环境中重要的抑制性受体之一[9]。PD-1属于CD28家族成员,主要在活化的T淋巴细胞、B淋巴细胞、活化自然杀伤T淋巴细胞、单核细胞和调节性T淋巴细胞中表达[10]。PD-1是一种Ⅰ型跨膜糖蛋白,胞外区是由一个IgV样结构域组成,含有多个糖基化位点并被重度糖基化,该结构域与其配体结合具有抑制T淋巴细胞活化的功能[10]。PD-L1是PD-1配体之一,属B7超家族的成员,一般在B淋巴细胞、T淋巴细胞、树突状细胞、巨噬细胞等细胞表面表达。当机体发生炎症反应时,PD-L1的表达上调,T淋巴细胞表面PD-1与抗原呈递细胞表面PD-L1结合产生抑制信号,防止T淋巴细胞在机体感染或外源体入侵时产生过度免疫,以确保正常组织免受损伤[9]。已有研究发现PD-L1在肺癌、乳腺癌等实体肿瘤组织和细胞中高表达[11],可通过与PD-1的结合产生抑制信号,使肿瘤细胞逃避T淋巴细胞的免疫监视功能,发生免疫逃逸[3]。PD-1/ PD-L1负性免疫调节作用在肿瘤的发生发展过程中起重要作用。
目前有关PD-1、PD-L1在儿童ALL中表达的文献鲜见报道。本研究通过流式细胞仪检测ALL患儿骨髓单个核细胞PD-1表达,发现初诊组和复发组的表达与对照组相比,差异无统计学意义(H=2.402,P>0.05),但PD-L1在初诊组表达高于对照组,差异有统计学意义(H=28.048,P<0.05),表明当淋巴细胞发生恶变时,PD-1的基础表达发生变化不大,而PD-L1发生了显著变化。Feucht等[12]和Kang等[13]通过流式细胞仪也检测到PD-L1在儿童急性白血病中高表达,本研究结果与之相符,结合文献报道认为儿童ALL细胞高表达PD-L1,激活PD-1/PD-L1抑制信号通路,促成白血病细胞免疫逃逸,可能参与儿童ALL的发病机制,PD-L1有望成为儿童ALL新的治疗靶标。
通过分析患儿的临床资料发现,PD-L1的表达与患儿初诊年龄、性别、血细胞计数均无相关性,仅与患儿白血病免疫分型有相关性(r=0.293,P=0.046)。临床危险分级是否对PD-L1的表达也有影响?进一步统计分析,复发组PD-L1的表达高于初诊组,据临床危险度分级比较PD-L1的表达也显示高危组>中危组>低危组,提示临床危险越高、PD-L1表达相对也越高。van Dam等[14]学者也研究发现在成人白血病复发组PD-L1的表达明显高于初诊或健康对照组,复发/难治性患者T淋巴细胞上PD-L1表达升高,认为成人白血病患者PD-L1的高表达可能与复发、不完全缓解和生存率降低有关,PD-L1对成人复发难治性ALL的生存预测有意义[15]。结合文献报道认为PD-L1在ALL患儿的高表达可能也预示复发、难治等不良预后,有望作为儿童ALL的预后预测指标,但仍需进一步临床研究验证。
经建立广义估计方程分析在治疗前、诱导治疗后、早期强化治疗后3个不同治疗阶段中PD-1、PD-L1的表达情况,结果显示PD-1在各治疗阶段表达差异无统计学意义(均P>0.05),但PD-L1的表达随着治疗的推进、骨髓的缓解呈逐渐下降趋势(均P<0.05),提示PD-L1可作为儿童ALL化疗疗效的评价指标。
综上,本研究认为PD-L1的表达升高,激活PD-1/PD-L1信号通路,其发挥的负性免疫调节作用可能参与儿童ALL的发病机制,且PD-L1高表达可能预示着ALL患儿不良的生存结局,PD-L1还可作为化疗疗效评价指标之一。PD-1/PD-L1信号通路可能是儿童ALL的潜在治疗靶点,阻断PD-1/PD-L1信号通路、干预ALL患儿骨髓单个核细胞中PD-L1的表达,有望成为儿童ALL治疗的新思路。目前已研发出PD-1/PD-L1的抑制剂应用于临床治疗黑色素瘤、肺癌、乳腺癌、霍奇金淋巴瘤并有显著临床疗效[16,17,18,19,20,21],未来有望应用于儿童复发难治性ALL的治疗。本研究为单中心研究,且存在随访时间较短、样本量较少等局限性,需要扩大样本量、延长随访时间、进行多中心研究等进一步论证本研究结论。
所有作者均声明不存在利益冲突



























