
比较RNA与DNA核酸检测方法在肺炎支原体(MP)感染早期诊断及疗效监测中的应用价值。
收集2018年1月至12月在首都儿科研究所附属儿童医院呼吸内科住院肺炎患儿的呼吸道标本。采用MP核酸及耐药突变位点检测试剂盒进行DNA检测,采用MP核酸检测试剂盒进行RNA检测。
进行MP-DNA检测的1 994例标本中,阳性检出率为42.1%(840/1 994例),其中96.0%(806/840例)的MP阳性标本存在大环内酯类耐药基因突变。进行MP-RNA检测的1 624例标本中,阳性检出率为33.9%(551/1 624例)。758例标本同时进行了MP-DNA与MP-RNA检测,MP-DNA检测的阳性率为43.1%(327/758例),MP-RNA检测的阳性率为36.7%(278/758例),差异有统计学意义(χ2=6.60,P=0.01)。2种检测方法有613例(80.9%,613/758例)标本的检测结果是一致的,Kappa值为0.604。MP-DNA检测阳性的患儿,1周后复查,MP-DNA转阴率为36.1%(22/91例);MP-RNA检测为阳性的患儿复查,MP-RNA转阴率为70.1%(47/67例),差异有统计学意义(χ2=33.20,P<0.01)。
2018年北京地区MP阳性检出率依然处于较高水平。MP-DNA与MP-RNA检测方法的检测结果具有较好的一致性,但MP-RNA检测方法更适用于MP感染的早期诊断,可以监测MP转归及药物疗效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺炎支原体(MP)是引起儿童社区获得性肺炎的主要致病菌之一,占儿童肺炎住院患者的10%~30%[1,2,3]。除可引起轻微的呼吸道感染外,还可引起支气管炎、肺炎及心肌炎、脑膜炎、皮疹、关节炎等多种肺外并发症,严重者可导致死亡。各种年龄均可发病,儿童及青壮年易感[4,5]。每3~7年出现一次世界范围内的暴发流行,每次流行持续1~2年[6]。早期诊断对于治疗和抗生素的选择均至关重要。目前常用的检测方法有培养法、血清学检测方法和核酸检测法[7]。核酸检测法分DNA检测和RNA检测。本研究对2018年1月至12月首都儿科研究所附属儿童医院呼吸内科住院的肺炎患儿的呼吸道标本进行核酸检测,比较2种核酸检测方法在MP早期诊断及预后评估中的应用。
收集2018年1月至12月于首都儿科研究所附属儿童医院呼吸内科住院的肺炎患儿的标本,诊断标准参考《儿童肺炎支原体呼吸道感染实验室诊断中国专家共识》《中国儿童肺炎支原体感染实验室诊断规范和临床实践专家共识(2019年)》[8,9]。标本类型包括肺泡灌洗液、咽拭子、痰及胸腔积液。按年龄分为4组:<1岁组,1~2岁组,3~6岁组(学龄前组)及≥7岁组(学龄组)。1 994例呼吸道标本进行了MP-DNA检测,男1 100例,女894例,男女比例为1.23:1.00。年龄为1个月~16岁10个月,平均年龄5.08岁。1 624例呼吸道标本进行了MP-RNA检测,男893例,女731例,男女比例为1.22:1.00。年龄为1个月~16岁8个月,平均年龄4.98岁。其中,758例标本同时进行了MP-DNA与MP-RNA检测。本项目严格遵守《赫尔辛基宣言》,患儿数据均为匿名报道,通过首都儿科研究所医学伦理委员会批准免除知情同意(批准文号:SHERLL2013032)。
MP-DNA检测采用MP核酸及耐药突变位点检测试剂盒(荧光PCR法,江苏默乐生物科技股份有限公司),RNA检测采用MP核酸检测试剂盒(RNA恒温扩增,上海仁度生物科技有限公司)。Real-time荧光定量PCR仪(Applied Biosystems,美国)。
吸取400 μL呼吸道标本,10 000 r/min离心(离心半径=5.1 cm)2 min后弃上清,保留底部沉淀。于沉淀物中加入50 μL裂解液,振荡混匀,100 ℃温浴10 min。10 000 r/min离心(离心半径=5.1 cm)5 min,DNA用于下一步实验。PCR反应体系为缓冲液6.0 μL,引物、探针2.0 μL,酶(含有DNA聚合酶和尿嘧啶糖基化酶)0.5 μL,DNA模板5.0 μL,加水补充终体积至20.0 μL。PCR反应条件为50 ℃,2 min,95 ℃预变性2 min,之后91 ℃15 s,64 ℃1 min,40个循环。待检测样品6-羧基荧光素(FAM)荧光(A2063G或A2064G)Ct ≥ 35.33、VIC荧光(MP)Ct ≥ 35.01,显示UNDECT或无典型S型扩增曲线时,为阴性标本。待检测样品FAM荧光Ct ≥ 35.33、VIC荧光Ct<35.01,为MP阳性,未发生A2063G或A2064G耐药突变;FAM荧光Ct<35.33、VIC荧光Ct<35.01,为MP阳性,发生A2063G或/和A2064G耐药突变。
吸取400 μL待测样品,加入100 μL核酸提取液,60 ℃保温5 min后室温放置10 min。将样本处理管置于磁珠分离装置上,静置5 min,待磁珠吸附于管壁后吸干管中液体,加入洗涤液洗涤2次。将EP管移离磁珠分离装置,每管分别加入40 μL扩增检测液,振荡混匀,取30 μL至微量检测管中。60 ℃保温10 min,然后立即置于42 ℃,5 min,每管中加入已42 ℃预热的酶10 μL,振荡混匀后放入荧光检测仪器。反应条件为:42 ℃ 1 min,40个循环,荧光通道设定为F1(FAM)和F2(HEX或者VIC),荧光信号每分钟收集1次;从40~80 ℃,进行熔解曲线分析。结果分析:F1通道dt ≤ 35且熔解曲线在(64±5) ℃区间有吸收峰,F2通道有或无数值,标本判定为阳性;F1通道dt无数值或为40,F2通道dt ≤ 35,同时熔解曲线在(64±5) ℃区间有或无吸收峰,均为阴性;F1通道dt ≤ 35,但熔解曲线在(64±5) ℃区间无吸收峰,为阴性。
采用Excel 2019软件进行数据录入,核对无误后,所有资料采用SPSS 20.0软件进行分析,2组检出率的比较采用χ2检验,P<0.05为差异有统计学意义。
进行MP-DNA检测的1 994例呼吸道标本中,840例为MP阳性,阳性检出率为42.1%。10月份的阳性检出率最高,为59.4%(130/219例),见表1。其中96.0%(806/840例)的MP阳性标本存在大环内酯类耐药基因突变,突变位点为A2063G或A2064G。按性别分析,男童阳性检出率为38.3%(421/1 100例),女童阳性检出率为46.9%(419/894),差异有统计学意义(χ2=14.90,P<0.01)。按年龄分组,<1岁组阳性检出率为4.05%(7/173例),1~2岁组阳性检出率为17.3%(76/440例),3~6岁组阳性检出率为48.9%(391/800例),≥7岁组阳性检出率为63.0%(366/581),学龄前及学龄组儿童MP-DNA阳性检出率明显高于婴幼儿组,差异有统计学意义(χ2=296.70,P<0.05)。按标本类型分析,肺泡灌洗液的阳性检出率为47.7%(606/1 271例),咽拭子的阳性检出率为34.7%(220/634例),痰的阳性检出率为16.0%(13/81例),胸腔积液的阳性检出率为12.5%(1/8例),肺泡灌洗液检测的MP-DNA阳性率明显高于其他组,差异有统计学意义(χ2=44.30,P<0.05)。
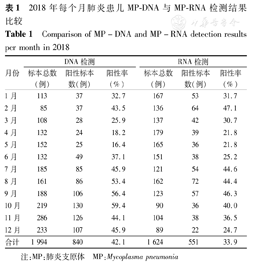
2018年每个月肺炎患儿MP-DNA与MP-RNA检测结果比较
Comparison of MP-DNA and MP-RNA detection results per month in 2018
2018年每个月肺炎患儿MP-DNA与MP-RNA检测结果比较
Comparison of MP-DNA and MP-RNA detection results per month in 2018
| 月份 | DNA检测 | RNA检测 | ||||
|---|---|---|---|---|---|---|
| 标本总数(例) | 阳性标本数(例) | 阳性率(%) | 标本总数(例) | 阳性标本数(例) | 阳性率(%) | |
| 1月 | 113 | 37 | 32.7 | 167 | 53 | 31.7 |
| 2月 | 85 | 37 | 43.5 | 136 | 64 | 47.1 |
| 3月 | 108 | 28 | 25.9 | 137 | 42 | 30.7 |
| 4月 | 132 | 24 | 18.2 | 179 | 39 | 21.8 |
| 5月 | 152 | 25 | 16.4 | 165 | 36 | 21.8 |
| 6月 | 132 | 49 | 37.1 | 151 | 38 | 25.2 |
| 7月 | 185 | 85 | 45.9 | 121 | 54 | 44.6 |
| 8月 | 161 | 86 | 53.4 | 162 | 72 | 44.4 |
| 9月 | 188 | 106 | 56.4 | 123 | 57 | 46.3 |
| 10月 | 219 | 130 | 59.4 | 90 | 36 | 40.0 |
| 11月 | 286 | 126 | 44.1 | 104 | 38 | 36.5 |
| 12月 | 233 | 107 | 45.9 | 89 | 22 | 24.7 |
| 合计 | 1 994 | 840 | 42.1 | 1 624 | 551 | 33.9 |
注:MP:肺炎支原体 MP:Mycoplasma pneumonia
进行MP-RNA检测的1 624例呼吸道标本中,551例为MP阳性,阳性检出率为33.9%。2月份的阳性率最高,为47.1%(64/136例),见表1。按性别分析,男童阳性检出率为32.3%(288/893例),女童阳性检出率为36.0%(263/731例),差异无统计学意义(χ2=2.49,P=0.114)。按年龄分组,<1岁组阳性检出率为10.8%(17/157例),1~2岁组阳性检出率为18.8%(72/382例),3~6岁组阳性检出率为37.4% (235/629例),≥7岁组阳性检出率为49.8%(227/456例),学龄前及学龄组儿童MP-RNA阳性检出率明显高于婴幼儿组,差异有统计学意义(χ2=109.20,P<0.05)。按标本类型分析,肺泡灌洗液的阳性检出率为36.4%(367/1 008例),咽拭子的阳性检出率为31.7%(151/476例),痰的阳性检出率为23.9%(32/134例),胸腔积液的阳性检出率为16.7%(1/6例),肺泡灌洗液检测的阳性检出率明显高于痰及胸腔积液,差异有统计学意义(χ2=7.29,P<0.05)。
758例标本同时进行了MP-DNA与MP-RNA检测,MP-DNA检测的阳性率为43.1%(327/758例),MP-RNA检测的阳性率为36.7%(278/758例),差异有统计学意义(χ2=6.60,P=0.01)。613例(80.9%,613/758例)标本2种检测方法结果是一致的,其中230例(30.3%,230/758例)标本的检测结果均为阳性,383例(50.5%,383/758例)标本的检测结果均为阴性,Kappa值为0.604,2种检测方法的检测结果一致性较好。145例(19.1%,145/758例)标本检测结果不一致,其中MP-DNA检测为阳性而MP-RNA检测为阴性的标本97例(12.8%,97/758例),MP-RNA检测为阳性而MP-DNA检测为阴性的标本48例(6.33%,48/758例)。
MP-DNA检测为阳性的840例标本中,91例于1周后复查MP-DNA,其中22例检测为阴性,转阴率为36.1%(22/91例);MP-RNA检测为阳性的551例标本中,67例患儿于1周后复查MP-RNA,其中47例检测为阴性,转阴率为70.1%(47/67例),与DNA检测结果比较差异有统计学意义(χ2=33.20,P<0.01)。其中33例患儿同时进行了DNA与RNA检测,其中MP-DNA的转阴率为27.3%(9/33例),MP-RNA的转阴率为66.7%(22/33例)。
近年来,关于大环内酯类耐药的MP及重症MP肺炎的报道逐渐增多,MP感染引起了越来越多学者的重视[10,11]。因此,及时准确的诊断具有重要意义。本研究发现,2018年MP的阳性检出率>30%,最高达59.4%,除春季外,MP的阳性检出率均处于一个较高水平。学龄前及学龄期儿童阳性检出率明显高于婴幼儿,女童高于男童,与学龄前及学龄期儿童的聚集性有关。肺泡灌洗液的MP阳性检出率较高,因此肺泡灌洗液是优选的标本类型。
常用的MP实验室检测方法有培养法、血清学检测及分子检测方法。各种检测方法各有自己的优点及缺点[12,13,14]。培养法是MP诊断的金标准,但MP生长缓慢,生长条件苛刻,阳性率低;血清学检测需要采集急性期和恢复期,间隔2周的双份血清标本,操作复杂且特异性较差。因此,限制了2种方法在MP早期诊断及临床用药中的应用。核酸扩增技术于1980年最早应用于MP的临床检测,核酸检测方法诊断准确性高、简单快速、易于操作,在MP实验室诊断中应用广泛[15]。核酸检测方法包括DNA检测及RNA检测。最常用的DNA检测方法是针对MP主要黏附相关基因p1基因的实时荧光定量PCR法[16]。
核酸恒温扩增检测技术(SAT技术)将核酸恒温扩增技术与实时荧光检测技术相结合,利用特异的核糖体RNA扩增引物及优化探针,在反转录酶M-MLV和T7 RNA多聚酶的共同作用下扩增RNA。与DNA方法比较,MP-SAT检测靶标为RNA,扩增起始模板数量高,灵敏度更高;扩增产物为RNA,产物易降解,减少实验室污染风险,进一步降低假阳性风险;磁珠法进行核酸提取,特异性磁珠捕获可以最大限度去除杂质,减少抑制物,提高特异性;用分子信标进行检测,提高特异性;MP-SAT每次反应的产物量可以达到102~103,降低实验室设备要求,仪器损耗小,且可以缩短检测时间[17]。
本研究结果显示,MP-DNA检测方法的阳性率高于MP-RNA检测的阳性率,但2种检测方法具有较好的一致性(Kappa值为0.604)。此外,97例标本MP-DNA检测结果为阳性,而MP-RNA检测结果为阴性的,是由于患儿处于MP肺炎的恢复期,MP死亡后RNA可以很快降解,而DNA还会存在一段时间,最长可达7个月[18,19,20]。MP-RNA检测为阳性而DNA检测为阴性的标本48例,是由于2种方法的模板提取方法不同,DNA检测中模板提取采用粗提法,模板浓度相对较低,且有杂质存在,而RNA检测的模板量每个菌可以高达103拷贝,RNA检测方法具有更高的灵敏度103 CFU/L[17,21]。由此可见,MP-RNA检测可以区分MP存活状态,避免因菌体死亡后DNA持续存在导致的假阳性,可极大地缩短检测窗口期,更适用于MP感染的早期诊断,并用于区分近期感染与既往感染。对于MP检测阳性的标本,1周后进行复查可见MP-RNA检测方法的转阴率明显高于MP-DNA检测方法。由此可见,MP-RNA检测方法更适合用来评价MP肺炎的转归,并可以作为判断治疗效果的指标[22]。
综上所述,2018年北京地区MP阳性检出率依然处于较高水平。MP-DNA与MP-RNA检测方法的检测结果具有较好的一致性,但MP-RNA检测方法更适用于MP感染的早期诊断,可以评价MP感染转归及疗效。
所有作者均声明不存在利益冲突



























