
分析肺炎支原体(MP)感染致塑型性支气管炎(PB)的临床特征,并探讨其危险因素。
回顾性分析2011年1月至2017年12月在苏州大学附属儿童医院呼吸科住院经支气管镜确诊的有塑型形成的MP肺炎(MPP)患儿的临床及实验室资料,并与同期无塑型形成的MPP患儿进行比较,同时采用Logistic回归分析探寻MP感染致PB的危险因素。
306例MPP患儿中PB组50例,非PB组256例。PB组患儿年龄[(82.74±35.17)个月比( 66.63±35.67)个月]、中性粒细胞比例(N)(0.705 8±0.139 1比0.605 7±0.162 6)、C反应蛋白(CRP)[17.40(10.21,42.86) mg/L比11.43(4.55,23.66) mg/L]、D-二聚体(DD)[1 071(279.5,2 386.5) μg/L比523(233.0,1 099.5) μg/L]、乳酸脱氢酶(LDH)[491.1(342.3,607.4) U/L比394.9(319.1,512.8) U/L]、红细胞沉降率(ESR)[25.0(17.0,36.0) mm/1 h比15.5(9.0,28.0)mm/1 h]、天冬氨酸转氨酶(AST)[33.5(26.1,49.3) U/L比29.2(24.0,37.2) U/L]、丙氨酸转氨酶(ALT)[19.1(11.45,31.50) U/L比13.6(10.30,23.15) U/L]、IgA[1.46(0.98,2.12) mg/L比1.15(0.64,1.60) mg/L]、CD3-CD(16+56)+ (0.155 0±0.088 6比0.120 2±0.071 5)、过敏史[44.0%(22/50例)比25.8%(65/256例)]、混合感染[38.0%(19/50例)比24.6%(63/256例)]、镜下黏膜糜烂[10.0%(5/50例)比2.3%(6/256例)]等方面均高于非PB组,差异均有统计学意义(均P<0.05)。Logistic回归分析显示过敏史(OR=5.604,95%CI:1.937~16.216)、年龄(OR=3.142,95%CI:1.425~6.929)、N(OR=2.387,95%CI:1.088~5.238)、CRP(OR=3.959,95%CI:1.072~14.662)、DD(OR=7.824,95%CI:2.824~21.673)是MP感染致PB的独立危险因素(均P<0.05),其中年龄、N、CRP、DD的临界值分别为64个月、0.70、35 mg/L、2 000 μg/L。
MP感染后发生PB往往见于年龄较大、有过敏体质的儿童,存在更强的炎症反应、免疫紊乱及高凝状态。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
塑型性支气管炎(plastic bronchitis,PB)是一种罕见的临床症状较重的肺部疾病,其内生性异物可局部或广泛性阻塞支气管,导致肺部分或全部通气功能障碍,因其气管支气管内生性厚而黏的肺支气管树样管型而命名[1,2],易堵塞气道而致通气和换气功能障碍,严重者引起呼吸功能不全。如不早期诊断、及时去除堵塞气道的塑型性物质,则会危及患儿生命。近年来,随着支气管镜技术的应用,报道PB的病例有增多趋势,据相关文献报道,肺炎支原体(Mycoplasma pneumoniae,MP)感染在PB中也有重要地位。为提高临床医师对MP感染所致PB的认识,本研究回顾性分析2011年1月至2017年12月在苏州大学附属儿童医院呼吸科住院经支气管镜确诊的镜下有树枝样塑型形成的MP肺炎(MPP)患儿的临床资料,并与同期无塑型形成的MPP患儿进行比较,探讨MP所致塑型性支气管炎的临床特点及危险因素。
选取2011年1月至2017年12月在苏州大学附属儿童医院呼吸科住院,确诊MPP并行支气管镜辅助灌洗治疗的患儿作为研究对象,根据支气管镜下是否有塑型分为塑型组与非塑型组。入选标准:(1)符合肺炎诊断[3],有呼吸道症状伴或不伴发热,胸部影像学显示大片肺实变或肺不张(占据1个或以上肺段范围)。(2)符合MP感染标准[4],即外周血MP-免疫球蛋白(Ig)M阳性和鼻咽深部抽吸物或支气管肺泡灌洗液(BALF)MP-DNA经荧光实时定量PCR(FQ-PCR)测定>108 copies/L。(3)符合行支气管镜检查和辅助治疗标准[5]:患儿经抗感染抗炎治疗1周后,仍有反复发热、症状未改善和/或影像学未见明显好转者及患儿病程中出现气促、呼吸困难等临床表现,怀疑存在气管内阻塞者,经监护人同意后,行支气管镜检查和灌洗治疗。经支气管镜辅助治疗后,明确塑型组及非塑型组患儿分别为50例、256例。本研究通过苏州大学附属儿童医院医学伦理委员会批准(批准文号:2016LW007),且患儿监护人均知情同意,并签署知情同意书。
包括:患儿年龄、性别、临床症状及体征、喘息史、过敏性家族史(包括家属哮喘、过敏性鼻炎/鼻窦炎等)、过敏史(包括吸入或食物过敏、血过敏原阳性、变应性皮炎、湿疹等)、影像学、主要实验室检查结果,如白细胞(WBC)、中性粒细胞比例(N)、C反应蛋白(CRP)、乳酸脱氢酶(LDH)、纤维蛋白原(FIB)、D-二聚体(DD)、红细胞沉降率(ESR)、天冬氨酸转氨酶(AST)、丙氨酸转氨酸(ALT)、淋巴细胞亚群、IgA、IgG、IgM及病原学检查。
所有患儿入院后使用抗生素前空腹抽取静脉血3~4 mL,行血常规、CRP、MP抗体、免疫功能、肝功能、ESR等检测;支气管镜检查时在病变部位用9 g/L盐水进行灌洗(体质量≤20 kg者每次灌洗量1 mL/kg,体质量>20 kg者每次灌洗量2 mL/kg),以负压13.3~20.0 kPa(100~150 mmHg)进行抽吸以获取BALF 2 mL,用于呼吸道病毒、BALF细菌培养、MP-DNA等检测。
(1)病毒检测:直接免疫荧光法检测7种常见呼吸道病毒:呼吸道合胞病毒,流感病毒A、B型,副流感病毒Ⅰ、Ⅱ、Ⅲ型,腺病毒。试剂购自美国Chemicon公司,按说明书操作。采用FQ-PCR法检测人类博卡病毒(HBoV),采用反转录PCR(RT-PCR)法检测人类偏肺病毒(hMPV)、人鼻病毒(HRV),以上试剂盒均由中山大学达安基因股份有限公司提供,具体操作严格按照说明书进行。(2)BALF细菌培养与鉴定:将痰标本制成悬液,接种于血平板和添加了万古霉素的巧克力平板,纯培养结果或优势菌生长判定为阳性。(3)MP抗体检测:采用酶联免疫吸附试验(ELISA)法检测血清中MP抗体IgG、IgM。(4)MP-DNA定量检测:采用FQ-PCR法检测MP-DNA,应用PE5700型基因检测系统进行PCR扩增及数据处理。
数据分析采用SPSS 19.0软件包。计数资料以百分比或率表示,组间比较采用χ2检验。计量资料符合正态分布的以 ±s表示,两两比较采用t检验,不符合正态分布的计量资料采用M(P25,P75)表示,两两比较采用秩和检验。将差异有意义的相关独立变量进一步行多因素Logistic回归分析,得到形成塑型的独立危险因素,绘制受试者工作特征曲线(ROC),取ROC曲线临界值为节点,取得各危险因素的临界值,P<0.05为差异有统计学意义。
±s表示,两两比较采用t检验,不符合正态分布的计量资料采用M(P25,P75)表示,两两比较采用秩和检验。将差异有意义的相关独立变量进一步行多因素Logistic回归分析,得到形成塑型的独立危险因素,绘制受试者工作特征曲线(ROC),取ROC曲线临界值为节点,取得各危险因素的临界值,P<0.05为差异有统计学意义。
符合入选标准的患儿共306例,根据病程中支气管镜镜下表现,将患儿分为塑型组及非塑型组,2组分别为50例和256例,男/女分别为0.79∶1.00、1.18∶1.00,差异无统计学意义(χ2=2.054,P=0.358)。年龄分别为(82.74±35.17)个月、(66.63±35.67)个月(t=-2.948,P<0.01),与非塑型组相比,塑型组年龄更大。
2组患儿病程中均有咳嗽、咳痰等呼吸道症状,均以"肺炎"为入院诊断,塑型组在病程中有发热、行支气管镜前病程≥10 d、镜前热程≥10 d均高于非塑型组(表1),且病程中有发热、镜前热程≥10 d的差异有统计学意义(P<0.05)。塑型组患儿存在气促、呼吸困难,诊断呼吸衰竭者,考虑与树枝样痰栓堵塞支气管、造成肺不张/实变影响通气有关(图1、图2)。

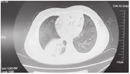
非塑型组与塑型组支气管炎患儿临床表现比较 [例(%)]
Comparison of clinical manifestations of children with bronchitis in the non-plastic group and the plastic group [case(%)]
非塑型组与塑型组支气管炎患儿临床表现比较 [例(%)]
Comparison of clinical manifestations of children with bronchitis in the non-plastic group and the plastic group [case(%)]
| 组别 | 例数 | 发热 | 镜前病程≥10 d | 镜前热程≥10 d |
|---|---|---|---|---|
| 非塑型组 | 256 | 224(87.50) | 167(63.20) | 60(23.40) |
| 塑型组 | 50 | 50(100.00) | 29(58.00) | 19(38.00) |
| χ2值 | 6.980 | 0.951 | 4.632 | |
| P值 | 0.008 | 0.330 | 0.031 |



1例7岁女性患儿,入院前后予阿奇霉素联合头孢类抗生素抗感染、糖皮质激素抗炎治疗12 d后,仍有反复发热、复查影像学检查提示炎症吸收不明显,行支气管镜辅助治疗,镜下见塑型,在抗感染同时予2次灌洗治疗,体温正常,复查胸片较前改善。
塑型组和非塑型组患儿既往喘息、过敏史及过敏体质家族史比较,其中过敏史发生率塑型组高于非塑型组,差异有统计学意义(表2)。
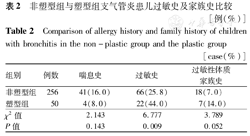
非塑型组与塑型组支气管炎患儿过敏史及家族史比较 [例(%)]
Comparison of allergy history and family history of children with bronchitis in the non-plastic group and the plastic group [case(%)]
非塑型组与塑型组支气管炎患儿过敏史及家族史比较 [例(%)]
Comparison of allergy history and family history of children with bronchitis in the non-plastic group and the plastic group [case(%)]
| 组别 | 例数 | 喘息史 | 过敏史 | 过敏性体质家族史 |
|---|---|---|---|---|
| 非塑型组 | 256 | 41(16.0) | 66(25.8) | 18(7.0) |
| 塑型组 | 50 | 4(8.0) | 22(44.0) | 7(14.0) |
| χ2值 | 2.143 | 6.777 | 3.789 | |
| P值 | 0.143 | 0.009 | 0.052 |
塑型组WBC、N、CRP、DD、LDH、ESR水平均高于非塑型组,差异均有统计学意义,塑型组肝功能指标AST、ALT均高于非塑型组(均P<0.05)。嗜酸性粒细胞、心肌酶谱、FIB在2组未见明显异常。塑型组和非塑型组淋巴细胞亚群中CD3-CD(16+56)+的水平差异有统计学意义。塑型组体液免疫中IgA、IgG、IgM水平高于非塑型组,其中IgA、IgG比较差异有统计学意义(表3)。
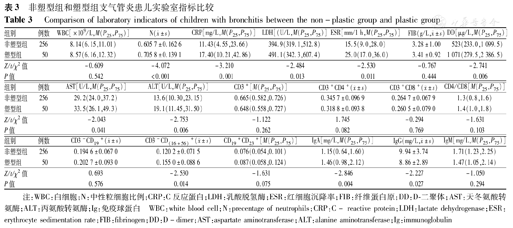
非塑型组和塑型组支气管炎患儿实验室指标比较
Comparison of laboratory indicators of children with bronchitis between the non-plastic group and plastic group
非塑型组和塑型组支气管炎患儿实验室指标比较
Comparison of laboratory indicators of children with bronchitis between the non-plastic group and plastic group
| 组别 | 例数 | WBC[×109/L,M(P25,P75)] | N( ±s) ±s) | CRP[mg/L,M(P25,P75)] | LDH[(U/L,M(P25,P75)] | ESR[mm/1 h,M(P25,P75)] | FIB(g/L, ±s) ±s) | DD[μg/L,M(P25,P75)] |
|---|---|---|---|---|---|---|---|---|
| 非塑型组 | 256 | 8.14(6.15,11.01) | 0.605 7±0.162 6 | 11.43(4.55,23.66) | 394.9(319.1,512.8) | 15.5(9.0,28.0) | 3.28±1.00 | 523(233.0,1 099.5) |
| 塑型组 | 50 | 8.57(6.16,12.32) | 0.705 8±0.139 1 | 17.40(10.21,42.86) | 491.1(342.3,607.4) | 25.0(17.0,36.0) | 3.41±0.92 | 1 071(279.5,2 386.5) |
| Z/t/χ2值 | -0.609 | -4.072 | -3.210 | -2.484 | -2.530 | -0.767 | -2.741 | |
| P值 | 0.542 | <0.001 | 0.001 | 0.013 | 0.011 | 0.444 | 0.006 |
| 组别 | 例数 | AST[U/L,M(P25,P75)] | ALT[U/L,M(P25,P75)] | CD3+[M(P25,P75)] | CD3+CD4+( ±s) ±s) | CD3+CD8+( ±s) ±s) | CD4/CD8[M(P25,P75)] |
|---|---|---|---|---|---|---|---|
| 非塑型组 | 256 | 29.2(24.0,37.2) | 13.6(10.30,23.15) | 0.665(0.582,0.726) | 0.345 7±0.096 9 | 0.264 7±0.067 9 | 1.3(0.8,1.6) |
| 塑型组 | 50 | 33.5(26.1,49.3) | 19.1(11.45,31.50) | 0.648(0.558,0.727) | 0.318 8±0.093 8 | 0.260 5±0.079 0 | 1.4(1.0,1.8) |
| Z/t/χ2值 | -2.043 | -2.753 | -1.122 | 1.745 | -0.294 | -1.631 | |
| P值 | 0.041 | 0.006 | 0.262 | 0.082 | 0.769 | 0.103 |
| 组别 | 例数 | CD3-CD19+ ( ±s) ±s) | CD3-CD(16+56)+ ( ±s) ±s) | CD19+CD23+ [M(P25,P75)] | IgA[mg/L,M(P25,P75)] | IgG(mg/L, ±s) ±s) | IgM[mg/L,M(P25,P75)] |
|---|---|---|---|---|---|---|---|
| 非塑型组 | 256 | 0.194 6±0.067 0 | 0.120 2±0.071 5 | 0.076(0.054,0.101) | 1.15(0.64,1.60) | 9.94±3.74 | 1.71(1.23,2.25) |
| 塑型组 | 50 | 0.202 7±0.093 0 | 0.155 0±0.088 6 | 0.087(0.058,0.124) | 1.46(0.98,2.12) | 8.86±2.89 | 1.47(1.05,2.14) |
| Z/t/χ2值 | 0.693 | -2.530 | -1.631 | -2.846 | -2.227 | -1.050 | |
| P值 | 0.576 | 0.014 | 0.075 | 0.004 | 0.027 | 0.294 |
注:WBC:白细胞;N:中性粒细胞比例;CRP:C反应蛋白;LDH:乳酸脱氢酶;ESR:红细胞沉降率;FIB:纤维蛋白原;DD:D-二聚体;AST:天冬氨酸转氨酶;ALT:丙氨酸转氨酶;Ig:免疫球蛋白 WBC:white blood cell;N:precentage of neutrophils;CRP:C- reactive protein;LDH:lactate dehydrogenase;ESR:erythrocyte sedimentation rate;FIB:fibrinogen;DD:D-dimer;AST:aspartate aminotransferase;ALT:alanine aminotransferase;Ig:immunoglobulin
塑型组混合感染率高于非塑型组[38.0%(19/50例)比24.6%(63/256例)],混合感染中比例最高的为肺炎链球菌[22例(8.6%)比4例(8.0%)],塑型组、非塑型组混合多种病原菌(≥2种)分别为10.0%(5/50例)比4.3%(11/256例),差异均无统计学意义(均P>0.05)。
2组患儿的X线片或胸部CT均提示有大叶性病变,病变分布中塑型组以左下肺最常见(12例,24.0%),非塑型组以右上肺最常见(55例,21.5%),其中塑型组累及双侧者高于非塑型组[4例(8.0%)比20例(7.8%),P=0.883],2组患儿影像学病变分布差异无统计学意义,塑型组合并胸腔积液者高于非塑型组[16例(32.0%)比49例(19.1%),χ2=4.844、P=0.028]。合并肺不张者2组间差异无统计学意义[4例(8.0%)比20例(7.8%),χ2=7.075、P=0.883]。
2组患儿镜下均可见黏膜充血、黏膜水肿,塑型组患儿纤维支气管镜下均可见痰栓堵塞呼吸道(图3),堵塞部位以左下肺多见,与肺部影像学炎症多发部位一致。塑型组有更高比例的黏膜坏死[5例(10.0%)比6例(2.3%),χ2=7.075、P=0.008]。


2组患儿均予大环内酯类抗生素抗感染、糖皮质激素抗炎治疗,治疗1周后仍有反复发热、症状未改善和/或影像学未见明显好转者及患儿病程中出现气促、呼吸困难等临床表现者,行支气管镜辅助治疗,塑型组患儿需多次(≥2次)行支气管镜辅助治疗的比例明显高于非塑型组[32(64%)比46(18%),χ2=46.667、P<0.005],其中有7例患儿行≥4次支气管镜辅助治疗。
将2组数据差异有统计学意义(P<0.05)的因素包括年龄、镜前热程≥10 d、胸腔积液、N、CRP、DD、LDH、ESR、IgA、IgG、CD3-CD(16+56)+、过敏史等行多因素Logistic回归分析,结果有5个变量纳入最佳回归方程,各因素的偏回归系数β、P值、OR值、95%可信区间(CI)见表4。
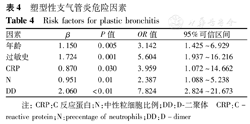
塑型性支气管炎危险因素
Risk factors for plastic bronchitis
塑型性支气管炎危险因素
Risk factors for plastic bronchitis
| 因素 | β | P值 | OR值 | 95%可信区间 |
|---|---|---|---|---|
| 年龄 | 1.150 | 0.005 | 3.142 | 1.425~6.929 |
| 过敏史 | 1.724 | 0.001 | 5.604 | 1.937~16.216 |
| CRP | 0.870 | 0.030 | 3.959 | 1.072~14.662 |
| N | 0.951 | 0.01 | 2.387 | 1.088~5.238 |
| DD | 2.060 | <0.01 | 7.824 | 2.824~21.673 |
注:CRP:C反应蛋白;N:中性粒细胞比例;DD:D-二聚体 CRP:C- reactive protein;N:precentage of neutrophils;DD:D-dimer
对危险因素绘制ROC曲线(图4),取得各组数据的预测值,得到各临界值分别为年龄>64个月、N>0.70、CRP>35 mg/L、DD>2 000 μg/L(表5)。
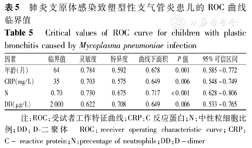
肺炎支原体感染致塑型性支气管炎患儿的ROC曲线临界值
Critical values of ROC curve for children with plastic bronchitis caused by Mycoplasma pneumoniae infection
肺炎支原体感染致塑型性支气管炎患儿的ROC曲线临界值
Critical values of ROC curve for children with plastic bronchitis caused by Mycoplasma pneumoniae infection
| 因素 | 临界值 | 灵敏度 | 特异度 | 曲线下面积 | P值 | 95%可信区间 |
|---|---|---|---|---|---|---|
| 年龄(月) | 64 | 0.784 | 0.592 | 0.678 | 0.001 | 0.585~0.772 |
| CRP(mg/L) | 35 | 0.703 | 0.575 | 0.649 | 0.006 | 0.548~0.749 |
| N | 0.70 | 0.730 | 0.675 | 0.717 | <0.001 | 0.628~0.806 |
| DD(μg/L) | 2 000 | 0.622 | 0.708 | 0.649 | 0.006 | 0.533-0.765 |
注:ROC:受试者工作特征曲线;CRP:C反应蛋白;N:中性粒细胞比例;DD:D-二聚体 ROC:receiver operating characteristic curve;CRP:C- reactive protein;N:precentage of neutrophils;DD:D-dimer


注:ROC:受试者工作特征曲线 ROC:receiver operating characteristic curve
关于PB的记载最早来自Galen,以气管内形成支气管树样塑型为特征,可导致支气管堵塞、通气障碍,预后不良。近年来对其病因、发病机制、诊治、预后等方面的讨论颇多。由于MP具有直接侵袭及免疫损伤两方面致病机制,其导致的重症、难治及坏死性肺炎的报道越来越多,MP引起PB也屡见报道[6],越来越受到人们的关注。若不能及早识别、及时经支气管镜取出,会导致治疗难度增加、病情加重、通气障碍、呼吸衰竭,留下严重后遗症甚至死亡等。本研究回顾性分析MP感染后形成塑型的临床资料,并进一步分析形成塑型的危险因素,以提高对MP所致PB的认识。
文献报道,PB多与腺病毒、流感病毒、MP等病原菌感染有关[7,8,9],感染及感染后免疫炎性反应可引起大量多形核中性粒细胞聚集、降解,形成高黏滞性物质,同时嗜酸性粒细胞的聚集、支气管上皮细胞的脱落、感染破坏支气管黏膜纤毛清除功能、肺部异常淋巴漏出[2,10,11]等多方面因素共同促进塑型的形成,支气管镜是诊断和治疗PB的首选方法[12]。镜下可见黏膜充血、黏膜水肿,管腔内分泌物增多,塑型组可见痰栓堵塞呼吸道,且塑型组有更高比例的黏膜坏死,提示强烈的炎症反应。有部分患儿甚至有塑型反复生成的情况,需多次支气管镜辅助治疗。在本研究中塑型组需多次支气管镜辅助治疗的比例明显较高,其中有7例患儿需>4次的支气管镜辅助治疗,故早期识别并实施支气管镜辅助治疗对后续治疗及预后有积极意义。
本研究共纳入306例患儿,其中塑型组50例、非塑型组256例,男/女分别为0.79∶1.00、1.18∶1.00,塑型组女性比例稍高于非塑型组,但差异无统计学意义,性别暂不考虑为PB发生的影响因素。在2组患儿中,塑型组患儿年龄大于非塑型组[(82.74±35.17)个月比(66.63±35.67)个月],且年龄>64个月是PB形成的独立危险因素,考虑与年龄较长儿童免疫系统更完善,在感染后有更强烈的免疫炎症反应有关。
MP作为一种病原体,其毒力不比细菌、病毒,但其引起的炎症反应却远远强于二者。本研究塑型组支气管镜前热程明显长于非塑型组,提示免疫性发热在PB的发生、发展中的作用。塑型组胸腔积液发生率高于非塑型组,与国内外数据一致[10]。胸腔积液是胸膜炎症反应的表现[13],可能是PB发生的一个危险信号。CRP作为炎症急性期的敏感指标,有助于识别重症MPP,本研究中CRP>35 mg/L是形成塑型的独立危险因素,与既往关于塑型的形成相一致。在本研究中,N>0.70亦是形成PB的独立危险因素,考虑N的升高与机体感染MP后,可通过Toll样受体(TLR)识别MP的脂质相关膜蛋白(lipid-associated membrane proteins,LAMPs)可激活中性粒细胞有关。N与CRP的升高共同反映了免疫炎症反应。强烈的气管黏膜的炎症反应促进塑型的形成[14]。既往研究结果表明MP感染后其体液与细胞免疫功能均会发生明显变化[15,16],在本研究中塑型组的IgA、IgG、CD3-CD(16+56)+均高于非塑型组。提示塑型组存在更强的体液免疫反应,与塑型的形成有关。
Bao等[17]的研究支持过敏性体质增加了MP感染致难治性MPP(RMPP)的风险。Bakshi等[18]通过对T淋巴细胞缺乏的哮喘小鼠模型实验发现,由于干扰素(IFN)的缺乏及白细胞介素(IL)-4对MP清除的失利会造成MP在呼吸道的高载量,进而与RMPP的发生有关。提示借由细胞因子的作用,过敏因素对RMPP的发生可能起到促进作用。在本研究中塑型组患儿过敏史的比例高于非塑型组,为塑型组的独立危险因素,这与Schumacher等[19]关于PB患儿患过敏性疾病的研究相一致。Racz等[20]对PB患者的塑型通过免疫荧光共聚焦显微镜等技术对其蛋白质、免疫表型等进一步分析,证实了其中炎症因子的存在,为过敏与PB之间可能的关联提供了线索。过敏的存在可能一方面增强了MP的严重程度进而推动了塑型的形成,另一方面可能直接影响了PB的形成,但具体机制仍需探讨。
DD是体内高凝状态和纤溶亢进的分子标志物之一[21],与血管内皮损伤有关。本研究DD>2 000 μg/L在2组数据中有明显差异,且为塑型形成的独立危险因素,提示MP感染可能引起肺部毛细血管网损伤,这与Singhi等[22]猜想PB中塑型的形成一致。
MP感染形成塑型后易出现呼吸困难、呼吸衰竭,这与PB患儿支气管内塑型存在,阻塞气道有关,与既往关于PB的报道一致,但MP较其他细菌、病毒感染引起的比例相对较低。考虑与气道内阻塞位置高低、支气管塑型大小不同等有关。有研究指出在不同病原菌所致PB中,MP感染所致的塑型较小,且位于主气管处较少,因此急性呼吸窘迫等症状较少,故MP所致PB中肺不张也并非绝对表现。因此,对于MP感染所致PB患儿,其临床表现可能不典型,易被忽略,在临床工作中更应提高警惕。在本研究中,塑型组的混合感染率高于非塑型,与国内关于混合感染在塑型形成中有促进作用一致,但本研究塑型组混合病原菌与既往研究[14]不同,考虑与不同地域不同病原菌分布有关。进一步证明免疫炎症反应在MP致PB中有重要地位。
综上所述,年龄>64个月、CRP>35 mg/L、N>0.70、DD>2 000 μg/L、过敏史是MP感染致PB的危险因素,提示发生PB患儿往往存在更强的炎症反应、免疫紊乱及更明显的高凝状态,其中存在过敏史的儿童需多加重视。建议在抗感染、抗炎症反应、改善高凝状态治疗同时积极行纤维支气管镜灌洗术辅助治疗,清除呼吸道分泌物,通畅呼吸道,减少并发症、后遗症的发生,改善患儿预后。本研究仍有不足之处,缺乏对塑型的病理分析,且为单中心、回顾性研究,数据选择上可能存在偏倚。MP感染引起PB作为一种少见、危重的疾病,有待进一步探讨其发病机制和干预措施,并进行随访。
所有作者均声明不存在利益冲突



























