
研究苏州地区肺炎支原体(MP)耐药情况,并试图说明MP耐药与难治性肺炎支原体肺炎(RMPP)之间的关系。
选取2013年10月至2014年9月在苏州大学附属儿童医院呼吸科确诊MPP而住院治疗的82例患儿,其中48例应用阿奇霉素治疗(10 mg/kg,1次/d,静脉滴注5~7 d),临床症状及胸部影像学仍持续进展,临床确诊为RMPP的患儿(RMPP组)作为试验组,另外34例应用大环内酯类抗生素(MA)治疗有效,确诊为普通肺炎支原体肺炎(GMPP)(GMPP组),从这些患儿气道分泌物中提取MP DNA,并对红霉素作用靶位MP 23S rRNA的2063和2064位点突变进行测序,并根据耐药基因测序结果将其分为MA耐药组(MRMP组)及MA敏感组(MSMP组)。比较2组患儿临床特点。
在MRMP组中,PMPP发生率为62.2%(46/74例),而MSMP组中,PMPP发生率为25.0%(2/8例),2组患儿耐药基因MP 23S rRNA点突变对RMPP的发生无显著影响(χ2=2.719,P=0.099)。相对于MRMP组,MSMP组患儿发热时间更短,糖皮质激素的应用更少。2组患儿在胸部影像学检查以及一些化验结果,如白细胞总数及分类、C反应蛋白(CRP)、丙氨酸转氨酶(ALT)、乳酸脱氢酶(LDH)和肌酸激酶同工酶(CK-MB)等方面差异均无统计学意义。
MP肺炎发热持续超过1周,提示MP耐药的可能,MP对MA耐药并未加剧RMPP的发生。通过胸部影像学特征及检验结果方面的差异来判断MP是否耐药并不可靠。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺炎支原体肺炎(MPP)目前已经是社区获得性肺炎的重要组成部分[1],在儿童社区获得性肺炎的占比约为40%,且呈逐年增加趋势。随着临床MPP病例的逐渐增多,关于难治性MPP(RMPP)的相关研究也越来越多,偶有MP感染致患儿死亡的病例报道[2]。尽管临床工作者已对此现象越发重视,但对RMPP发病机制的认识尚不明确。部分研究认为MPP的病情严重程度可能与感染MP的数量及宿主免疫反应等有关[3],而有些研究认为MP对大环内酯类抗生素(MA)耐药可使病情恶化,也是RMPP的主要发病机制之一[4]。
一般MP经MA抗感染治疗5~7 d,患儿体温下降,肺部炎症吸收,临床好转,诊断为普通MPP(GMPP),而RMPP患儿给予以上治疗后,仍会发热,X线检查提示肺部病变持续进展。目前普遍观点认为MP对MA耐药的主要分子基础是MP核糖体的23S rRNA的2063和2064等作用靶位的点突变[5]。本研究将RMPP患儿鼻咽吸出物/支气管肺泡灌洗液(NPA/BALF)中的MP DNA的23S rRNA基因片段进行测序,并将该结果与MP标准株作比对分析,以此研究苏州地区的MP耐药基因突变与RMPP的发病及临床表现之间的关系。
选取2013年10月至2014年9月在苏州大学附属儿童医院呼吸病区住院的82例患儿,其中48例被确诊为RMPP患儿作为试验组,同期住院的34例被诊断为GMPP患儿作为对照组。RMPP诊断标准参考《难治性肺炎支原体肺炎诊治中应关注的问题》[6],标本均为单一患儿,无重复统计。本研究通过苏州大学附属儿童医院医学伦理委员会批准[批准文号:(2020)伦研批第5号],患儿监护人均知情同意,并签署知情同意书。
经临床评估病情需要,且经监护人签署相关知情同意书后,48例诊断RMPP的患儿均行电子支气管镜检查,并收集了BALF标本,34例GMPP患儿中8例进行了电子支气管镜检查,获得BALF标本,其余26例为NPA标本。并立即送往实验室进行病原学检测、涂片及病理等检测。
采用实时荧光定量RCR(qPCR)法(中山大学达安基因股份有限公司)检测NPA/BALF中MP DNA拷贝数>1.0×106 copies/L为阳性。将上述阳性标本和MP129标准株的MP 23S rRNA基因进行PCR,扩增产物送生工生物工程(上海)股份有限公司对MP 23S rRNA基因片段进行测序并比对。
利用软件Aman(http://www.Onlinedown.net/soft/89230.htm)进行结果分析。统计分析软件为SPSS 18.0。正态分布计量资料以 ±s表示,两组间比较采用t检验;非正态分布计量资料以M(P25~P75)表示,两组间比较采用Wilcoxon秩和检验。计数资料以百分比或率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
±s表示,两组间比较采用t检验;非正态分布计量资料以M(P25~P75)表示,两组间比较采用Wilcoxon秩和检验。计数资料以百分比或率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
RMPP组共48例。其中男21例(44.8%),女27例(55.2%);年龄(5.92±2.06)岁。GMPP组共34例。男19例(55.9%),女15例(44.1%);年龄(5.23±1.72)岁。2组患儿性别(χ2=1.773,P=0.279)及年龄(t=-1.695,P=0.090)比较差异均无统计学意义。
利用23S rRNA基因引物进行PCR扩增,48例RMPP和34例GMPP患儿NPA/BALF标本,均得到244 bp大小的基因片段(图1)。


注:M129为肺炎支原体标准株,M为标准带,N为阴性对照 M129 showed the standard strain of Mycoplasma pneumoniae,M showed the standard band,and N showed the negative control
48例RMPP患儿BALF标本PCR扩增产物中2例基因序列与MP129标准株23S rRNA序列完全相同,未检出点突变(图2),其余46例基因序列出现点突变,突变率达95.8%,全部为2063位A→G的突变(图3),未检出2063位A→T及2064位A→G的突变。34例GMPP患儿NPA/BALF标本PCR扩增产物中6例基因序列与MP129标准株23S rRNA序列完全相同,未检出点突变;其余28例基因序列出现点突变,突变率为82.4%,同样全部为2063位A→G的突变,未检出2063位A→T及2064位A→G的突变。最终,2组患儿MP 23S rRNA基因序列发生突变的共计74例,突变率达90.2%(74/82例),全部为2063位点A→G的突变。
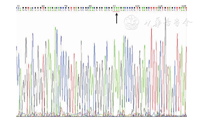

注:下划红线处指MP129标准株的23S rRNA基因的2063、2064、2065位点碱基,均为A The red line below refers to the 2063,2064 and 2065 bases of 23S rRNA gene of MP129 standard strain,all of which were A
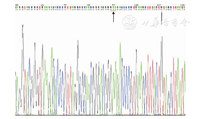

注:下划红线处指2063位发生碱基A→G的点突变,2064、2065位碱基仍为A The red line below refers to the point mutation of base A→G occurred at position 2063,and the base at position 2064 and 2065 were still A
本研究将MP耐药基因发生突变的和未发生突变的分为2组,分别为MA耐药组(MRMP组) (74例)和敏感组(MSMP组)(8例),均接受阿奇霉素抗感染。MRMP组发热持续时间13.0(7.0~15.0) d,MSMP组患儿的发热持续时间7.0(4.3~7.3) d,2组发热持续时间比较差异有统计学意义(Z=2.236,P=0.025),MRMP发热时间明显长于MSMP组。MRMP组住院时间为8.0(7.0~10.0) d,MSMP组住院时间为7.0(6.0~10.5) d,2组住院时间比较差异无统计学意义(Z=0.568,P=0.36)。MRMP组有78.4%(58例)患儿使用了糖皮质激素,而MSMP组仅有37.5%(3例)使用糖皮质激素,差异有统计学意义(χ2=4.369,P<0.05)。74例MRMP组患儿中出现46例(62.2%)RMPP患儿,其余28例(37.8%)经阿奇霉素抗感染治疗后痊愈,8例MSMP组患儿中仅出现2例(25.0%)RMPP,2组比较差异无统计学意义(χ2=2.719,P>0.05)。还分析了2组患儿血液中白细胞总数、中性粒细胞比例、淋巴细胞亚群分类、C反应蛋白(CRP)水平,丙氨酸转氨酶(ALT),乳酸脱氢酶(LDH),肌酸激酶同工酶(CK-MB)及胸部影像学表现等指标,差异均无统计学意义(均P>0.05)(表1)。
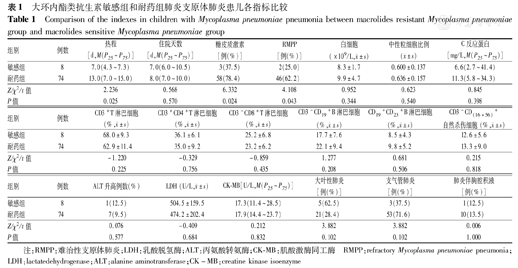
大环内酯类抗生素敏感组和耐药组肺炎支原体肺炎患儿各指标比较
Comparison of the indexes in children with Mycoplasma pneumoniae pneumonia between macrolides resistant Mycoplasma pneumoniae group and macrolides sensitive Mycoplasma pneumoniae group
大环内酯类抗生素敏感组和耐药组肺炎支原体肺炎患儿各指标比较
Comparison of the indexes in children with Mycoplasma pneumoniae pneumonia between macrolides resistant Mycoplasma pneumoniae group and macrolides sensitive Mycoplasma pneumoniae group
| 组别 | 例数 | 热程[d,M(P25~P75)] | 住院天数[d,M(P25~P75)] | 糖皮质激素[例(%)] | RMPP[例(%)] | 白细胞(×109/L, ±s) ±s) | 中性粒细胞比例( ±s) ±s) | C反应蛋白[mg/L,M(P25~P75)] |
|---|---|---|---|---|---|---|---|---|
| 敏感组 | 8 | 7.0(4.3~7.3) | 7.0(6.0~10.5) | 3(37.5) | 2(25.0) | 8.3±1.7 | 0.600±0.137 | 6.6(2.7~41.4) |
| 耐药组 | 74 | 13.0(7.0~15.0) | 8.0(7.0~10.0) | 58(78.4) | 46(62.2) | 9.9±4.7 | 0.636±0.157 | 11.3(5.8~34.3) |
| Z/χ2/t值 | 2.236 | 0.568 | 6.332 | 4.108 | 0.952 | 0.623 | 0.845 | |
| P值 | 0.025 | 0.570 | 0.024 | 0.043 | 0.344 | 0.540 | 0.398 |
| 组别 | 例数 | CD3+T淋巴细胞(%, ±s) ±s) | CD3+CD4+T淋巴细胞(%, ±s) ±s) | CD3-CD8+T淋巴细胞(%, ±s) ±s) | CD3-CD19+B淋巴细胞(%, ±s) ±s) | CD19+ CD23+B淋巴细胞(%, ±s) ±s) | CD3-CD(16+56)+自然杀伤细胞(%, ±s) ±s) |
|---|---|---|---|---|---|---|---|
| 敏感组 | 8 | 68.0±9.3 | 36.1±6.1 | 25.2±6.8 | 17.7±7.6 | 8.5±4.3 | 12.6±5.6 |
| 耐药组 | 74 | 62.9±11.4 | 35.0±9.2 | 23.2±6.2 | 22.1±9.4 | 9.8±5.2 | 13.3±9.0 |
| Z/χ2/t值 | -1.220 | -0.329 | -0.859 | 1.277 | 0.681 | 0.215 | |
| P值 | 0.225 | 0.756 | 0.435 | 0.208 | 0.506 | 0.818 |
| 组别 | 例数 | ALT升高例数(%) | LDH (U/L, ±s) ±s) | CK-MB[U/L,M(P25~P75)] | 大叶性肺炎[例(%)] | 支气管肺炎[例(%)] | 肺炎伴胸腔积液[例(%)] |
|---|---|---|---|---|---|---|---|
| 敏感组 | 8 | 1(12.5) | 504.5±159.5 | 17.3(11.4~28.5) | 5(62.5) | 3(37.5) | 1(12.5) |
| 耐药组 | 74 | 7(9.5) | 474.2±202.4 | 17.9(14.4~23.7) | 21(28.4) | 53(71.6) | 10(13.5) |
| Z/χ2/t值 | 0.076 | -0.409 | 0.212 | 3.882 | 3.882 | 0.006 | |
| P值 | 0.577 | 0.684 | 0.832 | 0.102 | 0.102 | 1.000 |
注:RMPP:难治性支原体肺炎;LDH:乳酸脱氢酶;ALT:丙氨酸转氨酶;CK-MB:肌酸激酶同工酶 RMPP:refractory Mycoplasma pneumoniae pneumonia;LDH:lactatedehydrogenase;ALT:alanine aminotransferase;CK-MB:creatine kinase isoenzyme
MP对MA耐药情况于2001年首次由Okazaki等[7]日本学者报道后,MRMP发生率在全球急剧上升,特别是亚洲更为显著,在中国达到90%~100%,日本为87%,韩国为84.6%,而在欧美国家相对较低,美国为13%,意大利为26%,苏格兰为19%[8]。因此,很多研究者从基因方面对耐药的机制做出了大量的研究。由于MP无细胞壁,所以青霉素、头孢菌素等作用于细胞壁的β-内酰胺类抗生素对其并不显效,而对MA、四环素及喹诺酮等影响微生物蛋白质合成的抗生素敏感。而四环素、喹诺酮等类药物在儿童群体中的的使用受到限制,因此儿科医师普遍使用MA治疗儿童MPP。但随着MA的普遍应用,耐药MP菌株逐渐增多,导致部分儿童在MP感染时选药困难。
目前研究认为,MA作用的基因靶点位于MP核糖体50S亚基23S rRNA的V结构域的中心为MA的公共作用区域。位于该区域的2063、2064等数个位点的突变可引起MP对红霉素及阿奇霉素等MA的高度耐药[9]。自Xin等[10]发表文章报道,目前中国分离到的MP耐药菌株突变均位于2063或2064位点,尚无其他位点突变的报道。由于MP生长缓慢,生长条件极其苛刻,至少需要2个月才能培养成功,因此临床获得生物学结果非常困难,导致实际上绝大部分患儿接受经验性抗MP治疗,造成严重的不合理用药。辛德莉等[11]报道,相对传统的MP培养及药物敏感实验,通过MP基因检测鉴定有无耐药基因序列来推测MP是否耐药更加快速、灵敏,会对临床合理应用抗生素发挥重要指导作用。
中国国内首次关于MP耐药状况的研究是由辛德莉等于2005年报道的,随后各地区陆续发表对MP耐药情况的研究成果,总体耐药发生率均较高。湖州地区120例住院患儿中有98例出现MA耐药,接近90%耐药发生A2063G突变,其余约5%为A2063C,A2064G,以及C2617G/A突变[12]。广州市连续5年对69 596例MPP患儿进行调查,MP耐药率为68.08%[13]。本研究结果显示,RMPP组和GMPP组患儿胸部X线检查诊断为支气管肺炎或大叶性肺炎的比例,以及是否合并胸腔积液的比例差异无统计学意义。2组患儿血液中白细胞总数、中性粒细胞比例、淋巴细胞亚群分类,CRP,ALT,LDH和CK-MB等异常改变亦无明显统计学差异。在陈煜等[14]的报道中,MPP患儿的血液中白细胞总数、中性粒细胞比例、CRP和CK-MB在MRMP组和MSMP组之间的差异无统计学意义。他们将肺部影像学特征分为点片状浸润、磨玻璃样渗出、节段性或大叶性实质浸润和单纯的肺门淋巴结大等4种类型,结果每种类型在2组间的发生率差异均无统计学意义(均P>0.05),本研究与之一致。但他们的报道中,ALT、LDH显著升高(P<0.05),而Lee等[15]的报道中胸片显示肺渗出、实变及胸腔积液发生率在2组差异无统计学意义,在WBC总数及分类、CRP、ALT及LDH异常改变等发生率两组间差异亦无统计学意义。所以,如果从胸部影像学特征及化验结果,如WBC总数及分类,CRP,ALT,LDH和CK-MB等方面来判断是否是耐药MP感染所致肺炎,可能会为临床决策作出误导。
RMPP的发生原因除了病原体耐药之外,还包括机体的异常免疫应答、混合感染、气道黏液堵塞气道、血液高凝状态及诊断延迟等方面[16]。但本研究中MRMP组和MSMP组患儿RMPP的发生差异并无统计学意义,提示MP对MA耐药并未加剧RMPP的发生。与既往资料[16]的矛盾可能与本研究的样本量较小有关,但也提示需要进一步开展更加严谨而科学的多中心研究去论证。有研究报道,MPP患儿BALF MP-DNA与中性粒细胞比例显著增加,提示MP可激活中性粒细胞,诱发机体细胞和体液免疫反应[17],相对于GMPP患者,RMPP患者体内CD8+T淋巴细胞比例增高,白细胞介素6(IL-6),白细胞介素10(IL-10)和干扰素γ(INF-γ)等细胞因子水平增高,这些免疫异常改变可能促进了炎症的进展,一定程度上促进了GMPP向RMPP的转化[18],这样也解释了RMPP组患儿在发热时程和糖皮质激素的应用比例明显高于GMPP组这一结果。但74例耐药患儿中28例(37.8%)(95%CI:26.8%~48.8%)给予MA及对症支持治疗后,病情痊愈,因此MA在抗MP感染的治疗中的权重有多大,甚至是否必要,还需要以后收集更多的资料,选择合适的方法进一步研究。
综上,苏州地区MP耐药株检出率较高,均为MP 23S rRNA基因2063位点A→G的点突变,耐药形式较为严峻。但想要根据临床表现、胸部影像学特征及常见的临床化验来鉴别MRMP或是MSMP并不可靠,因此需要进一步收集合适的临床资料,采取更好的研究方法,为临床决策者寻找方便可靠的指标来帮助判断每例MPP患儿的预后,为更合理地选择诊疗方案提供指导作用。
所有作者均声明不存在利益冲突



























