
奥马珠单抗是治疗哮喘的生物靶向药物,推荐用于血清IgE升高、吸入性糖皮质激素联合长效β2受体激动剂控制不佳的≥6岁儿童中重度过敏性哮喘。对于哮喘合并过敏性鼻炎、慢性荨麻疹、特应性皮炎、食物过敏等,奥马珠单抗有较好临床疗效,并且在季节性应用及IgE水平过高时,该药物的个体化应用亦受到临床关注。为规范儿童奥马珠单抗临床应用,中华医学会儿科学分会呼吸学组哮喘协作组参考国内外循证医学证据,达成了奥马珠单抗在儿童过敏性哮喘临床应用专家共识,供临床实践参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
支气管哮喘(简称哮喘)是儿童时期最常见的慢性气道炎症性疾病,以慢性气道炎症和气道高反应性为特征,具有反复发作的喘息、咳嗽、气促和胸闷等临床特点的异质性疾病。患病率呈逐年上升趋势[1,2,3]。目前临床上多以吸入性糖皮质激素(ICS)、ICS联合长效β2受体激动剂(ICS-LABA)、白三烯受体拮抗剂(LTRA)等控制类药物治疗儿童慢性持续期哮喘,过敏原特异性免疫治疗适用于有适应证的患儿。但仍有部分哮喘患儿控制不理想。多中心调查结果显示[4],19.9%的2~16岁哮喘患儿哮喘未达控制。全国流行病学调查数据显示[5],分别有77%和47.3%的哮喘患儿1年内曾发生哮喘急性发作或因哮喘急性发作住院。
过敏性哮喘是儿童哮喘的最常见表型,IgE介导的Ⅰ型变态反应是儿童过敏性哮喘的主要免疫学机制,也是Ⅱ型炎症的重要表型。研究显示,83.0%~98.6%的哮喘患儿总IgE水平升高或过敏原特异性IgE检测为阳性[6]。儿童哮喘合并过敏性鼻炎、荨麻疹、特应性皮炎、食物过敏等系统性过敏症比例较高,此类表型的哮喘可能是构成对ICS-LABA控制治疗反应性差的Ⅱ型炎症表型主要来源。
重组人源化抗IgE单克隆抗体——奥马珠单抗(Omalizumab)是全球第1个治疗哮喘的生物靶向药物,已在临床应用10余年。《儿童支气管哮喘诊断与防治指南(2016年版)》[7]推荐其用于血清IgE升高、高剂量ICS-LABA无法控制的≥6岁中重度过敏性哮喘。
临床实践显示,奥马珠单抗对于哮喘合并过敏性鼻炎、慢性荨麻疹、特应性皮炎、食物过敏等有较好临床疗效,并且在季节性应用及IgE水平过高时,该药物的个体化应用亦受到临床关注。目前,对于奥马珠单抗的使用疗程和剂量调整方案尚没有统一认识。
为了规范奥马珠单抗治疗学龄期儿童和青少年过敏性哮喘的临床应用,建立适用于中国哮喘患儿的优化治疗方案,中华医学会儿科学分会呼吸学组哮喘协作组结合中国国情及全球循证医学证据,对奥马珠单抗治疗儿童过敏性哮喘及其他IgE介导的过敏性疾病的相关问题进行充分讨论,达成了奥马珠单抗临床应用专家共识,供临床实践参考。
过敏性哮喘又称变应性哮喘(allergic asthma)或特应性哮喘(atopic asthma),既往亦称为外源性哮喘(extrinsic asthma),是指由过敏原致敏引起和/或触发的一类哮喘,是哮喘的主要类型或表型,尤其在学龄儿童,占哮喘的60%~80%[8]。
在明确诊断哮喘的基础上,具备以下情况中的一项或多项,支持过敏性哮喘的诊断[7,8,9]:(1)典型的过敏病史或哮喘发作是因暴露于过敏原而触发;(2)伴有过敏性鼻炎、食物过敏、湿疹或特应性皮炎等;(3)存在过敏原致敏的实验室依据:过敏原皮肤点刺试验阳性、血清过敏原特异性IgE水平升高或总IgE水平升高;(4)外周血嗜酸性粒细胞(EOS)计数增高;(5)呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)水平升高;(6)诱导痰细胞学检查显示EOS比例增加。其中过敏原检测为最直接的实验室证据。
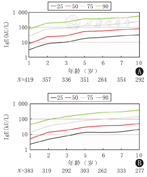
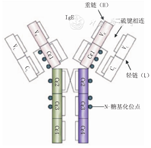
IgE是Ⅰ型变态反应疾病发病机制中最重要的免疫球蛋白,也是过敏性哮喘气道炎症反应的核心。血清IgE含量在不同年龄的健康人群中存在较大差异,随着年龄增长呈上升趋势,10~15岁达到高峰,此后逐渐下降。此外,IgE水平还受环境、种族、检测方法等因素的影响[10]。有研究显示,8~14岁无过敏因素的正常儿童,总IgE的均值为45 kU/L(即45 IU/mL)[11]。1~10岁总IgE水平的变化规律见图1[12]。IgE是由2条相同的轻链和2条相同的重链组成的免疫球蛋白,每一条链均含有1个可变区(VH或VL)和1个或多个恒定区(CH或CL),见图2[13]。轻链和重链的可变区共同组成了IgE分子的抗原结合位点。重链的恒定区(Fc片段)包含IgE与效应细胞表面IgE受体(FcεR)的结合位点(cε3区域的N-糖基化位点)。IgE受体包括高亲和力受体(FcεRⅠ)和低亲和力受体(FcεRⅡ)两种类型,前者主要表达于肥大细胞、嗜碱粒细胞和树突状细胞,后者表达于B淋巴细胞、单核巨噬细胞和EOS等[13]。IgE在血液中的半衰期为2~5 d,但通过与FcεRⅠ的结合后及肥大细胞的调控作用,在血液中可持续存在几周甚至几个月。


机体首次暴露于过敏原时,激活初始Th0细胞分化成Th2细胞。Th2细胞主要功能为介导体液免疫应答,合成并释放白细胞介素(IL)-4、IL-13等细胞因子,促进B淋巴细胞成熟分化为浆细胞,产生特异性IgE。IgE与肥大细胞和嗜碱性粒细胞表面的FcεRⅠ结合形成FcεRⅠ-IgE复合物,细胞处于致敏状态。当机体再次暴露相同过敏原,与效应细胞上的FcεRⅠ-IgE复合物结合,引发细胞脱颗粒,释放组胺、白三烯及前列腺素等促炎因子,导致平滑肌收缩、黏液分泌增加、血管通透性增高和炎性细胞浸润,进而引起哮喘急性发作(速发相反应)[14,15]。同时,所释放的促炎因子及Th2细胞产生的IL-3、IL-5等细胞因子募集并活化EOS等炎症细胞,引发级联扩大反应,导致炎症持续、气道收缩、组织损伤及气道重塑(迟发相反应)[14,15,16]。此外,IgE与B淋巴细胞、单核巨噬细胞及EOS表达的FcεRⅡ结合,有助于抗原提呈细胞对过敏原的摄入、处理并提呈,进一步增强机体对过敏原的免疫应答。
奥马珠单抗是高度人源化的抗IgE单克隆抗体,具有亲和力高和不良免疫反应风险低的特性[17]。其作用机制如下。
奥马珠单抗与游离IgE的cε3区域结合,显著降低游离IgE水平,同时抑制游离IgE与效应细胞,如树突状细胞、肥大细胞、嗜碱性粒细胞表面的FcεRⅠ结合,抑制效应细胞活化脱颗粒和炎症介质的释放,从而阻断过敏级联反应的发生,见图3[18]。有研究显示奥马珠单抗降低过敏性哮喘患者的游离IgE水平效应在停药后1年仍持续存在[19,20]。
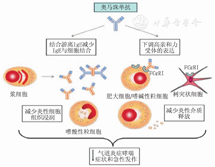

奥马珠单抗可下调效应细胞表面FcεRⅠ的数量和功能,当患者接受奥马珠单抗治疗后,体内游离IgE被奥马珠单抗捕获,导致效应细胞表面的FcεRⅠ无法与其结合,表面FcεRⅠ被加速内吞,从而使细胞脱敏,减少炎症介质释放,对速发相和迟发相过敏反应均有抑制作用[21]。
近年来关于奥马珠单抗治疗儿童(6~18岁)过敏性哮喘的研究和循证证据逐渐增多。国外多项多中心、随机、双盲对照研究显示,中重度过敏性哮喘患儿(6~20岁)在ICS治疗的基础上联合奥马珠单抗附加治疗(疗程为24~60周),可进一步改善哮喘症状[25,26,27,28,29]降低哮喘急性发作率,并可减少ICS的吸入剂量[25,29,30]。总体而言,在ICS治疗的基础上联合奥马珠单抗附加治疗对儿童过敏性哮喘是有效、安全的[25,26,27,31]。2015年法国的一项真实世界研究显示[32],重度过敏性哮喘患儿(6~18岁)长期使用奥马珠单抗附加治疗(至少>48周),可进一步提高哮喘良好控制率,降低哮喘急性发作率和住院率,改善肺通气功能,减少ICS吸入剂量。2017年日本的一项研究观察了重度未控制过敏性哮喘患儿长期使用奥马珠单抗附加治疗的有效性和安全性,平均用药时间长达近117周(47~151周),结果显示[33],奥马珠单抗附加治疗可使76%的患儿达到哮喘完全控制或良好控制,哮喘相关的住院率和急诊率明显下降。不良反应发生率无随使用时间延长而累积增加。有研究观察了已使用ICS维持治疗的6~17岁过敏性哮喘儿童在秋季开学前4~6周启动奥马珠单抗附加治疗(至开学后3个月停药)对秋季哮喘急性发作的预防作用[23]。
国内回顾性研究表明,奥马珠单抗附加治疗6岁以上中重度过敏性哮喘伴或不伴过敏性鼻炎患儿16周,患儿哮喘症状控制水平和生活质量均显著改善,肺功能指标有显著改善,且不影响生长发育,安全性良好[34,35,36]。
奥马珠单抗一般适用于6岁及以上儿童患者,用于经ICS-LABA治疗后,仍不能有效控制症状的中重度持续性过敏性哮喘[37]。
儿童研究显示,奥马珠单抗对基线第1秒用力呼气容积(FEV1)占预计值百分比<90%,治疗前一年急性发作≥3次[38],FeNO≥20 ppb,EOS≥2%,体质量指数(BMI)≥25 kg/m2的患儿疗效更加显著[39]。对于成人及青少年重度哮喘的研究发现,当基线EOS≥260/μL或FeNO≥19.5 ppb时患者或更能从奥马珠单抗治疗中获益[40];奥马珠单抗也适用于因不良反应而需要避免/减少使用口服激素[41]和/或不愿长期使用ICS的中重度过敏性哮喘患儿[42]。
总IgE水平是计算患儿用药剂量的基础,根据基线IgE(IU/mL,治疗开始前测定)和体质量(kg),确定奥马珠单抗合适的给药剂量(每次给药剂量为75~600 mg)和给药频率(每2周或4周给药1次)。若每次给药剂量≤150 mg,则于1个部位皮下注射;若剂量>150 mg,则按需分1~4个部位分别皮下注射。奥马珠单抗每次给药最大推荐剂量为600 mg,每2周1次。用药剂量见图4[37],每次给药时,给药剂量与瓶数、注射次数和总注射体积的换算见表1[37]。若患儿总IgE<30 IU/mL或>1 500 IU/mL,应谨慎评估后再行使用(参见本文8.7部分内容)。


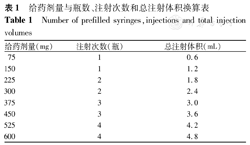
给药剂量与瓶数、注射次数和总注射体积换算表
Number of prefilled syringes,injections and total injection volumes
给药剂量与瓶数、注射次数和总注射体积换算表
Number of prefilled syringes,injections and total injection volumes
| 给药剂量(mg) | 注射次数(瓶) | 总注射体积(mL) |
|---|---|---|
| 75 | 1 | 0.6 |
| 150 | 1 | 1.2 |
| 225 | 2 | 1.8 |
| 300 | 2 | 2.4 |
| 375 | 3 | 3.0 |
| 450 | 3 | 3.6 |
| 525 | 4 | 4.2 |
| 600 | 4 | 4.8 |
血清总IgE的测定方法包括放射过敏原吸附试验(RAST,又称固相放射免疫测定)、酶联免疫吸附试验、间接血凝试验、化学发光法、电化学发光免疫测定等,其中以RAST和酶联免疫吸附试验精确度较高,临床应用广泛[8]。
奥马珠单抗应冷藏保存(2~8 ℃),脱离冷藏条件的药品应于8 h内注射,若不能及时注射,不能重新冷藏保存。制备奥马珠单抗皮下注射液的操作步骤应严格遵循药品说明书。
由于注射后有过敏反应的风险,应在具备留观条件和抢救过敏性休克相关医疗设施的医疗机构进行注射。
须为经过培训的医师或护士。
注射部位为上臂的三角肌区,若因某些原因不能在三角肌区注射,也可在大腿部位注射给药。
奥马珠单抗治疗16周时应对患儿的哮喘控制情况进行初步评估以判断其有效性[46,47],根据总体哮喘控制效果,即治疗有效性全球评估(Global Evaluation of Treatment Effectiveness,GETE)来判断是否继续应用奥马珠单抗。应答显著改善者建议继续使用;中等应答或无法明确判断应答情况,则应延长治疗时间至6个月或6~12个月再次评估;无应答者则予以停止治疗,见图5。目前奥马珠单抗治疗的具体疗程尚未有定论,但根据现有研究证据,建议治疗持续12个月以上为最佳[48,49],而12个月的后半年时间可维持原足量治疗方案,也可酌情采用每次给药量减半或间隔时间延长1倍的治疗方案。根据2020年版全球哮喘防治创议(GINA)指南的建议,在奥马珠单抗持续用药12个月后,如患儿在中或低剂量ICS治疗下仍能得到很好地哮喘控制,可考虑尝试停用奥马珠单抗[9]。季节性加重的患儿建议酌情在秋季和/或春季前加用奥马珠单抗4~6周[23,50,51]。
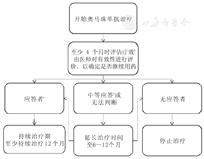

注:GETE:治疗有效性全球评估;a根据GETE评分判断,应答:GETE评分为优/好;中等应答:GETE评分为中 GETE:Global Evaluation of Treatment Effectiveness;ajudged by GETE score,response:GETE score is excellent/good;moderate response:GETE score is medium
奥马珠单抗治疗期间一般无需用监测总IgE水平变化来调整奥马珠单抗的剂量。而当患儿体质量发生显著改变时,应根据新的体质量调整给药剂量。奥马珠单抗减量与停药方案目前大多基于个体化实践经验。综合目前有限的数据资料,可考虑采用减少每次给药量或延长时间间隔的渐进式剂量减量方案,且首次减量不应超过50%或逐渐延长给药时间间隔。减量后如哮喘仍能保持控制,应维持半年以上再进行下一次减量或停药,如因减量或停药导致哮喘失去控制,则应返回上一次按照原剂量或频率继续给药方案[31,52]。可考虑减量的指征包括:年龄较小、肺功能较好、哮喘控制良好、伴随用药已减量、奥马珠单抗治疗初始应答好[31]、长期治疗后总IgE呈下降趋势[53]。现有儿童研究证据显示使用奥马珠单抗超过2年且无重度急性发作至少1年的哮喘患儿中,约3/4的患儿停药成功[54]。
若患儿治疗期间因故中断用药,应及时恢复治疗。当治疗中断时间<1年,仍以首次剂量确定时测得的血清总IgE水平为依据,按之前计算的剂量和注射频率继续治疗;当治疗中断时间≥1年时,应根据重新检测血清总IgE水平确定给药剂量[44]。此外,在足疗程的奥马珠单抗治疗后,应根据患儿哮喘控制程度和儿童支气管哮喘诊断与防治指南(2016年版)[7]的降阶梯方案来调整其他哮喘控制药物的剂量。
初次接受奥马珠单抗治疗16周后与维持治疗期每3个月时,由医师进行疗效评估,包括用药后的临床表现及肺功能、FeNO等辅助检查改善情况[52]。同时评估患儿对奥马珠单抗的应答情况,包括哮喘急性发作次数和哮喘控制问卷和生活质量量表等进行评估,治疗16周后建议应用GETE进行评估。
大量临床研究和应用证实,6岁及以上儿童接受奥马珠单抗治疗时耐受性良好,不良事件的发生率较低,多为轻中度,持续时间短[27,34]。6~12岁儿童的不良反应主要为头痛、发热和上腹痛,12岁及以上常见注射部位疼痛、肿胀、红斑和瘙痒,还可出现轻微关节痛、疲劳、头晕等[55]。奥马珠单抗相关的严重过敏反应少见,其发生率为0.1%~0.2%,在儿童临床应用中尚未出现严重过敏反应的报道[56,57]。
其他受到关注的可能相关的不良反应包括恶性肿瘤、蠕虫感染、血清病样反应、动脉血栓栓塞事件等。一项随访5年的前瞻性观察队列研究表明,接受奥马珠单抗治疗的12岁及以上中重度过敏性哮喘患儿出现原发性恶性肿瘤的比例及其他系统疾病发生率与对照组未见差异[58];在6~12岁儿童患者治疗的临床研究中,无恶性肿瘤病例的报道[57]。IgE在机体抗寄生虫的免疫中起重要作用,使用奥马珠单抗治疗未观察到蠕虫感染的增加[59],但有蠕虫感染高风险人群应在专科医师的指导下谨慎使用。尚无证据表明奥马珠单抗与心脑血管不良事件之间存在关联[60],但仍不排除接受奥马珠单抗治疗的患者发生该类不良事件的潜在风险增加[61]。有个别病例出现类血清病样症状,但在儿童中未检测到抗奥马珠单抗抗体。尽管上述相关不良事件目前在儿童中尚未见报道,仍需进行更长期的监测和随访以确认其在儿童患者中用药的安全性。
有研究证实,奥马珠单抗可使≥12岁的青少年及成人过敏性哮喘合并严重过敏性鼻炎的患者获益[62,63,64,65]。由IgE介导的过敏性哮喘合并严重过敏性鼻炎患者,在回避过敏原及基础药物治疗反应不佳时,推荐采用奥马珠单抗治疗。
奥马珠单抗虽未批准用于单纯过敏性鼻炎,但已有奥马珠单抗治疗儿童、青少年及成人严重季节性过敏性鼻炎(seasonal allergic rhinitis,SAR)的报道[66,67]。Meta分析证实,奥马珠单抗可有效改善儿童及成人严重SAR的鼻部症状,减少其他鼻炎用药,提高生活质量,安全性良好[68]。对于≥12岁的青少年及成人经规范治疗仍无法控制症状的常年性过敏性鼻炎(perennial allergic rhinitis,PAR)患者,应用奥马珠单抗治疗安全、有效且耐受性好。奥马珠单抗治疗严重过敏性鼻炎的用量参照过敏性哮喘适应证的推荐剂量,每2周或4周给药1次。对于严重SAR患儿,建议仅在过敏高发季节症状出现后尽早开始治疗,至少应用12周,再评估是否需要继续用药;对于严重PAR患儿,参照过敏性哮喘适应证的使用疗程进行治疗。
研究发现奥马珠单抗可通过多种途径改善特应性皮炎的临床症状。近期一项对34项临床研究的Meta分析发现有169例(79%)应用奥马珠单抗治疗特应性皮炎患者取得了轻度-完全缓解[69]。一项英国62例4~19岁重症特应性皮炎患者的临床试验显示,奥马珠单抗可显著降低儿童重症特应性皮炎严重程度和改善生活质量[70]。来自Czech Anti-IgE Registry真实数据显示,310例重症过敏性哮喘患者接受12个月奥马珠单抗治疗后均有明显改善,且67例重症过敏性哮喘合并特应性皮炎患者中特应性皮炎完全缓解或明显改善率达82.1%[62]。我国也有报道应用奥马珠单抗治疗哮喘合并重症特应性皮炎取得良好的效果[71]。因此,虽然早期也有病例报道或非对照药物临床研究对奥马珠单抗治疗特应性皮炎疗效提出争议[72],但对于儿童哮喘合并中重症特应性皮炎常规治疗效果欠佳时,可以考虑试用奥马珠单抗。
虽然目前尚无指南给出奥马珠单抗治疗儿童过敏性哮喘合并特应性皮炎明确的疗程建议,大部分临床观察性研究使用奥马珠单抗治疗特应性皮炎疗程超过3个月。一项英国重症特应性皮炎患者的随机双盲安慰剂对照临床试验显示,奥马珠单抗治疗24周后特应性皮炎严重程度较治疗前明显改善[70]。目前建议疗程6个月以上。
过敏性哮喘合并慢性荨麻疹患者使用奥马珠单抗治疗,应遵循中国哮喘适应证说明书剂量表进行用药。研究显示,奥马珠单抗治疗1年,85%的患者可改善哮喘伴随荨麻疹症状[37,62]。另外,也有诸多文献报道奥马珠单抗对哮喘合并慢性荨麻疹患者显著有效,可以同时改善哮喘症状和7 d荨麻疹活动性评分(Weekly Urticaria Activity Score,UAS7评分)[73,74,75,76]。
食物过敏的特异免疫反应分为IgE介导和非IgE介导。IgE介导的食物过敏常出现严重过敏反应,且过敏持续时间长,耐受产生会延迟,少数患者甚至终身过敏。
对于严重的IgE介导的食物过敏患者,可以从抗IgE治疗中获益,接受奥马珠单抗治疗后可以提高对过敏食物的耐受量,降低意外暴露后发生严重过敏反应的风险。一项真实世界研究发现[77],严重哮喘同时伴有食物过敏的患者使用了奥马珠单抗4个月后食物过敏的阈值增加8.6倍,部分患者甚至可以重新引入过敏食物。由于食物限制减少,患者的生活质量明显改善。
IgE介导的食物过敏是过敏性哮喘的诱发因素之一,且哮喘症状重,多为伴有严重过敏反应,因此食物过敏的口服免疫治疗十分重要,但治疗过程中不良反应率高于吸入变应原免疫治疗。奥马珠单抗联合食物过敏原口服免疫治疗能够更快地达到目标维持剂量,可以耐受更高的初始剂量,不良反应率明显降低[78,79]。但是相关研究的病例数较少,而且部分研究发现奥马珠单抗联合食物过敏原口服免疫治疗针对某些食物没有优势,与安慰剂没有差别,停药后再次出现过敏症状等[80]。联合免疫治疗还存在一些没有解决的问题,如奥马珠单抗在口服免疫治疗前的介入时机,疗程长短,治疗后患儿无过敏症状能持续多长时间等[81],亟待今后的研究中继续探索。
季节性奥马珠单抗治疗可以预防哮喘急性发作。一项多中心随机对照试验(RCT)研究[23]显示,对于近19个月内有哮喘急性发作,接受2~5级治疗并达到哮喘控制的患儿,在秋季开学前1个月起进行为期4个月的奥马珠单抗短期治疗,可显著降低秋季哮喘发作概率,奥马珠单抗组≥1次秋季哮喘急性发作的患儿比例显著低于安慰剂组。接受5级治疗的患儿中,奥马珠单抗组秋季哮喘急性发作的风险更是较安慰剂组降低了63%。澳大利亚一项研究[82]显示,对前一个冬季有哮喘急性发作的患儿,在本年冬季病毒感染高发期接受为期5个月的奥马珠单抗治疗,安慰剂组发生严重哮喘发作是奥马珠治疗组的10.8倍,奥马珠单抗的保护作用并不能延续至下一年,但接受奥马珠单抗治疗的患儿再次出现严重发作的时间间隔较安慰剂组更长。日本的一项成人哮喘研究[83]显示,5例患有日本雪松花粉症和哮喘的患者接受连续3年季节性奥马珠单抗治疗,可缓解日本雪松花粉症和哮喘患者临床症状,并降低患者的特异性IgE水平。
季节性奥马珠单抗治疗中重度哮喘伴变应性鼻炎安全有效。马婷婷等[84]研究显示,在夏秋季接受3个月奥马珠单抗短期治疗能够改善中重度哮喘伴过敏性鼻炎患者的肺功能、鼻部症状和生活质量,减少哮喘发作次数,安全性良好。隋海晶等[85]研究显示,中重度哮喘合并难治性鼻息肉患者在接受4个月奥马珠单抗治疗后,其哮喘得到良好控制,鼻炎症状评分及生活质量评分明显改善。
中重度哮喘或者同时合并其他过敏性疾病,季节性应用奥马珠单抗治疗安全有效。
目前全球范围内奥马珠单抗尚未被批准用于6岁以下患儿的治疗,6岁以下儿童中应用的大样本证据有限,仅部分小样本临床研究或病例报告探索了奥马珠单抗在6岁以下儿童中的使用情况。研究显示患儿接受奥马珠单抗治疗后哮喘急性发作显著减少、缓解药物使用减少、儿童哮喘控制测试(C-ACT)评分显著提高,因哮喘急诊就诊减少、哮喘住院率降低,且未见该年龄段安全性不良事件的相关报道[79,86,87,88]。目前报道的儿童最低用药年龄为2岁,患者用药期间无不良事件发生[89]。此外,一项针对奥马珠单抗2~6岁儿童用药的Ⅱ期临床研究(NCT02570984)正在进行,该研究建议:如临床需要应用时,可根据患儿体质量与总IgE按0.016 mg/(kg·IU)计算用药剂量,每4周给药1次[76]。
目前奥马珠单抗说明书中未对总IgE>1 500 IU/mL的患者进行剂量推荐,有研究显示奥马珠单抗在高水平IgE哮喘患者中的疗效与那些IgE水平在剂量表内患者的疗效是一致的,可帮助患儿实现哮喘控制、减少急性发作[19,90,91,92]。根据奥马珠单抗药物代谢动力学/药物效应动力学(PK/PD)研究数据,总IgE>1 500 IU/mL的患者推荐奥马珠单抗按最大给药剂量(600 mg,每2周1次)用药,以达到用药后降低患者血清游离IgE的目的[93]。
奥马珠单抗可以根据病情在AIT治疗的不同阶段使用。(1)预先给予奥马珠单抗开启AIT。研究显示,对于经哮喘常规治疗控制不佳或合并其他严重过敏性疾病的哮喘患儿,预先给予奥马珠单抗治疗可以顺利开启AIT[94,95,96,97];(2)联合奥马珠单抗助力AIT达到剂量维持阶段。国内研究显示,AIT治疗剂量递增阶段发生严重过敏反应或难以达到维持剂量的患儿,联合奥马珠单抗可以成功达到剂量维持阶段[97];(3)用奥马珠单抗预处理减少集群/冲击免疫治疗的严重不良反应的发生[98,99]。在一项RCT研究中,患者首先接受9周的奥马珠单抗或安慰剂预治疗,冲击免疫治疗1 d,再联合治疗12周以上,结果显示联合奥马珠单抗可使冲击免疫治疗阶段发生过敏反应的风险降低5倍[100]。另有研究显示,对于合并季节性过敏性鼻结膜炎的过敏性哮喘患儿,奥马珠单抗联合AIT治疗组在奥马珠单抗停药2年后,鼻炎症状、哮喘控制情况及与疾病相关的生活质量评分与单纯AIT组比较无显著差异[101],这表明短期联合奥马珠单抗治疗的持久效果有待进一步评估。AIT中应用奥马珠单抗的剂量和持续时间还需进一步探讨。
奥马珠单抗精准靶向游离IgE是6岁及以上儿童中重度过敏性哮喘新的治疗选择。在哮喘合并过敏性鼻炎、荨麻疹、特应性皮炎以及食物过敏等其他过敏性疾病,奥马珠单抗的特殊应用实践亦对临床工作具有一定参考价值。近年来,随着对哮喘潜在发病机制研究的不断深入,针对不同哮喘表型的个体化靶向治疗已成为哮喘领域未来的治疗方向。包括最早应用的奥马珠单抗,靶向EOS的IL-5、IL-5受体、IL-4受体、IL-4、IL-13等的Mepolizumab、Relizumab、Benralizumab和Dupilumab等生物制剂已用于临床治疗Ⅱ型炎症的难治性哮喘,部分还可以治疗荨麻疹、特应性皮炎、过敏性鼻炎、慢性鼻窦炎等[109]。对Ⅱ型炎症的难治性哮喘患者,GINA建议优先选择靶向Ⅱ型炎症的生物制剂,若靶向生物制剂有效,应尽可能减少糖皮质激素的用量[9]。未来10年,随着靶向胸腺基质淋巴细胞生成素(TSLP)、IL-33等药物的临床应用、新靶点的不断发现、依据药物基因学正确选择应用靶向药物,难治性哮喘及其他过敏性疾病的治疗前景光明[109]。本共识通过国内外相关证据的收集整理,结合中国临床应用经验,对奥马珠单抗治疗儿童哮喘患者的临床应用给予建议,以期为中国儿科医师提供有价值的临床决策参考。今后还需要通过更长期的观察和研究获得更多我国儿童临床应用的高质量有效性和安全性数据,以对本专家共识进一步完善与补充,使众多哮喘儿童获益。
(刘长山 向莉 陈实 陈爱欢 陈艳萍 陈志敏 成焕吉 韩志英 郝创利 华山 刘传合 刘恩梅 刘瀚旻 卢根 陆敏 陆小霞 潘家华 沙莉 尚云晓 邵洁 孙新 王金荣 王雪艳 徐保平 叶乐平 张琪 赵京 赵德育 郑跃杰 周薇 申昆玲 执笔)
参与本共识讨论、制定的专家(按姓氏拼音排序):陈实(海南省人民医院);陈爱欢(广州医科大学附属第一医院广州呼吸健康研究院);陈艳萍(湖南省儿童医院);陈志敏(国家儿童健康与疾病临床医学研究中心,浙江大学医学院附属儿童医院);成焕吉(吉林大学白求恩第一医院);韩志英(山西省儿童医院);郝创利(苏州大学附属儿童医院);华山[复旦大学附属儿科医院安徽医院(安徽省儿童医院)];刘传合(首都儿科研究所附属儿童医院);刘恩梅(国家儿童健康与疾病临床医学研究中心,重庆医科大学附属儿童医院);刘瀚旻(四川大学华西第二医院);刘长山(天津医科大学第二医院);卢根(广州市妇女儿童医疗中心);陆敏(上海市儿童医院);陆小霞(华中科技大学同济医学院附属武汉儿童医院);马琳(国家儿童医学中心,首都医科大学附属北京儿童医院);潘家华[中国科学技术大学附属第一医院(安徽省立医院)];沙莉(首都儿科研究所附属儿童医院);尚云晓(中国医科大学附属盛京医院);邵洁(上海交通大学医学院附属瑞金医院);申昆玲(国家儿童医学中心,首都医科大学附属北京儿童医院,国家呼吸系统疾病临床医学研究中心);孙新(空军军医大学西京医院);王金荣(山东第一医科大学附属省立医院);王雪艳(天津医科大学第二医院);向莉(国家儿童医学中心,首都医科大学附属北京儿童医院,国家呼吸系统疾病临床医学研究中心);徐保平(国家儿童医学中心,首都医科大学附属北京儿童医院,国家呼吸系统疾病临床医学研究中心);叶乐平(北京大学第一医院);张琪(中日友好医院);赵京(首都儿科研究所附属儿童医院);赵德育(南京医科大学附属儿童医院);郑跃杰(深圳市儿童医院);周薇(北京大学第三医院)
所有作者均声明不存在利益冲突


























