
探讨奥马珠单抗在变应性哮喘(AS)并特应性皮炎(AD)患儿中的应用。
回顾性分析2018年11月至2020年8月于南京医科大学附属儿童医院呼吸科诊断中重度AS并AD 5例患儿临床资料,治疗均遵循AS规范化治疗联合奥马珠单抗,观察奥马珠单抗治疗AD的疗效和不良反应。选择特应性皮炎严重程度指数(SCORAD)、湿疹面积及严重度指数(EASI)、儿童皮肤病生活质量的指数(CDLQI)和峰值瘙痒数字评价量表(NRS)评价AD患儿的皮损严重程度、面积、瘙痒及其对生活质量的影响。
5例患儿在治疗4个月后,SCORAD、EASI、CDLQI和NRS评分(60.80±10.79比40.30±15.62;13.93±6.81比6.18±2.70;18.80±6.26比13.20±4.82;8.60±0.89比6.00±1.87)均明显下降,差异均有统计学意义(t=7.833、4.106、5.199、5.099,均P<0.05)。2例患儿在奥马珠单抗治疗后联合变应原特异性免疫治疗,免疫治疗过程顺利,未见不良反应。5例患儿共接受奥马珠单抗皮下注射104次,均未见不良反应。
在中重度AS并AD患儿治疗中,奥马珠单抗可明显减轻其皮损严重程度、减少皮炎面积,显著改善其生活质量。奥马珠单抗在特异性免疫治疗前使用,可提高机体对变应原的免疫耐受性和安全性。奥马珠单抗长期皮下注射,安全性好,不良反应轻。奥马珠单抗有望成为治疗儿童AD的新型靶向药物,且可作为变应原特异性免疫治疗的辅助药物。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
世界变态反应组织统计数据表明,近30年间变态反应性疾病发病率至少增长了3倍[1]。特应性皮炎(AD)为一种常见的慢性瘙痒性炎症性皮肤病,常共患变应性哮喘(AS)、变应性鼻炎(AR)等多种变态反应性疾病。儿童AD的严重程度往往重于成人,影响其生活学习质量,且儿童AD药物选择较为局限,药物治疗面临巨大挑战。奥马珠单抗是一种人源化单克隆抗体,选择性地与免疫球蛋白E(IgE)结合,抑制IgE与效应细胞表面高亲和力受体结合,阻止效应细胞活化脱颗粒、释放炎症因子及募集炎症细胞[2]。目前我国批准奥马珠单用于6岁以上中重度、难治性、耐药性AS治疗。2018年欧洲变应性反应与临床免疫学会联合全球变态反应和哮喘欧洲协作组、欧洲皮肤病学论坛、世界过敏组织指南将奥马珠单抗列为12岁以上人群慢性荨麻疹的三线治疗药物[3]。目前奥马珠单抗在儿童AD中临床数据仍较缺乏,本研究对5例AS并AD患儿应用奥马珠单抗治疗的临床资料进行回顾性分析,以期为奥马珠单抗治疗儿童AD提供疗效和安全性经验。
选取2018年11月1日至2020年8月31日在南京医科大学附属儿童医院诊断中重度AS并AD行奥马珠单抗治疗的5例患儿。男3例,女2例;年龄6岁3个月~17岁,中位年龄9岁4个月。纳入标准:(1)年龄≥6岁且<18岁;(2)AS诊断参考《儿童支气管哮喘诊断与防治指南(2016年版)》[4],AD诊断参考《中国特应性皮炎诊疗指南(2020版)》[5];(3)血清总IgE增高(>30 IU/mL),且伴至少1项过敏原阳性;(4)患儿自愿参加且监护人签署奥马珠单抗治疗知情同意书,并接受随访调查。排除标准:(1)对奥马珠单抗活性成分或其他任何辅料有过敏反应者;(2)患慢性肺疾病、肺炎、气胸、胸廓畸形、胸膜病变和心力衰竭等影响心肺功能疾病者;(3)资料不全者;(4)奥马珠单抗治疗疗程未满4个月者。本研究通过南京医科大学附属儿童医院医学伦理委员会批准(批准文号:202008048-1)。患儿监护人均知情同意并签署知情同意书。
按照血清总(基线)IgE水平(30~1 500 IU/mL)及体质量(20~150 kg),依据药品说明书推荐计算奥马珠单抗注射剂量;若基线IgE>1 500 IU/mL时,依据体质量推荐的最大剂量为奥马珠单抗注射剂量。注射部位均为上臂三角区,前3次注射后观察2 h,以后每次注射后观察30 min。参考《奥马珠单抗治疗过敏性哮喘的中国专家共识》[2],治疗2个月及4个月后分别进行疗效评估,必要时调整治疗方案,以后每2个月再次评估。
选择特应性皮炎严重程度指数(SCORAD)[6]、湿疹面积及严重度指数(EASI)[7]、儿童皮肤病生活质量指数(CDLQI)[8]、峰值瘙痒数字评价量表(NRS)[9]评价AD患儿的皮损严重程度、面积、瘙痒及其对生活质量的影响。
奥马珠单抗不良反应包括注射部位局部反应(包括注射部位疼痛、肿胀、红斑、瘙痒),全身反应(包括头痛、发热、上腹痛等),以及过敏反应(包括支气管平滑肌痉挛、低血压、晕厥、荨麻疹、舌头或喉头血管性水肿等)。
应用SPSS 20.0统计学软件对数据进行统计分析。数值以 ±s表示,组间数据比较采用配对t检验,P<0.05为差异有统计学意义。
±s表示,组间数据比较采用配对t检验,P<0.05为差异有统计学意义。
5例患儿接受奥马珠单抗治疗时间为4~19个月,中位治疗时间13个月。5例患儿临床诊断均为AS+AD+AR。治疗前予AS、AR规范化治疗联合抗过敏药物口服、保湿药物外用。在奥马珠单抗治疗开始前1年内均未接受糖皮质激素和其他生物制剂治疗。患儿AS、AR症状控制均可,但AD控制欠佳。例1、2分别在奥马珠单抗治疗2、5个月后联合尘螨特异性免疫治疗,免疫治疗按照常规剂量及疗程,目前已分别持续17个月及13个月,免疫治疗过程中未出现不良反应(表1)。
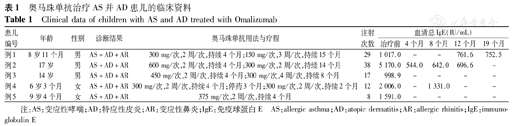
奥马珠单抗治疗AS并AD患儿的临床资料
Clinical data of children with AS and AD treated with Omalizumab
奥马珠单抗治疗AS并AD患儿的临床资料
Clinical data of children with AS and AD treated with Omalizumab
| 患儿编号 | 年龄 | 性别 | 诊断结果 | 奥马珠单抗用法与疗程 | 注射次数 | 血清总IgE(IU/mL) | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 4个月 | 8个月 | 12个月 | 19个月 | ||||||
| 例1 | 8岁11个月 | 男 | AS+AD+AR | 300 mg/次,2周/次,持续4个月;150 mg/次,3周/次,持续15个月 | 29 | 1 017.0 | - | - | 761.6 | 752.5 |
| 例2 | 17岁 | 男 | AS+AD+AR | 600 mg/次,2周/次,持续4个月;300 mg/次,2周/次,持续14个月 | 38 | 5 170.0 | 544.0 | 642.0 | 696.6 | - |
| 例3 | 14岁 | 男 | AS+AD+AR | 450 mg/次,2周/次,持续4个月;300 mg/次,4周/次,持续8个月 | 17 | 998.9 | - | - | - | - |
| 例4 | 6岁3个月 | 女 | AS+AD+AR | 300 mg/次,2周/次,持续4个月;停药3个月;300 mg/次,2周/次,持续2个月 | 12 | 2 006.0 | - | 1 331.0 | - | - |
| 例5 | 9岁4个月 | 女 | AS+AD+AR | 375 mg/次,2周/次,持续4个月 | 8 | 1 591.0 | - | - | - | - |
注:AS:变应性哮喘;AD:特应性皮炎;AR:变应性鼻炎;IgE:免疫球蛋白E AS:allergic asthma;AD:atopic dermatitis;AR:allergic rhinitis;IgE:immunoglobulin E
5例患儿奥马珠单抗具体治疗剂量与用法见表1。例1~5的奥马珠单抗治疗疗程分别为19个月、18个月、12个月、6个月、4个月,其中例4在持续治疗4个月后自行停药3个月,后又持续治疗2个月。
5例患儿基线IgE水平为998.9~5 170.0 IU/mL,中位数1 591.0 IU/mL。例1、2在奥马珠单抗治疗过程中间断检测血清总IgE水平,发现血清总IgE水平有不同程度下降。例2在奥马珠单抗治疗4个月后血清总IgE下降了约89.5%,随后血清总IgE水平较最低水平稍有上升,但维持相对低水平状态。例4在奥马珠单抗治疗4个月后自行停药3个月,再次行奥马珠单抗治疗1个月后检测血清总IgE水平较基线IgE仍有下降(表1)。
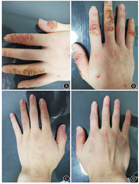
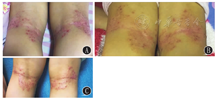
80%的(4/5例)患儿在奥马珠单抗治疗4个月后SCORAD等级下降为中度或轻度(表2)。与治疗前比较,治疗2个月和4个月时5例患儿的SCORAD、EASI、CDLQI、NRS指数均明显下降,差异均有统计学意义(均P<0.05)(表3);例1、2、3在奥马珠单抗治疗后8个月后,SCORAD、EASI、NRS指数(64.00±7.09比37.67±6.45;13.50±3.40比3.20±1.03;8.67±1.15比5.00±2.00)均明显下降,差异均有统计学意义(t=13.70、7.51、5.50,均P<0.05)。例2治疗前手部皮肤可见较多红斑丘疹、糜烂、渗出、结痂以及抓痕(图1)。例4在奥马珠单抗治疗10 d后腘窝处红斑、丘疹、渗出均有减少,苔藓样变改善不明显,奥马珠单抗再次治疗2个月后仍存在红斑、丘疹、渗出、苔藓样变(图2)。



奥马珠单抗治疗前后AS并AD患儿5例AD相关评价指数
AD related evaluation index before and after Omalizumab treatment in 5 children with AS combined with AD
奥马珠单抗治疗前后AS并AD患儿5例AD相关评价指数
AD related evaluation index before and after Omalizumab treatment in 5 children with AS combined with AD
| 患儿编号 | 选择特应性皮炎严重程度指数 | 湿疹面积及严重度指数 | 儿童皮肤病生活质量指数 | 峰值瘙痒数字评价量表指数 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后2个月 | 治疗后4个月 | 治疗后8个月 | 治疗后12个月 | 治疗后18个月 | 治疗前 | 治疗后2个月 | 治疗后4个月 | 治疗后8个月 | 治疗前 | 治疗后2个月 | 治疗后4个月 | 治疗后8个月 | 治疗前 | 治疗后2个月 | 治疗后4个月 | 治疗后8个月 | |
| 例1 | 56.0 | 45.5 | 36.0 | 30.5 | 25.0 | 15.5 | 10.00 | 7.90 | 5.25 | 2.10 | 24 | 19 | 16 | 9 | 8 | 6 | 5 | 3 |
| 例2 | 66.5 | 57.5 | 54.0 | 43.0 | 36.5 | 31.0 | 13.70 | 10.25 | 5.15 | 3.35 | 15 | 14 | 12 | 8 | 10 | 9 | 9 | 7 |
| 例3 | 69.5 | 59.5 | 49.5 | 39.5 | 35.0 | - | 16.80 | 12.20 | 7.10 | 4.15 | 13 | 11 | 10 | 8 | 8 | 7 | 6 | 5 |
| 例4 | 68.0 | 58.0 | 47.0 | 58.5 | - | - | 23.55 | 13.80 | 10.30 | 26.25 | 27 | 23 | 20 | 27 | 9 | 8 | 6 | 8 |
| 例5 | 44.0 | 32.0 | 15.0 | - | - | - | 5.60 | 3.65 | 3.10 | - | 15 | 10 | 8 | - | 8 | 5 | 4 | - |
注:AS:变应性哮喘;AD:特应性皮炎 AS:allergic asthma;AD:atopic dermatitis

AS并AD 5例患儿在奥马珠单抗治疗前以及治疗2个月和4个月后AD相关评价指数比较 ( ±s)
±s)
Comparison of AD related evaluation index before treatment,2 months and 4 months after Omalizumab treatment in 5 children with AS combined with AD ( ±s)
±s)
AS并AD 5例患儿在奥马珠单抗治疗前以及治疗2个月和4个月后AD相关评价指数比较 ( ±s)
±s)
Comparison of AD related evaluation index before treatment,2 months and 4 months after Omalizumab treatment in 5 children with AS combined with AD ( ±s)
±s)
| AD评价量表 | 治疗前 | 治疗后2个月 | 治疗后4个月 | P值(治疗前比治疗后2个月) | t值 | P值(治疗前比治疗后4个月) | t值 |
|---|---|---|---|---|---|---|---|
| 选择特应性皮炎严重程度指数 | 60.80±10.79 | 50.50±11.76 | 40.30±15.62 | <0.01 | 21.025 | 0.001 | 7.833 |
| 湿疹面积及严重度指数 | 13.93±6.81 | 9.56±3.97 | 6.18±2.70 | 0.038 | 3.058 | 0.015 | 4.106 |
| 儿童皮肤病生活质量指数 | 18.80±6.26 | 15.40±5.50 | 13.20±4.82 | 0.014 | 4.185 | 0.007 | 5.199 |
| 峰值瘙痒数字评价量表指数 | 8.60±0.89 | 7.00±1.58 | 6.00±1.87 | 0.016 | 4.000 | 0.007 | 5.099 |
注:AS:变应性哮喘;AD:特应性皮炎 AS:allergic asthma;AD:atopic dermatitis
5例患儿共行奥马珠单抗皮下注射104次,未见不良反应。
AD是一种慢性炎症性皮肤疾病,是AS的重要共患疾病之一,二者均属于变态反应性疾病[10]。在AS并AD患儿血清中存在高水平IgE,伴特异性IgE阳性[11]。因此,抗IgE治疗能特异性抑制IgE高表达、阻断IgE通路传导,用于治疗IgE介导的Ⅰ型变态反应性疾病。奥马珠单抗是唯一的抗IgE人源化单克隆抗体,可剂量依赖性降低触发过敏级联反应的游离IgE数量,同时抑制IgE与高亲和力IgE受体结合,阻断下游信号通路。
研究表明,奥马珠单抗皮下注射后游离IgE水平明显下降,而血清总IgE水平增高,这可能是由于人血清IgE的半衰期为2.4 d,而奥马珠单抗属于IgG型抗体,与IgE结合形成复合物,半衰期延长至26 d。也可能是奥马珠单抗结合并激活IgE阳性的记忆B淋巴细胞,促使IgE生成增多、血清总IgE水平增高[12]。但本研究发现,奥马珠单抗治疗4个月后血清总IgE水平有不同程度下降,血清总IgE包括结合和游离IgE,推测血清总IgE下降的可能原因是游离IgE在血清总IgE中占绝大多数,奥马珠单抗显著减少游离IgE表达,这与Gon等[13]和Korn等[14]报道相一致,奥马珠单抗治疗后血清总IgE水平暂时性上升,但随着奥马珠单抗长期使用,血清总IgE水平总体上趋于下降。因此,检测游离IgE水平对监测IgE水平长期波动情况更为重要。
本研究3例患儿基线IgE水平超过奥马珠单抗推荐剂量范围,本研究按照患儿体质量对应最大剂量为基线IgE超范围时奥马珠单抗治疗剂量,在治疗过程中未见药物相关不良反应,检测血清总IgE水平均明显下降,且临床AD皮损严重程度减轻、面积减少。这说明基线IgE水平超范围时,按体质量范围对应的最高剂量进行奥马珠单抗治疗有效且安全性好。
本研究发现患儿SCORAD、EASI、CDLQI、NRS指数在奥马珠单抗治疗2个月及4个月均较治疗前有显著下降,差异均有统计学意义,这说明奥马珠单抗减轻了AS并AD患儿的皮损严重程度和面积大小,明显改善了瘙痒等症状,提高了生活质量。Velling等[15]在AD并AS患者中研究发现使用奥马珠单抗治疗2个月后,其生活质量得到明显改善。因此,推测奥马珠单抗治疗儿童AD起效时间约为2个月,建议临床使用奥马珠单抗治疗AD满2个月时进行疗效评估。
AD发病机制复杂,除IgE外,树突状细胞、嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞都是AD皮肤炎症的重要参与者[16]。研究表明,奥马珠单抗下调了树突状细胞上IgE受体,阻止IgE介导的肥大细胞的活性增强,对肥大细胞、嗜碱粒细胞和树突状细胞进行非特异性脱敏[17]。奥马珠单抗也减轻了嗜酸性粒细胞介导的皮肤炎症[18]。因此奥马珠单抗作为抗IgE单克隆抗体,作用机制多样,有望成为治疗儿童AD的新型有效分子靶向药物。目前奥马珠单抗治疗AD的有效剂量难以确定。本研究对象均为中重度AS并AD患儿,治疗剂量参考奥马珠单抗治疗AS的推荐剂量或基线IgE超范围时参考体质量范围的最大剂量,发现该剂量对儿童AD的瘙痒、皮炎面积及皮损严重程度等均有明显疗效。其中3例患儿在奥马珠单抗治疗4个月后调整治疗剂量和频率,经临床随访发现,持续小剂量奥马珠单抗5~6 mg/(kg·次)、每2~4周注射1次亦能维持良好的疗效,未见皮炎加重或反复。
本研究中2例患儿在接受奥马珠单抗治疗后联合尘螨特异性免疫治疗,免疫治疗过程未见不良反应。文献报道在特异性免疫治疗时或治疗前加用奥马珠单抗可显著降低过敏反应频率和严重程度,提高对变应原的免疫耐受性和安全性,获得良好的长期治疗效果[19]。联合奥马珠单抗治疗亦显著缩短了达到特异性免疫治疗维持剂量所需时间[20]。因此,奥马珠单抗可作为特异性免疫治疗的辅助药物,但目前奥马珠单抗治疗时机、持续时间和剂量尚不能明确,仍需进一步研究。
综上所述,奥马珠单抗作为抗IgE单克隆抗体,用于治疗IgE介导的变态反应性疾病,其安全性良好,不良反应轻。在中重度AS并AD的儿童中,联合奥马珠单抗治疗明显减轻了AD皮损严重程度、减少了皮炎面积,显著改善生活质量。奥马珠单抗在特异性免疫治疗前使用,提高机体对变应原的免疫耐受性和安全性。因此,奥马珠单抗是一种安全且耐受性良好的治疗中重度AS并AD患儿的药物,其有望成为治疗儿童AD的新型分子靶向药物,可作为变应原特异性免疫治疗的辅助药物加以应用。
所有作者均声明不存在利益冲突



























