
观察反复惊厥持续状态后海马神经元中分子伴侣介导的自噬分子的表达及其与惊厥后脑损伤的关系。
取日龄7 d的SD大鼠,采用简单随机分组方法分为对照组(6只)及惊厥组(39只),惊厥组反复吸入三氟乙醚诱导大鼠的惊厥持续状态,1次/d,30 min/次,连续诱导7 d。成功建立惊厥模型共30只(弃去建模失败9只),采用简单随机分组方法分为末次惊厥后0 h、1.5 h、3 h、12 h、24 h组,每组6只。采用Western blot法及反转录聚合酶链反应(RT-PCR)法观察海马神经元中分子伴侣介导的自噬标记分子[热应激同源蛋白70(Hsc70)、溶酶体相关膜蛋白2a(LAMP-2a)、热休克蛋白(HSP)40及HSP90]的表达,原位末端标记法(TUNEL)检测细胞凋亡。
1.RT-PCR及Western blot显示:与对照组相比,分子伴侣Hsc70表达量在末次惊厥后1.5 h开始升高,持续至惊厥后24 h(P<0.05);HSP90在末次惊厥后立即升高,持续至惊厥后24 h(P<0.01);HSP40及LAMP-2a表达量在末次惊厥发作后也呈现高表达(P<0.05)。2.TUNEL法显示:与对照组(15.16±2.48)/40倍视野相比,惊厥组在末次惊厥后3 h(36.33±5.16)/40倍视野、12 h(44.83±4.83)/40倍视野、24 h(54.83±7.16)/40倍视野,大鼠海马CA1区凋亡细胞数明显增多(均P<0.01)。3.Pearson相关性分析显示发育期反复惊厥持续状态后大鼠海马CA1区的细胞凋亡与分子伴侣标记分子表达呈正相关(Hsc70:r=0.734,P=0.001;LAMP-2a:r=0.790,P<0.001)。
发育期大鼠反复惊厥持续状态发作后,存在多个分子伴侣介导的自噬表达升高,并与细胞凋亡呈正相关,可能参与了发育期反复惊厥发作后脑损伤过程。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
儿童癫痫占癫痫患者总数的2/3,年发病率为(10~42)/10万[1]。在儿童发育期如反复的惊厥发作将影响癫痫患儿的脑发育,并对远期的脑功能造成不良影响[1,2]。研究证实自噬先于凋亡发生,并发现自噬在多种疾病(如神经退行性病变、肿瘤、外伤)中发挥重要作用[3,4,5]。分子伴侣是一类以热应激同源蛋白70(Hsc70)为代表的热休克蛋白(HSP)家族,包括HSP40、HSP90、Hsc70-HSP 90联合蛋白(Hop)、Hsc70相关蛋白(Hip)和Bcl-2结合抗凋亡蛋白(Bag-1)等,在辅助自噬过程以维持细胞内环境稳态过程中发挥重要作用[6,7,8]。有研究发现,作为最常见神经退行性疾病的阿尔茨海默病(AD),分子伴侣可以介导自噬从而清除作为主要病理特征的磷酸化的tau蛋白及β淀粉样蛋白(Aβ)[9,10];同样,与帕金森病致病相关的α-synuclein蛋白也可以在分子伴侣的作用下通过自噬途径进行降解[11],提示分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)有可能成为神经系统疾病治疗的新靶点。而发育期反复惊厥发作后CMA的变化如何?Cao等[12]在成年癫痫大鼠中发现癫痫发作后CMA过程标记分子2a型溶酶体相关膜蛋白(LAMP-2a)mRNA和蛋白均显著增加,抗坏血酸可以通过减少氧化应激水平和LAMP-2a表达而具有保护作用,提示CMA可能参与成年期大鼠癫痫所致脑损伤的病理过程。而在发育期大鼠,CMA的作用如何?本研究拟利用三氟乙醚诱导的发育期大鼠反复惊厥发作模型,观察CMA标记分子Hsc70、HSP40、HSP90和LAMP-2a在惊厥后脑损伤中表达的变化,为临床癫痫的干预与治疗寻找新的可能靶点。
健康清洁级SD大鼠,日龄7 d,体质量19.10~22.68 g,雌雄不限,由苏州昭衍新药研究中心有限公司提供[许可证号SCXK(苏) 2013-0003]。所有大鼠在避强光、避噪声、24 h昼夜循环、自由饮水条件下饲养。
出生7 d(P7)的SD大鼠,适应性喂养1 d后,于出生8 d(P8)简单随机分为对照组(NS组,6只)、惊厥组(RS组,39只)。RS组:将大鼠置于玻璃实验舱(大小为40 cm×20 cm×20 cm)中,通过舱顶的注射孔快速滴入0.04~0.05 mL三氟乙醚,迅速封闭实验舱,约数十秒钟后大鼠出现惊厥状态,惊厥发作行为学评分参考Racine评分法[13]:0级:无惊厥发作;Ⅰ级:面部肌肉抽搐,如节律性咀嚼、眨眼、动须等;Ⅱ级:颈部肌肉抽搐,主要表现为节律性点头;Ⅲ级:单侧前肢阵挛、抽搐,不伴后肢直立;Ⅳ级:阵挛性直立,表现为双侧前肢阵挛、抽搐并伴有后肢直立;Ⅴ级:全身性强直-阵挛发作,表现为双侧后肢强直阵挛,甚至跌倒。本研究将大鼠出现Racine评分标准中Ⅲ级及以上的惊厥行为作为惊厥发作诱导成功。每次注入三氟乙醚诱导的惊厥持续4~5 min。当惊厥进入恢复期,但神志尚未完全恢复时再次滴入相同剂量的三氟乙醚,使大鼠再次出现惊厥状态,从大鼠第1次出现惊厥开始计时,反复诱导惊厥,使惊厥持续30 min,立即将大鼠从实验舱中取出,自然呼吸条件下恢复;每天诱导1次,连续诱导7 d;NS组除不给予三氟乙醚外其他处理与RS组相同。RS组成功建立惊厥模型30只,弃去建模失败9只,采用简单随机分组方法分为末次惊厥后0 h、1.5 h、3 h、12 h、24 h组,每组6只。
于大鼠出生第14天(P14)时,于末次惊厥后0 h、1.5 h、3 h、12 h、24 h各取6只大鼠。对大鼠进行腹腔注射0.4 g/L水合氯醛(1 mL/100 g)麻醉后,心脏取血后立即断头取脑,冰上钝性分离海马,按统一标准选取一侧的海马组织,放入提前预冷的Eppendorf管(EP管)中,一半迅速放入-80 ℃冰箱保存用于反转录聚合酶链反应(RT-PCR)及Western blot法检测及线粒体膜电位检测;另一半脑组织立即置于100 g/L的多聚甲醛中固定,固定至少1周后,根据大鼠立体定位图谱,取含海马结构的一块相邻组织3~5 mm,常规脱水、浸蜡、包埋制作石蜡标本,然后以5 μm厚冠状连续切片,选取含海马组织的相邻三套切片,载玻片涂多聚赖氨酸防脱片,捞片后置62 ℃温箱过夜,分别行HE和原位细胞凋亡的检测。
按照设计在各时间点取得的海马,用预冷的0.01 mol/L PBS洗去血液后尽量剪碎海马组织,并放入10 mL玻璃研磨器中,将3 mL预冷的细胞裂解液加入研磨器后,在冰浴条件下缓慢研磨成匀浆,转移至10 mL离心管,4 ℃,1 600 r/min离心10 min(离心半径9.5 cm),收集上清液,4 ℃、12 000 r/min离心20 min(离心半径9.5 cm),沉淀为线粒体,-80 ℃冰箱中保存备用。
将500 μL细胞裂解液分别装入有大鼠海马组织的EP管中,利用超声波细胞粉碎机进行低温匀浆后在4 ℃12 000 r/min离心15 min(离心半径9.5 cm)后,取上清液分装于EP管,置-80 ℃冰箱保存备用。利用一个装有NanoDrop软件的NanoDrop 2000超微量分光光度计测定蛋白浓度。配胶、电泳、转膜、封闭后,配制一抗反应液,用封口膜机封口,室温下于摇床上摇动2 h,置4 ℃冰箱过夜;弃去一抗反应液,用TBST溶液洗涤,每次10 min,3次,共30 min;加入二抗多克隆抗体溶液中,室温下摇动2 h,同样方法再次洗膜。最后发光液与膜充分接触后将其放在ChemiScope 5200一体式化学发光成像系统内,显影曝光。运用Image-Pro Plus图像处理软件进行分析,得出条带的灰度值。
提取海马总RNA。反转录制备cDNA:10 μL提取的总RNA组织加多聚胸腺嘧啶(oligoDT) 10 μL和焦碳酸二乙酯(DEPC) 10 μL;70 ℃ 5 min后,立即冰浴5 min,3 000 r/min离心10 s(离心半径9.5 cm);在上述混合液中加入M-MLV反转录酶(200 U/μL)1 μL、5×Buffer 5 μL、脱氧核糖核苷酸(dNTPs)5 μL、RNasin (40 U/μL)0.7 μL、DEPC纯水1.3 μL;混匀,3 000 r/min离心10 s(离心半径9.5 cm),42 ℃反应90 min,终止反应,即为cDNA溶液。在合成的cDNA EP管中加入下列试剂,配成PCR反应体系,操作在冰上进行:SYBR Premix ExTaq12.5 μL,上、下游引物各0.5 μL,探针0.3 μL,单蒸水(dH2O) 7.2 μL,cDNA 4 μL,加双蒸水补足反应总体积为25 μL(Hsc70、LAMP-2a、HSP40及HSP90的引物序列见表1)。轻弹管底将溶液混合,置入PCR扩增仪中,预变性:94 ℃,5 min;并进行40个PCR循环;终末延伸:72 ℃,5 min。RT-PCR结果数据的收集和分析采用SDS 1.3软件。根据梯度稀释DNA绘制标准曲线,反应结束后得到各反应管的循环阈值(△Ct,△CT=CT target gene-CT β-actin),检测基因的表达量按照2-△△Ct法对基因表达量进行相对定量。
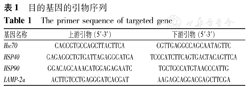
目的基因的引物序列
The primer sequence of targeted gene
目的基因的引物序列
The primer sequence of targeted gene
| 基因名称 | 上游引物(5′-3′) | 下游引物(5′-3′) |
|---|---|---|
| Hsc70 | CACCGTGCCAGCTTACTTCA | CGTTGAGGCCAGCAATAGTTC |
| HSP40 | GAGAGGCTGTGATTAGAGGGATGA | TCCCATCTTCAGTGACTACAGTTCA |
| HSP90 | GGACAGCAAACATGGAGAGAATC | TGCTGCCATGTAACCCATTG |
| LAMP-2a | ACTTGTCCTGAGGGATCACGAT | AAGAGCAGGACGAGCTTCGA |
应用SPSS 17.0软件进行统计学分析,符合正态分布的计量数据以 ±s表示,两组计量资料间比较采用t检验,多组间比较采用单因素方差分析;2个连续性变量的相关性分析采用Pearson相关性分析,P<0.05为差异有统计学意义。
±s表示,两组计量资料间比较采用t检验,多组间比较采用单因素方差分析;2个连续性变量的相关性分析采用Pearson相关性分析,P<0.05为差异有统计学意义。
与NS组相比,大鼠海马神经元自噬的分子伴侣Hsc70表达量在末次惊厥后1.5 h开始升高,持续至惊厥后24 h(P<0.05),其中在惊厥发作后12 h升高最明显(P<0.01)(表2、图1)。
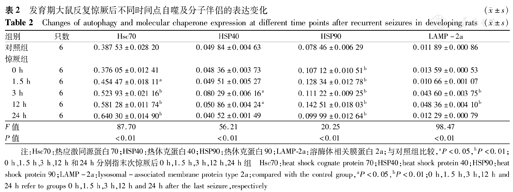
发育期大鼠反复惊厥后不同时间点自噬及分子伴侣的表达变化( ±s)
±s)
Changes of autophagy and molecular chaperone expression at different time points after recurrent seizures in developing rats( ±s)
±s)
发育期大鼠反复惊厥后不同时间点自噬及分子伴侣的表达变化( ±s)
±s)
Changes of autophagy and molecular chaperone expression at different time points after recurrent seizures in developing rats( ±s)
±s)
| 组别 | 只数 | Hsc70 | HSP40 | HSP90 | LAMP-2a | |
|---|---|---|---|---|---|---|
| 对照组 | 6 | 0.387 53±0.028 20 | 0.049 84±0.004 63 | 0.078 46±0.006 29 | 0.011 89±0.000 86 | |
| 惊厥组 | ||||||
| 0 h | 6 | 0.376 05±0.012 41 | 0.048 36±0.003 73 | 0.107 12±0.010 51b | 0.013 59±0.000 53 | |
| 1.5 h | 6 | 0.454 47±0.018 11a | 0.049 51±0.005 27 | 0.128 34±0.012 78b | 0.010 66±0.001 07 | |
| 3 h | 6 | 0.523 93±0.021 16b | 0.080 29±0.006 16a | 0.111 22±0.009 25b | 0.043 60±0.003 75b | |
| 12 h | 6 | 0.581 28±0.011 74b | 0.050 86±0.004 24a | 0.142 51±0.018 03b | 0.048 36±0.004 10b | |
| 24 h | 6 | 0.640 30±0.014 90b | 0.040 52±0.001 49 | 0.099 99±0.012 64b | 0.012 29±0.000 79 | |
| F值 | 87.70 | 56.21 | 20.25 | 98.47 | ||
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | ||
注:Hsc70:热应激同源蛋白70;HSP40:热休克蛋白40;HSP90:热休克蛋白90;LAMP-2a:溶酶体相关膜蛋白 2a;与对照组比较,aP<0.05,bP<0.01;0 h、1.5 h、3 h、12 h和24 h分别指末次惊厥后0 h,1.5 h,3 h,12 h,24 h组 Hsc70:heat shock cognate protein 70;HSP40:heat shock protein 40;HSP90:heat shock protein 90;LAMP-2a:lysosomal-associated membrane protein type 2a;compared with the control group,aP<0.05,bP<0.01;0 h,1.5 h,3 h,12 h and 24 h refer to groups 0 h,1.5 h,3 h,12 h and 24 h after the last seizure,respectively
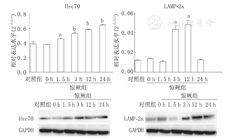

注:RT-PCR:反转录聚合酶链反应;Hsc70:热应激同源蛋白70;LAMP-2a:溶酶体相关膜蛋白 2a;与对照组比较,aP<0.05,bP<0.01 RT-PCR:reverse transcription-polymerase chain reaction;Hsc70:heat shock cognate protein 70;LAMP-2a:lysosome-associated membrane protein type 2a;compared with control group,aP<0.05,bP<0.01
与NS组相比,大鼠海马神经元自噬的分子伴侣LAMP-2a表达量在末次惊厥后3 h开始升高,持续至惊厥后12 h(P<0.01),继之在末次惊厥后24 h下降至正常水平(P<0.05)(图1、表2)。
与NS组相比,大鼠海马分子伴侣自噬复合物相关基因HSP40表达量在末次惊厥后3 h和12 h升高(P<0.01),余时间点与NS组差异无统计学意义(P>0.05)(图2、表2)。
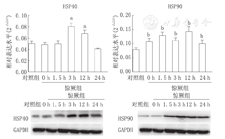

注:RT-PCR:反转录聚合酶链反应;HSP40:热休克蛋白40;HSP90:热休克蛋白90;与对照组比较,aP<0.05,bP<0.01 RT-PCR:reverse transcription-polymerase chain reaction;HSP40:heat shock protein 40;HSP90:heat shock protein 90;compared with control group,aP<0.05,bP<0.01
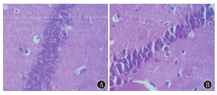
NS组海马CA1区锥体细胞呈橢圆形或圆形,排列紧密、层次分明、边缘清晰、胞质透明,染色质在核内分布均匀、核仁清晰(图3A);反复惊厥后海马CA1区锥体细胞排列散乱、细胞肿胀、碎裂,继之出现如细胞变小、核固缩浓染、染色质边集、细胞外出现空晕等凋亡特征性改变,高峰在惊厥后24 h(图3B)。

光镜下,NS组海马CA1区少见TUNEL阳性细胞,细胞数为(15.16±2.48)/40倍视野(图4A);末次惊厥后0 h及1.5 h,TUNEL阳性细胞数分别为(16.66±2.73)/40倍视野、(18.33±2.16)/40倍视野,与NS组相比差异均无统计学意义;而惊厥后3 h海马CA1区凋亡的锥体细胞数明显增多,达(36.33±5.16)/40倍视野,核块状浓染,呈棕褐色,惊厥后12 h凋亡细胞数增至(44.83±4.83)/40倍视野,与NS组相比,差异有统计学意义(P<0.01);凋亡细胞的表达增多持续至末次惊厥后24 h(54.83±7.16)/40倍视野(图4B)。各组海马CA1区细胞凋亡数见图5。
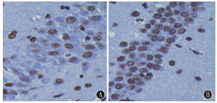

注:TUNEL:原位末端标记法 TUNEL:TdT-mediated dUTP nick-end labeling
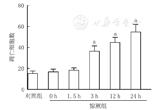

注:TUNEL:原位末端标记法;与对照组比较,aP<0.05 TUNEL:TdT-mediated dUTP nick-end labeling;compared with the control group,aP<0.05
Pearson相关性分析显示,发育期反复惊厥发作后大鼠海马CA1区的细胞凋亡与CMA标记分子Hsc70和LAMP-2a的表达呈正相关(Hsc70:r=0.734,P=0.001;LAMP-2a:r=0.790,P<0.001)。
惊厥是儿童发育期常见的临床症状,反复或长程的惊厥发作对发育期脑发育及远期神经行为、学习、记忆等脑功能造成的不良影响。出生8~10 d的大鼠相当于人类的新生儿期,处于大脑不断发育的特殊时期。因此,本研究选取出生8 d的大鼠为实验对象,利用三氟乙醚吸入诱导反复惊厥发作模型,动态监测大脑中分子伴侣的表达水平,探讨发育期反复惊厥发作后分子伴侣在脑损伤中的作用。
基础实验和临床已经表明,发育期反复或长程惊厥发作,将对未成熟大脑的发育进程和神经元正常功能连接造成影响,影响神经可塑性及脑发育,进而造成远期认知功能缺陷及情感障碍[14]。谭正玲等[15]研究显示孕晚期大鼠惊厥显著降低子代学习与记忆功能。Sogawa等[16]研究亦发现,反复发作的新生儿惊厥大鼠的远期学习能力受损,癫痫发作阈值降低,海马CA3区苔藓纤维发芽,数周后(成年期)大鼠的视觉、空间学习记忆能力下降,惊厥阈值下降,并与谷氨酸受体过度表达相关。本课题组以往研究也显示在新生期反复惊厥发作后,成年期的学习记忆等认知功能将缺损,并与脑内海马苔藓纤维发芽、神经重塑及γ-氨基丁酸(GABA)、N-甲基-D-天冬氨酸(NMDA)受体基因表达有关[17]。因此,寻找发育期反复惊厥的发病机制并通过干预来保护神经元、防止神经细胞死亡是目前发育期惊厥性脑损伤的治疗策略,从而寻找保护神经元和防止神经细胞死亡的治疗靶点具有十分重要的意义。
自噬是细胞内一个重要的生理过程,其能够清除构型异常的蛋白质,并消化受损和多余的细胞器,是真核细胞中广泛存在的降解/再循环系统。自噬包括巨自噬、小自噬和分子伴侣介导的自噬。CMA具有高度选择性,HSP家族作为分子伴侣仅存在哺乳动物细胞,是维持蛋白质稳态的重要成员,在蛋白质的合成、组装及降解中具有重要作用[18]。自噬由多种信号通路调控,可以在饥饿、感染或氧化应激等情况下应激激活。
近年的研究发现,自噬与衰老、肿瘤、代谢性疾病、风湿病、肝炎等疾病密切相关[19,20],其中分子伴侣在自噬过程中发挥重要的作用。而在新的研究中发现,一些神经系统疾病与CMA有关,如在神经系统的毒性损伤时存在分子伴侣表达增高,可能发挥了神经保护的作用[21],但在神经退行性疾病,如帕金森病、AD等发病机制研究过程中发现,错误折叠肽链的装配、运输、细胞内定位、蛋白酶复合体的形成以及最终被溶酶体降解等过程都需要分子伴侣的参与,该类疾病过程中存在CMA功能不足,不能清除异常蛋白,导致异常蛋白聚集而导致发病[22],对于帕金森患者,基于Hsc70介导的自噬的靶向多肽可能通过清除Aβ低聚物而发挥神经保护作用[10]。癫痫发病过程中自噬与分子伴侣的功能如何?国内外均罕见相关的报道。Cao等[12]和曹丽丽等[23]发现在匹罗卡品致成年癫痫持续状态大鼠模型中,癫痫大鼠的海马组织中分子伴侣Hsc70及LAMP-2a基因和蛋白的水平均显著高于对照组,氧化应激标志分子丙二醛含量明显升高,而作为机体内重要的自由基清除剂超氧化物歧化酶(SOD)的水平显著下降,抗坏血酸可通过抑制分子伴侣活性和降低氧化应激反应来减轻癫痫发作中的海马损伤,提示癫痫持续状态后氧化应激能够诱发分子伴侣发生。本研究结果显示,在发育期反复惊厥发作后脑损伤自噬机制中有分子伴侣的参与。本研究PT-PCR及Western Blot结果显示在发育期反复惊厥发作后海马神经元存在多种分子伴侣如Hsc70、HSP40、HSP90等基因迅速被激活,甚至发作结束后立即有HSP90表达升高,说明在发育期反复惊厥发作后能够激活分子伴侣,提示分子伴侣参与了发育期反复惊厥发作后的自噬过程;且CMA标记分子LAMP-2a的转录和合成水平增高,说明三氟乙醚诱导的惊厥持续状态后自噬-溶酶体降解程序的激活可以部分通过分子伴侣介导的LAMP-2a体内合成增加来实现,与既往研究结果一致[12,24]。本研究通过Pearson相关性分析还发现分子伴侣标记分子Hsc70、LAMP-2a的表达与惊厥发作后海马的细胞凋亡呈正相关,说明分子伴侣与发育期反复惊厥发作后脑损伤有关,为进一步寻找新的癫痫干预靶点提供了实验依据。
所有作者均声明不存在利益冲突



























