
探讨儿童急性坏死性脑病(ANE)的临床特点及预后。
回顾性分析2014年1月至2019年9月就诊于华中科技大学同济医学院附属武汉儿童医院的41例ANE患儿的临床资料及随访情况。
41例患儿中,男23例,女18例;起病年龄(4.4±3.2)岁。41例患儿前驱感染以消化道和呼吸道症状为主[分别为20例(48.8%)、19例(46.3%)];前驱感染后迅速出现急性脑病[29例(70.7%)≤2 d],32例(78.0%)出现昏迷,32例(78.0%)出现惊厥,27例(65.9%)出现多器官功能障碍,较少出现休克和弥散性血管内凝血,28例(68.3%)进入重症监护室治疗。头颅磁共振成像(MRI)显示,41例(100.0%)丘脑病变,34例(82.9%)侧脑室周围白质病变,31例(75.6%)脑干病变,26例(63.4%)基底核病变,20例(48.8%)大脑皮质及皮质下病变,18例(43.9%)小脑病变;典型头颅MRI表现为表观扩散系数图上丘脑呈"三色模式"或"双色模式";MRI随访≥6个月显示,出血、囊变、萎缩随病程动态变化。患儿均予糖皮质激素治疗,38例(92.7%)静脉注射丙种球蛋白治疗。7例(17.1%)死亡,存活34例均出现神经功能障碍。
儿童ANE是一种特殊的临床影像综合征,病情进展迅速,临床表现多种多样,头颅MRI具有典型影像学特点并随病程动态演变,该病治疗方法有限,预后欠佳,幸存者多遗留轻重不一的神经功能障碍。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性坏死性脑病(ANE)是一种急性、爆发性重症脑病,多见于儿童,病死率高达30%,幸存者多遗留神经系统后遗症[1]。ANE相对少见,国内关于儿童ANE的大宗病例研究尚不多,为此,本研究对41例ANE患儿的临床及随访资料进行分析,以了解儿童ANE的流行病学、临床特点、影像学特征、治疗及预后,以期提高临床医师对该病的诊治水平。
收集2014年1月至2019年9月华中科技大学同济医学院附属武汉儿童医院住院确诊的41例ANE患儿。本研究通过医院医学伦理委员会批准(批准文号:2019017)。患儿监护人均知情同意。
纳入标准:患儿均符合2007年Mizuguchi等[2]修订的ANE诊断标准:(1)发热性疾病1~3 d后出现急性脑病,必需指标:意识恶化(甚至昏迷);支持指标:惊厥。(2)头部影像学显示对称性、多发性病灶,必需部位:双侧丘脑;支持部位:侧脑室周围白质、内囊、壳核、脑干、小脑。(3)脑脊液(CSF)检查无细胞数升高,常见CSF蛋白水平升高。(4)血清转氨酶升高,血氨正常。(5)排除其他疾病:感染性、代谢性、中毒性、线粒体病、自身免疫性疾病。排除临床资料不完整的病例。
收集患儿一般情况、临床表现、实验室检查、影像学演变、治疗、随访及预后等资料。采用头颅磁共振成像(MRI)评估影像学改变:患儿均在首次入院,病程第2周、第1个月、第3个月、第6个月进行头颅MRI检查,部分病例MRI随访>6个月。均采集T1加权像(T1WI) 、T2加权像(T2WI)、液体衰减反转恢复序列(FLAIR)、弥散加权成像(DWI),部分病例采集表观扩散系数(ADC)图。预后评估:生存结局分为存活和死亡;存活病例随访均>7个月,以最后一次随访的结果做评估,结局分为正常、轻度神经功能障碍、中度神经功能障碍、重度神经功能障碍。运动:正常、轻度异常(有支撑或无支撑行走)、中度异常(有支撑或无支撑坐立)、重度异常(需要支撑才能坐立)。认知:根据Gesell发育量表或韦氏智力测试评估,正常[发育商/智商(DQ/IQ)≥70分]、轻度(50分≤DQ/IQ<70分)、中度(30分≤DQ/IQ<50分)、重度(DQ/IQ<30分)。使用Yamamoto等[3]提出的ANE严重程度评分(ANE-SS)和Wong等[4]提出的MRI评分评价其临床表现、影像学与预后的关系。
采用SPSS 22.0软件对数据进行处理和统计分析。计量资料采用 ±s表示,不同组别间比较应用单因素方差分析。P<0.05为差异有统计学意义。
±s表示,不同组别间比较应用单因素方差分析。P<0.05为差异有统计学意义。
41例ANE患儿中,男23例(56.1%),女18例(43.9%);起病年龄8.9个月~11岁10个月[(4.4±3.2)岁]。23例(56.1%)于冬春季发病。患儿生长发育里程碑均正常,家族均无类似疾病史。
41例(100.0%)病初均出现高热和超高热(39.0~41.0 ℃),以消化道症状[20例(48.8%)]、呼吸道症状[19例(46.3%)]突出,25例(61.0%)经实验室检查发现病原学感染,其中流感病毒感染8例(19.5%)。从前驱感染到出现急性脑病的时间非常迅速[29例(70.7%)≤2 d],大部分出现昏迷[浅昏迷19例(46.3%)、深昏迷13例(31.7%)],32例(78.0%)出现惊厥,7例(17.1%)伴惊厥持续状态。病程中27例(65.9%)出现多器官功能障碍,4例(9.8%)出现休克,5例(12.2%)出现弥散性血管内凝血(DIC),28例(68.3%)入重症监护病房(ICU)治疗,9例(22.0%)行气管插管。
41例均完善了血常规、肝肾功能、电解质、心肌酶、凝血功能、CSF常规及生化检查。(1)血常规:大多正常,6例(14.6%)白细胞计数升高,3例(7.3%)血小板减低(最低52×109/L)。(2)血生化:19例(46.3%)丙氨酸转氨酶(ALT)升高(最高2 202 U/L),32例(78.0%)天冬氨酸转氨酶(AST)升高(最高3 732 U/L),31例(75.6%)乳酸脱氢酶(LDH)升高(最高4 978 U/L),30例(73.2%)磷酸肌酸激酶(CK)升高(最高5 687 U/L)。17例(41.5%)活化部分凝血活酶时间(APTT)延长(最高66 s)。(3)CSF检查:细胞数多正常,5例(12.2%)轻度升高(最高37×106/L);糖、氯化物均正常;24例(58.5%)蛋白升高(最高3.3 g/L)。
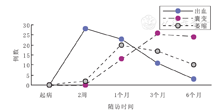
41例首次入院头颅MRI显示,病灶多呈对称分布,病灶累及部位:丘脑41例(100.0%)、侧脑室周围白质34例(82.9%)、脑干31例(75.6%)、基底核26例(63.4%)、大脑皮质及皮质下20例(48.8%)、小脑18例(43.9%)。累积部位数为(4.10±1.56)个。32例(78.0%)DWI示双侧丘脑中央低信号区周围环形高信号,最外层丘脑周围可见低信号区,ADC与之相反,呈"三色模式"(图1A,图1B);9例(22.0%)DWI表现为丘脑中央高信号及边缘低信号,ADC与之相反,呈"双色模式"(图1C,图1D)。34例幸存病例均在病程第2周、第1个月、第3个月、第6个月行头MRI随访(图2),24例MRI随访>1年。病程中28/34例(82.4%)头颅MRI显示出血,多发生在丘脑,病程2周内出现,后逐渐消失,6个月后大部分病例出血消失(图1E,图1F,图1G,图1H),3/24例(12.5%)在病程1年后遗留含铁血黄素沉积(图1L)。26/34例(76.5%)头颅MRI显示囊变,多发生在丘脑及侧脑室周围白质,病程1个月左右可出现,3个月后达到高峰,6个月后部分好转,1年后仍有15/24例(62.5%)存在囊变(图1I);20/34例(58.8%)头颅MRI示脑萎缩,多在1个月时出现,后脑萎缩逐渐可恢复,10/20例(50.0%)在6个月后恢复(图1J,图1K);1年后仍有6/24例(25.0%)存在脑萎缩。
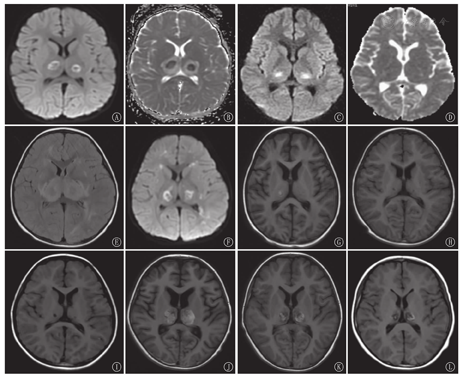

注:ANE:急性坏死性脑病;MRI:磁共振成像;DWI:弥散加权成像;ADC:表观扩散系数;FLAIR:液体衰减反转恢复序列;T1WI:T1加权像 ANE:acute necrotizing encephalopathy;MRI:magnetic resonance imaging;DWI:diffusion weighted imaging;ADC:apparent diffusion coefficient;FLAIR:fluid-attenuated inversion recovery sequence;T1WI:T1 weighted imaging

41例(100.0%)均使用糖皮质激素治疗,38例(92.7%)静脉注射丙种球蛋白治疗,24例(58.5%)使用亚低温治疗,无患儿进行血浆置换。
7例(17.1%)死亡;存活34例随访7个月~5.7年[(2.17±1.64)年],均出现神经功能障碍,其中轻度8例(23.5%)、中度12例(35.3%)、重度14例(41.2%)。使用ANE-SS发现其评分在重度、中度、轻度神经功能障碍间差异无统计学意义(F=0.31,P>0.05)。使用MRI评分发现重度神经功能障碍患儿MRI评分显著高于中度及轻度患儿[重度(3.62±0.65)分,中度(2.83±1.19)分,轻度(2.00±0.76)分],差异有统计学意义(F=7.963,P<0.05)。
早年报道的ANE主要发生于日本和中国台湾,几乎均见于既往体健儿童,发病年龄在5个月~11岁,6~18个月为发病高峰[5,6],近年来越来越多ANE病例在全球报道,婴儿至成人均可发病,并且有复发性或家族性病例[1]。本组病例男女发病无明显差异,发病年龄以婴幼儿多见,发病季节多见于冬春流感高发季节,无复发性或家族性病例。
ANE临床分前驱感染期、急性脑病期、恢复期。本组病例前驱感染以消化道及呼吸道症状为主,病原学包括流感病毒、肺炎支原体、EB病毒、巨细胞病毒等。大多研究认为流感病毒是导致ANE常见的病原之一[1,5,7,8],本组仅8例流感病毒感染。Okumura等[9]认为流感病毒和非流感病毒引起的ANE在临床表现、实验室指标及预后方面均无差异,但在影像学方面,流感病毒更易引起脑干病变。本组8例流感病毒感染病例均有脑干受累,与Okumura等[9]报道一致。ANE起病急骤、进展迅速,本研究发现前驱感染到出现急性脑病的时间大多≤2 d,急性脑病期主要表现为惊厥、意识障碍、多器官功能障碍。值得注意的是,惊厥发生率非常高,且在脑病早期就开始出现,常伴意识障碍加重。本研究中68.3%的病例进入ICU治疗,但较少出现休克和DIC,考虑与近年来本院对ANE的认识提高,及早予以合理治疗及重症监护有关。
ANE实验室指标的变化与发病机制密切相关,最普遍公认的发病机制为"细胞因子风暴",其在神经系统主要导致血脑屏障通透性增加,多灶性脑损伤,可使CSF蛋白水平升高;在全身系统表现为肝功能异常、多器官功能衰竭、休克、DIC等,可出现ALT、AST、LDH、CK升高,血小板减少,APTT延长。本研究中均有这些实验室指标的改变,并且因不同病例而异。有些病例在首次入院时检查正常或轻微异常,但24 h或更长时间后再次检查时可出现明显异常,因此对出现急性脑病的患儿应密切监测上诉实验室指标,予及时诊断和治疗。ANE经典影像为"同心圆"、"三色模式"或"靶形图形"[1,10],主要出现在双侧丘脑,在ADC图上更加明显。病变中心为血管周围出血、神经元坏死和神经胶质细胞增生,ADC显示略高信号;在中心的外围部分ADC显示低信号,为动脉、静脉及毛细血管淤血和少突胶质细胞急性水肿;最外层的ADC高信号为病变渗出,即血管源性水肿。轻型病例血管壁通透性改变轻微,中央无神经元和胶质细胞坏死,且无明显出血,ADC图可能仅表现为中央低信号、外周高信号的"双色模式"[11]。本组中9例患儿DWI序列表现为"双色模式",考虑与疾病的轻重和进行MRI检查的时间截点有关。对称性多灶性脑损害为ANE另一影像学特征,本研究MRI检查发现病灶分布与文献中描述的ANE相似,主要累及丘脑、侧脑室周围白质、脑干、基底核、大脑皮质及皮质下及小脑,病灶多成对称性,也可出现不对称性病灶(主要发生在侧脑室周围白质、大脑皮质及皮质下及小脑)。
ANE影像学是一个与临床、病理生理改变相对应的动态过程[1],疾病早期表现为脑水肿,亚急性期及中期表现为点状出血、坏死,后期出现囊变、萎缩、含铁血黄素沉积等。本研究中这些影像学表现随着ANE的不同病程不断演变。出血多发生在丘脑,也可见基底核区,偶见于脑干,多在病程2周内出现,后逐渐消失,6个月后大部分病例出血消失,少部分1年后遗留含铁血黄素沉积。囊变多发生在丘脑及侧脑室周围白质,可在病程1个月出现,3个月达到高峰,6个月后部分病例囊变好转,1年后仍有大部分存在囊变;脑萎缩多在1个月时出现,后脑萎缩逐渐可恢复,部分可在6个月后恢复,1年后仍有部分存在脑萎缩。了解ANE的影像学演变特点有助于更好地管理该疾病。
ANE既往诊断标准5条中有2条是关于实验室检查,分别为CSF检查无细胞数升高,常见CSF蛋白水平升高;血清转氨酶不同程度升高,血氨正常[2]。文献[5,12]报道的ANE中有少数病例CSF细胞数升高或CSF蛋白正常、血清转氨酶正常(本研究也有类似现象),这些与现有诊断标准相悖,因此,有学者认为诊断标准需根据临床特征进行修订[12]。本课题组建议可根据既往诊断标准进行调整,主要诊断标准为既往诊断标准[2]的(1)、(2)、(5);次要诊断标准为既往诊断标准[2]的(3)和(4)。3条主要诊断标准+1条次要诊断标准可诊断ANE,这样将有利于更多ANE患者得到及时诊治。
ANE无特异性治疗,主要包括糖皮质激素、免疫球蛋白、血浆置换等免疫治疗,亚低温治疗,线粒体修复治疗,重症监护、对症支持治疗,康复治疗等。本组病例早期均使用了免疫治疗,死亡率为17.1%,低于既往报道的30%以上[1,6,8],这与Kim等[13]报道相同,提示早期免疫治疗可提高该病生存率。许多研究认为亚低温可抗细胞因子,减轻免疫炎症反应,能改善ANE预后[1,8,14,15],本研究58.5%的病例使用了亚低温治疗。该病总体预后欠佳,幸存病例均遗留神经功能障碍。有学者认为ANE是自身免疫性神经系统疾病谱中的一种[11],若能在临床上发现可能的自身抗体,单克隆抗体治疗可为ANE治疗提供新选择。
目前关于ANE预后的评分系统主要包括ANE-SS[3]和MRI评分[4]。本研究使用MRI评分得出与Wong等[4]相同的结论,但使用ANE-SS发现其与预后无明显相关性,分析原因可能与本研究病例早期均使用了免疫治疗而较少出现休克和DIC有关,而休克在ANE-SS评分中占3分,反应DIC的实验室指标——血小板减少在ANE-SS评分中占1分。未来研究可进一步探讨更合适的反映预后的临床评分系统。
本研究仅为单中心研究、随访时间截点不一致,仍存在一定局限性。总之,儿童ANE是一种特殊的临床影像综合征,病情进展迅速,临床表现多样,头颅MRI具有典型影像学特点并随病程不断演变,现有诊断标准可根据临床实践进一步修订。该病治疗方法有限,预后欠佳,尚需大样本、长时间随访研究进一步探讨。
所有作者均声明不存在利益冲突



























