
比较类风湿因子(RF)阳性(+)和阴性(-)多关节型幼年特发性关节炎(PJIA)患儿的临床特点、疗效和药物不良反应。
回顾性分析2013年1月至2018年12月华中科技大学同济医学院附属同济医院收治的67例PJIA患儿临床资料,根据RF滴度分为RF(+)组(23例)和RF(-)组(44例),比较2组患儿临床特征、实验室指标及临床疗效。
1.受累关节分布情况:RF(+)组前3位依次为指关节(16例,69.57%)、腕关节(15例,65.22%)和踝关节(13例,56.52%),RF(-)组受累关节依次为膝关节(33例,75.00%)、踝关节(29例,65.91%)和髋关节(26例,59.09%),RF(+)组腕关节受累明显高于RF(-)组,而膝关节受累者低于RF(-)组,差异均有统计学意义(均P<0.01)。2.受累关节磁共振改变:2组关节腔积液(54例,84.38%)、滑膜增厚(44例,68.75%)及骨质水肿(26例,40.63%)常见,RF(+)组骨质破坏(7例,70.00%)及软组织水肿(7例,70.00%)发生率高于RF(-)组(2例,18.18%和2例,18.18%),差异均有统计学意义(均P<0.05)。3.实验室指标变化:RF(+)组C反应蛋白以及红细胞沉降率、抗环瓜氨酸肽抗体和抗核抗体阳性率明显高于RF(-)组(均P<0.05)。4.幼年型关节炎疾病活动评分(JADAS27评分)情况:RF(+)组和RF(-)组组间评分差异无统计学意义[(22.83±5.60)分比(23.07±6.66)分,t=0.148,P>0.05]。5.疗效分析:2例患儿出院后失访,余65例给予传统治疗,其中30例初次住院即予生物制剂以及9例传统治疗失败后改生物制剂治疗,35例生物制剂治疗后疾病活动控制,在不同给药方案中,RF(-)组疾病缓解率普遍高于RF(+)组。
PJIA患者关节受累情况多样化,RF(+)患者容易出现关节破坏,传统治疗疗效差,生物制剂能够有效改善重症PJIA尤其是有预后不良因素患儿的症状,改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
幼年特发性关节炎(JIA)是儿童时期最常见的风湿性疾病,发病率为16/100 000~150/100 000[1]。多关节型JIA(PJIA)是其中亚型之一,指16岁以下儿童在起病6个月内病变累及≥5个关节,导致关节进行性破坏,严重影响患儿的生长发育及心理健康。研究表明PJIA是由遗传、环境及感染等多重因素介导,引起淋巴细胞功能紊乱的自身免疫疾病[2,3]。根据类风湿因子(RF)的表达与否分为RF阴性(-)PJIA(占所有JIA 11%~30%)和RF阳性(+)PJIA(占2%~10%)[1,4]。本研究回顾性分析华中科技大学同济医学院附属同济医院诊治的67例PJIA患儿临床病变特点及治疗效果和安全性,进一步提高PJIA诊断、优化治疗以改善患者预后。
查阅2013年1月至2018年12月在华中科技大学同济医学院附属同济医院儿科初诊住院的67例PJIA患儿病历,其临床诊断和分类均符合2001年国际风湿病联盟PJIA诊断标准[5],临床表现为活动性关节炎,呈对称性,以肿痛为主,部分伴跛行和晨僵,并除外血液系统肿瘤、活动性结核及外伤性关节炎等疾病患儿。其中男17例,女50例(1.00∶2.94);年龄16个月~16岁[(7.04±3.55)岁],2岁以下5例;病程1.4~72.0个月[(12.58±14.72)个月],5例超过24个月。根据RF检查结果,将67例患儿分为RF(+)PJIA组[RF(+)组,23例;起病6个月内最少间隔3个月,存在2次以上RF(+)]和RF(-)PJIA组[RF(-)组,44例]。本研究通过医院医学伦理委员会批准(批准文号:TJ-IRB20210343)。患儿监护人均知情同意,并签署知情同意书。
(1)关节病变; (2)关节磁共振成像(MRI)表现; (3)疾病活动度评价;(4)关节外表现。
(1)部分常规;(2)部分炎性指标; (3)部分免疫学指标; (4)D-二聚体和25羟维生素D3[25(OH)D3]。
(1)口服药:①非甾体抗炎药:布洛芬30~40 mg/(kg·d),或双氯芬酸钠1~3 mg/(kg·d);②抗风湿药:甲氨蝶呤10~15 mg/m2,每周1次,或柳氮磺胺吡啶,初始剂量10~20 mg/(kg· d),逐渐增量至30~50 mg/(kg· d);③糖皮质激素:醋酸泼尼松片口服0.5~1.0 mg/(kg·d),症状缓解后尽快减量至停用。(2)注射制剂:①环磷酰胺(德国,Baxter Oncology GmbH):0.50~0.75 g/m2,每月1次,静脉滴注,6~10次;②注射用重组人Ⅱ型肿瘤坏死因子(TNF)受体-抗体融合蛋白[三生国健药业(上海)股份有限公司]:0.8 mg/(kg·次),每周1次,皮下注射,持续3个月~1年以上;③英夫利西单抗(人鼠嵌合的TNF-α单克隆抗体,瑞士,Cilag AG):3~5 mg/(kg·次),静脉滴注,分别于0、2、6周各1次,以后每间隔8周再使用;④托珠单抗[重组人源化抗人白细胞介素6(IL-6)受体单克隆抗体,罗氏制药Roche]:8 mg/(kg·次),静脉滴注,每月1次,6个月后可根据病情适当延长至2~3个月1次或停药。
采用SPSS 24.0统计学软件进行数据分析。计量资料采用 ±s表示,正态分布两组间比较采用独立样本t检验,非正态分布计量资料组间比较采用秩和检验。计数资料以频数(例)和百分比(%)表示,组间比较采用χ2检验或Fisher′s精确概率法。P<0.05为差异有统计学意义。
±s表示,正态分布两组间比较采用独立样本t检验,非正态分布计量资料组间比较采用秩和检验。计数资料以频数(例)和百分比(%)表示,组间比较采用χ2检验或Fisher′s精确概率法。P<0.05为差异有统计学意义。
64例(95.52%)PJIA患儿首发症状表现为关节肿痛,其中膝关节(18例,26.57%)、踝关节(16例,23.42%)、指关节(15例,21.85%)居前3位。RF(+)组和RF(-)组受累关节前3位依次分别为指关节、腕关节、踝关节和膝关节、踝关节、髋关节,RF(+)组腕关节受累明显高于RF(-)组,而膝关节受累者低于RF(-)组,差异均有统计学意义(均P<0.01),见表1。
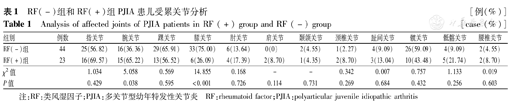
RF(-)组和RF(+)组PJIA患儿受累关节分析[例(%)]
Analysis of affected joints of PJIA patients in RF (+) group and RF (-) group [case (%)]
RF(-)组和RF(+)组PJIA患儿受累关节分析[例(%)]
Analysis of affected joints of PJIA patients in RF (+) group and RF (-) group [case (%)]
| 组别 | 例数 | 指关节 | 腕关节 | 踝关节 | 膝关节 | 肘关节 | 肩关节 | 颞颌关节 | 颈椎关节 | 趾间关节 | 髋关节 | 骶髂关节 | 腰椎关节 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| RF(-)组 | 44 | 25(56.82) | 16(36.36) | 29(65.91) | 33(75.00) | 6(13.64) | 0(0) | 2(4.55) | 1(2.27) | 4(9.09) | 26(59.09) | 4(9.09) | 2(4.55) |
| RF(+)组 | 23 | 16(69.57) | 15(65.22) | 13(56.52) | 6(26.09) | 4(17.39) | 2(8.70) | 1(4.35) | 2(8.70) | 3(13.04) | 10(43.48) | 5(21.74) | 2(8.70) |
| χ2值 | 1.034 | 5.058 | 0.569 | 14.855 | 0.168 | - | - | 0.342 | 0.007 | 0.757 | 1.133 | 0.019 | |
| P值 | 0.429 | 0.038 | 0.595 | <0.001 | 0.726 | 0.114 | 0.731 | 0.269 | 0.684 | 0.432 | 0.256 | 0.603 |
注:RF:类风湿因子;PJIA:多关节型幼年特发性关节炎 RF:rheumatoid factor;PJIA:polyarticular juvenile idiopathic arthritis
67例PJIA患儿,有64例接受了关节MRI平扫,其关节改变以关节腔积液(54例,84.38%)、滑膜增厚(44例,68.75%)、骨质水肿(26例,40.63%)居前3位。比较RF(+)和RF(-)2组PJIA患儿腕关节的MRI改变,发现RF(+)组患骨质破坏及软组织水肿的发生率显著高于RF(-)组,差异有统计学意义(P<0.05),其他关节病变在2组间发生率比较差异均无统计学意义(均P>0.05)(表2)。
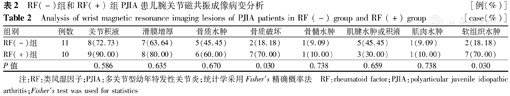
RF(-)组和RF(+)组PJIA患儿腕关节磁共振成像病变分析[例(%)]
Analysis of wrist magnetic resonance imaging lesions of PJIA patients in RF (-) group and RF (+) group [case(%)]
RF(-)组和RF(+)组PJIA患儿腕关节磁共振成像病变分析[例(%)]
Analysis of wrist magnetic resonance imaging lesions of PJIA patients in RF (-) group and RF (+) group [case(%)]
| 组别 | 例数 | 关节积液 | 滑膜增厚 | 骨质水肿 | 骨质破坏 | 骨髓水肿 | 肌腱水肿或积液 | 肌肉水肿 | 软组织水肿 |
|---|---|---|---|---|---|---|---|---|---|
| RF(-)组 | 11 | 8(72.73) | 7(63.64) | 5(45.45) | 2(18.18) | 1(9.09) | 5(45.45) | 1(9.09) | 2(18.18) |
| RF(+)组 | 10 | 9(90.00) | 8(80.00) | 6(60.00) | 7(70.00) | 1(10.00) | 3(30.00) | 1(10.00) | 7(70.00) |
| P值 | 0.586 | 0.635 | 0.670 | 0.030 | 0.738 | 0.659 | 0.738 | 0.030 |
注:RF:类风湿因子;PJIA:多关节型幼年特发性关节炎;统计学采用Fisher′s精确概率法 RF:rheumatoid factor;PJIA:polyarticular juvenile idiopathic arthritis;Fisher′s test was used for statistics
67例PJIA患儿入院治疗前JADAS27评分为(22.99±6.26)分,最高为38.5分,最低为12.0分。均处于疾病活动期,RF(+)组和RF(-)组评分组间差异无统计学意义[(22.83±5.60)分比(23.07±6.66)分,t=0.148,P>0.05]。
对比两组,17.29%(4例)RF(+)和25.00%(11例)RF(-)PJIA患儿入院时发热,4.35%(1例)RF(+)和11.36%(5例)RF(-)PJIA患儿有明显肝脾大,另有3例RF(-)PJIA患儿伴随皮疹(1例为无热性紫红色瘀点样皮疹)。并发症方面,8.70%(2例)RF(+)和20.45%(9例)RF(-)PJIA患儿发育迟滞,身高低于同年龄同性别人身高的第3百分位;2例RF(-)PJIA患儿因就诊前长期不规则口服糖皮质激素并发股骨头坏死,其中1例并发白内障。
28.79%(19/66例)的PJIA患儿WBC>10×109/L;36.92%(24/65例)的患儿Hb下降(<110 g/L);36.92%(24/65例)的患儿PLT升高(>400×109/L);50.75%(34/67例)的患儿ESR增快。57.81%(37/64例)的患儿CRP升高(>10 mg/L),38.78%(19/49例)的患儿IL-6水平升高(>20 ng/L)。52%(26/50例)的PJIA患儿25(OH)D3缺乏(<20 μg/L);而31.75%(20/63例)的PJIA患儿D-二聚体升高(>250 μg/L)。RF(+)组ESR快于RF(-)组(P<0.05),RF(+)组CRP水平升高比例明显高于RF(-)组(P<0.05),RF(+)组D-二聚体升高率明显高于RF(-)组(P<0.05),2组IL-6水平以及25(OH)D3缺乏率比较差异均无统计学意义(均P>0.05)(表3)。
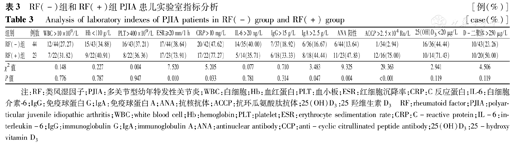
RF(-)组和RF(+)组PJIA患儿实验室指标分析[例(%)]
Analysis of laboratory indexes of PJIA patients in RF(-) group and RF(+) group[case(%)]
RF(-)组和RF(+)组PJIA患儿实验室指标分析[例(%)]
Analysis of laboratory indexes of PJIA patients in RF(-) group and RF(+) group[case(%)]
| 组别 | 例数 | WBC>10×109/L | Hb<110 g/L | PLT>400×109/L | ESR≥20 mm/1 h | CRP>10 mg/L | IL-6>20 ng/L | IgG>15 g/L | IgA>2.5 g/L | ANA阳性 | ACCP>2.5×104 Ru/L | 25(OH)D3<20 μg/L | D-二聚体>250 μg/L |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| RF(-)组 | 44 | 12/44(27.27) | 15/43(34.88) | 16/43(37.21) | 17/44(38.64) | 20/42(47.62) | 14/35(40.00) | 7/37(18.92) | 6/36(16.67) | 6/44(13.64) | 1/34(2.94) | 16/36(44.44) | 10/43(23.26) |
| RF(+)组 | 23 | 7/22(31.82) | 9/22(40.91) | 8/22(36.36) | 17/23(73.91) | 17/22(77.27) | 5/14(35.71) | 6/18(33.33) | 8/18(44.44) | 11/23(47.83) | 12/16(75.00) | 10/14(71.43) | 10/20(50.00) |
| χ2值 | 0.148 | 0.227 | 0.004 | 7.520 | 5.205 | 0.077 | 0.710 | 3.483 | 9.325 | 29.363 | 2.941 | 4.506 | |
| P值 | 0.776 | 0.787 | 0.947 | 0.010 | 0.033 | 0.781 | 0.314 | 0.047 | 0.004 | <0.001 | 0.119 | 0.119 |
注:RF:类风湿因子;PJIA:多关节型幼年特发性关节炎;WBC:白细胞;Hb:血红蛋白;PLT:血小板;ESR:红细胞沉降率;CRP:C反应蛋白;IL-6:白细胞介素-6;IgG:免疫球蛋白G;IgA:免疫球蛋白A;ANA:抗核抗体;ACCP:抗环瓜氨酸肽抗体;25(OH)D3:25羟维生素D3 RF:rheumatoid factor;PJIA:polyarticular juvenile idiopathic arthritis;WBC:white blood cell;Hb:hemoglobin;PLT:platelet;ESR:erythrocyte sedimentation rate;CRP:C-reactive protein;IL-6:interleukin-6;IgG:immunoglobulin G;IgA:immunoglobulin A;ANA:antinuclear antibody;CCP:anti-cyclic citrullinated peptide antibody;25(OH)D3:25-hydroxy vitamin D3
23.64%(13/55例)的PJIA患儿IgG水平升高(>15 g/L),最高达28.69 g/L;25.93%(14/54例)的患儿IgA水平升高(>2.5 g/L),最高达4.86 g/L。RF(+)组IgG和IgA升高率与RF(-)组比较差异无统计学意义(P>0.05)。25.37%(17/67例)的患儿ANA阳性滴度≥1∶100,其中5例滴度≥1∶1 000;RF(+)组ANA阳性率明显高于RF(-)组英夫利西单抗(P<0.01)。26.00%(13/50例)的PIJA患儿抗环瓜氨酸肽抗体(ACCP)水平升高(>2.5×104 Ru/L),RF(+)组升高患儿比例高于RF(-)组,差异有统计学意义(P<0.01)(表3)。
2例[RF(+)和RF(-)PJIA各1例]患儿出院后失访,余65例患儿均予非甾体类抗炎药及改善病情抗风湿药物口服。39例患儿使用生物制剂,共35例经生物制剂治疗后疾病活动最终控制,其中23例应用注射用重组人Ⅱ型TNF受体-抗体融合蛋白,6例疾病控制不佳改用托珠单抗;9例患儿使用英夫利西单抗(最多次数达14次,治疗时间为2.5年),3例给药6个月后疾病控制不佳改用托珠单抗治疗。共16例患儿使用托珠单抗治疗,12例给药后疾病控制,2例中断治疗,2例控制不佳。
对比RF(+)与RF(-)组患儿初次给药治疗方案疗效,RF(-)组疾病缓解率普遍高于RF(+)组,其中3例RF(+)患儿和8例RF(-)患儿应用非甾体类抗炎药+改善病情抗风湿药物口服3~6个月后疾病缓解;8例RF(+)患儿和16例RF(-)患儿应用环磷酰胺,50.00%(4例)的RF(+)患儿和56.25%(9例)的RF(-)患儿在应用6~12个月后疾病缓解;11例RF(+)患儿和13例RF(-)患儿应用TNF拮抗剂(包括注射用重组人Ⅱ型TNF受体-抗体融合蛋白和英夫利西单抗),54.55%(6例)RF(+)和84.62%(11例)的RF(-)患儿在应用6~24个月后疾病缓解;此外,分别有1例RF(+)患儿和5例RF(-)患儿应用托珠单抗,目前均处于疾病缓解期。
出院患儿每隔1~3个月随访1次,观察一般临床表现、关节炎活动情况及实验室炎性指标等,随访最长者为4年10个月。1例在治疗2年后并发巨噬细胞活化综合征死亡。24例应用环磷酰胺治疗的患儿出现10次胃肠道反应,9次急性上呼吸道感染,2次急性支气管炎,2次肺炎,2次肝功能损害及1次过敏性皮疹,无出血性膀胱炎表现。4例应用托珠单抗患儿出现4例无菌性白细胞尿,1例应用英夫利西单抗出现过敏反应。
PJIA累及关节数目多,活动性关节炎重,是导致关节短期和长期残疾的严重疾病,与关节受累较少的JIA儿童相比,往往更加复杂,治疗难度更大[8]。结合本研究与目前国内报道的PJIA临床病例[9,10],PJIA患者女性较多,发病年龄以学龄期及青春期为主,受累关节最多见于踝关节、指关节及膝关节,较少累及中轴关节。值得重视的是,在本研究中,就诊前存在生长发育迟滞患者并不少见,而这与国内对JIA患者对早期诊治及规范治疗缺乏足够重视密切相关。
RF在类风湿关节炎(RA)的诊断及判断预后中有重要的临床意义,但其他的结缔组织病也普遍存在,包括系统性红斑狼疮、干燥综合征、硬皮病及JIA。一项加拿大研究表明,PJIA患者,尤其是RF(+)的PJIA患者,进入疾病缓解的可能性较小,并且治疗上使用类固醇和生物制剂治疗的可能性更高[11]。在本研究中不同RF亚组的临床特点有差异,RF(+)PJIA患儿表现具有成人类风湿关节炎的特点,RF(+)组腕关节累及率高,RF(-)组膝关节累及率高;RF(+)组腕关节出现骨质破坏及软组织水肿的比例更高,CRP及ESR升高率高于RF(-)组,以及治疗上RF(+)组对不同治疗方案的疾病缓解率普遍低于RF(-)组。由此可见,RF与PJIA患者的预后密切相关。另外研究发现,RF和ACCP阳性是JIA关节损伤的最相关预测因子[12],PJIA中ACCP抗体的流行程度不同,但通常与RF状态一致[13]。而在本研究中,RF(+)组ACCP抗体阳性率明显高于RF(-)组,ACCP抗体分布情况基本同RF,进一步证实ACCP抗体表达和RF密切相关。
PJIA患者由于病程长,病情进展复杂,治疗目的应该多维:控制疼痛,保持关节及肌肉功能,诱导疾病缓解,管理全身并发症和促进正常的身体和心理发展[4]。2011年ACR在≥5个关节JIA患者治疗建议中,提出TNF-α拮抗剂作为一线生物制剂[14],多项临床研究证实TNF-α拮抗剂能有效缓解PJIA患者病情,改善预后[15,16]。托珠单抗是第1个靶向拮抗IL-6受体的全人源化单克隆抗体,能同时拮抗膜结合性及可溶性IL-6受体,在国内全身型JIA患者应用的疗效及安全性得到肯定[17,18]。2013年,托珠单抗成为第3个批准用于治疗多关节型JIA的一线生物制剂[19]。目前国内托珠单抗治疗PJIA的临床报道甚少,但国外已进行多项临床研究。2014年的一项随机对照双盲临床试验(CHERISH)研究数据表明托珠单抗不仅能够有效控制PJIA疾病活动,并且能够降低JIA疾病复发率[20]。Horneff等[19]对比观察托珠单抗及TNF-α拮抗剂包括阿达木单抗及依那西普治疗PJIA患者的疗效、安全性及依从性的研究中,发现托珠单抗对比阿达木单抗及依那西普疗效相当,不良事件发生率最低,依从性最高。在本研究中,9例对TNF-α拮抗剂治疗无效和2例对环磷酰胺治疗无效的患儿在应用托珠单抗给药6~12个月后均达到疾病缓解,进一步反映托珠单抗能够有效治疗难治性PJIA患者。所以对于难治性PJIA患者治疗,托珠单抗作用疗效不容小觑,兼具安全性及依从性。
综上所述,PJIA女性患儿多见,以对称性关节肿痛为临床特点,关节畸形及骨质破坏不少见,RF与疾病炎症因子及关节破坏密切相关,生物制剂的应用(包括IL-6受体拮抗剂)极大改善了PJIA患儿的预后。但由于本研究样本量不多,对于生物制剂在PJIA的应用仍需要更多的临床研究去证实其远期疗效和安全性。
所有作者均声明不存在利益冲突



























