
总结手术治疗以癫痫性痉挛(ES)为主要发作形式患儿的临床特点及手术预后,分析与预后相关的因素,提高对此类患儿手术及术前定位的认识。
回顾性分析北京大学第一医院儿童癫痫中心2014年6月至2015年12月经手术治疗以ES为主要发作形式的患儿资料。收集患儿人口学特征、发作形式、病因、脑电图、头颅磁共振成像(MRI)、手术方式、病理及预后。采用Engel分级评估患儿手术效果。通过比较疗效良好(Engel Ⅰ)和疗效不良(Engel Ⅱ~Ⅳ)患儿的特点探索预后相关因素。
共收集25例患儿,其中男16例(64.0%),女9例(36.0%);起病年龄(0.81±0.68)岁,手术时年龄(2.98±1.63)岁,手术时病程(2.17±1.48)年。84.0%(21/25例)的患儿有多种发作形式,局灶性发作(19例)最常见。所有患儿头颅MRI均有明确病变,11例(44.0%)累及1个脑叶,14例(56.0%)累及多脑叶或半球。最常见的病因为局灶性皮质发育不良(13例),其次为发育性肿瘤(3例)。患儿均行切除性手术,其中病变切除3例,单脑叶切除9例,多脑叶离断3例,大脑半球离断10例。随访4.0~5.5年,1例失访,余24患儿中,EngelⅠ级18例(75.0%),EngelⅡ级2例(8.3%),Engel Ⅳ级4例(16.7%)。癫痫预后良好组与预后不良组单因素比较显示,发作间期脑电图异常与病灶相一致者预后良好(P=0.006)。
1.手术治疗对病灶明确的ES患者效果肯定。2.间期脑电图异常与病灶相一致可能提示手术预后良好。3.如ES有局灶性起源的可能且符合药物难治性癫痫,应尽早排查有无结构性病因。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
癫痫性痉挛(ES)是婴儿期起病的癫痫发作形式中常见的发作形式,在婴儿期起病的癫痫发作形式中占13.0%~45.5%,病因复杂、治疗困难[1,2,3,4,5,6,7]。既往认为ES为全面性发作,不适合行手术治疗。研究发现ES亦可局灶起始,部分患者行癫痫外科手术治疗可达到无发作状态[8]。因ES的特殊性,如起始难以定位,常伴多种发作形式,脑电多为多灶或广泛性放电,在此类患者中寻找致痫区存在较大的难度和风险。本研究回顾性总结25例以ES为主要发作形式患儿的癫痫发作症状学、药物治疗、头颅磁共振成像(MRI)、脑电图(EEG)、病因学、手术方式及术后恢复情况,以期提高临床医师对本病的认识。
回顾性收集25例2014年6月至2015年12月在北京大学第一医院儿童癫痫中心行癫痫灶切除/离断术以ES为主要发作形式患儿的人口学特征、神经影像学、病理学、手术和预后资料。入组标准:(1)以ES为主要发作形式;(2)符合药物难治性癫痫[应用正确选择且能耐受的2种抗癫痫药物(单药或联合用药),仍未能达到持续无发作];(3)年龄≤18岁;(4)术后随访≥4年。排除标准:(1)行迷走神经刺激术者;(2)行姑息性手术者,如胼胝体离断等。本研究通过北京大学第一医院医学伦理委员会批准(批准文号:2016005),患儿监护人均知情同意,并签署知情同意书。
收集患儿一般信息包括性别、出生日期及癫痫发作症状学和癫痫相关资料(起病年龄、发作形式、频率、药物治疗等)。通过询问里程碑发育、粗大运动、精细运动、语言、学习等方面来评估患儿手术前后的发育情况。应用光电数字脑电监测系统对患儿行长程视频脑电图(video-EEG)监测,监测方法按照国际10-20系统安放19导记录电极,至少监测3次有效的惯常癫痫发作。患儿间期EEG分为2组[8,9]:(1)背景异常或间期放电有定侧或定位意义即与病灶相一致,背景不对称(慢波,电压降低),间期放电表现为一侧放电、局灶放电、多灶放电但一侧突出;(2)背景或间期放电无定侧意义,背景双侧对称,间期放电表现为高度失律,广泛性或多灶性放电。头颅MRI采用Philips Achieva 3.0T TX磁共振扫描仪及32通道头线圈进行扫描,序列包括轴位3D T1加权成像(T1WI)、轴位T2加权成像(T2WI)、轴位3D液体衰减翻转恢复序列等。癫痫外科手术信息的收集包括手术日期、手术方式、手术切除范围及术后病理。根据末次随访的癫痫预后情况,应用Engel分级将患儿分为癫痫预后良好组(Engel Ⅰ)和预后不良组(Engel Ⅱ~Ⅳ),从以下方面分析能预测癫痫预后的指标:(1)ES与头颅影像学的一致性;(2)ES发作期脑电图与头颅影像学的一致性;(3)局灶性发作(PS)与头颅影像学的一致;(4)PS发作期脑电图起始与头颅影像学的一致性;(5)脑电图背景异常与头颅影像学的一致性;(6)间期异常放电与头颅影像学的一致性;(7)有无"全面性发作";(8)病因。
通过门诊就诊、再入院或电话随访获得随访资料,术后3个月、6个月各随访一次,之后每年随访一次。
使用SPSS 22.0统计学软件进行统计分析,分类变量使用频数和百分比表示,连续变量使用 ±s、中位数或范围表示。预后相关因素均为分类变量,各因素在不同预后的2组间比较采用Fisher′s精确检验。P<0.05为差异有统计学意义。
±s、中位数或范围表示。预后相关因素均为分类变量,各因素在不同预后的2组间比较采用Fisher′s精确检验。P<0.05为差异有统计学意义。
共收集患儿25例。其中男16例(64.0%),女9例(36.0%)。起病年龄1 d~2岁[(0.81±0.68)岁],手术时年龄1~9岁[(2.98±1.63)岁],手术时病程0.5~7.0年[(2.17±1.48)年]。病程中口服药物3~8种(中位数为4种),手术时口服药物2~5种(中位数为3种)。术前22例(88.0%)患儿智力运动发育落后于同龄儿,3例智力运动发育同同龄儿。在术后随访的24例患儿中,3例术前发育正常的患儿术后仍正常,18例(75.0%)智力运动较术前进步,但仍落后于同龄儿,3例术后无进步,见表1。
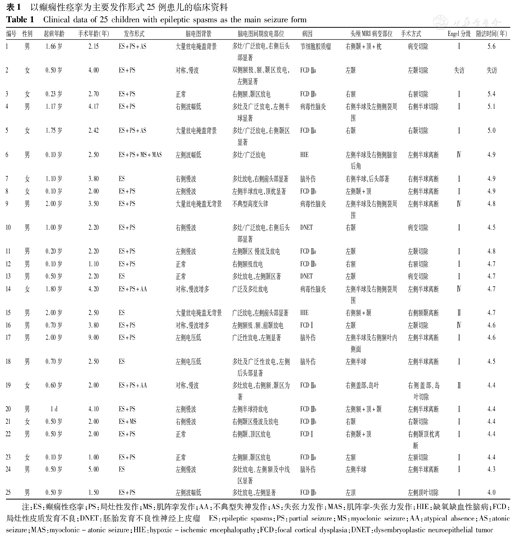
以癫痫性痉挛为主要发作形式25例患儿的临床资料
Clinical data of 25 children with epileptic spasms as the main seizure form
以癫痫性痉挛为主要发作形式25例患儿的临床资料
Clinical data of 25 children with epileptic spasms as the main seizure form
| 编号 | 性别 | 起病年龄 | 手术年龄(年) | 发作形式 | 脑电图背景 | 脑电图间期放电部位 | 病因 | 头颅MRI病变部位 | 手术方式 | Engel分级 | 随访时间(年) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 男 | 1.66岁 | 2.15 | ES+PS+AS | 大量放电掩盖背景 | 多灶/广泛放电,右侧后头部显著 | 节细胞胶质瘤 | 右侧颞+顶+枕 | 病变切除 | Ⅰ | 5.6 |
| 2 | 女 | 0.50岁 | 4.00 | ES+PS | 对称,慢波 | 双侧额极、额、颞区放电,左侧显著 | FCD Ⅱa | 左颞 | 左颞切除 | 失访 | 失访 |
| 3 | 女 | 0.23岁 | 2.70 | ES+PS | 正常 | 右侧额、颞区放电 | FCD Ⅱb | 右额 | 右额切除 | Ⅰ | 5.4 |
| 4 | 男 | 1.17岁 | 4.17 | ES+PS | 右侧波幅低 | 多灶及广泛放电,左侧半球显著 | 病毒性脑炎 | 右侧半球及左侧侧裂周围 | 右侧半球切除 | Ⅰ | 5.1 |
| 5 | 女 | 1.75岁 | 2.42 | ES+PS+AS | 大量放电掩盖背景 | 多灶/广泛放电,右侧颞区显著 | FCD Ⅱa | 右颞 | 右颞切除 | Ⅰ | 5.0 |
| 6 | 男 | 0.10岁 | 2.50 | ES+PS+MS+MAS | 左侧波幅低 | 多灶/广泛放电 | HIE | 左侧半球及右侧侧脑室后角 | 左侧半球离断 | Ⅳ | 4.9 |
| 7 | 女 | 1.10岁 | 3.80 | ES | 右侧慢波 | 多灶放电,右侧前头部显著 | 脑外伤 | 右侧半球,后头部著 | 右侧半球离断 | Ⅰ | 4.9 |
| 8 | 女 | 0.10岁 | 2.00 | ES+PS | 左侧慢波 | 左侧半球放电,顶枕显著 | FCD Ⅱb | 左侧颞+顶 | 左侧半球离断 | Ⅰ | 4.9 |
| 9 | 男 | 2.00岁 | 3.50 | ES+PS | 大量放电掩盖无背景 | 不典型高度失律 | 病毒性脑炎 | 左侧半球及右侧侧裂周围 | 左侧半球离断 | Ⅳ | 4.8 |
| 10 | 男 | 1.00岁 | 2.20 | ES+PS | 右侧慢波 | 多灶/广泛放电,右侧后头部显著 | DNET | 右颞 | 病变切除 | Ⅰ | 4.5 |
| 11 | 男 | 0.20岁 | 2.20 | ES+PS | 左侧慢波 | 左侧颞区慢波及放电 | FCD Ⅱa | 左颞 | 左颞切除 | Ⅰ | 4.8 |
| 12 | 男 | 0.10岁 | 1.10 | ES+PS | 正常 | 右侧额极放电 | FCD Ⅱb | 右额 | 右额切除 | Ⅰ | 4.7 |
| 13 | 男 | 0.50岁 | 2.20 | ES | 正常 | 多灶放电,左侧颞区著 | DNET | 左颞 | 病变切除 | Ⅰ | 4.7 |
| 14 | 女 | 1.80岁 | 4.20 | ES+PS+AA | 对称,慢波增多 | 广泛及多灶放电 | 病毒性脑炎 | 左侧半球及右侧侧裂周围 | 左侧半球离断 | Ⅳ | 4.7 |
| 15 | 男 | 2.00岁 | 2.50 | ES | 大量放电掩盖无背景 | 广泛放电,左侧前头部显著 | HIE | 右侧额+颞 | 右侧额颞离断 | Ⅱ | 4.7 |
| 16 | 男 | 0.70岁 | 3.80 | ES+PS | 对称,慢波增多 | 左侧额极、额、前颞放电 | FCD Ⅰ | 左颞 | 左颞切除 | Ⅳ | 4.6 |
| 17 | 男 | 2.00岁 | 9.00 | ES+PS | 左侧电压低 | 广泛性放电,左侧显著 | 脑外伤 | 左侧半球及右侧额叶内侧面 | 左侧半球离断 | Ⅰ | 4.6 |
| 18 | 男 | 0.70岁 | 2.50 | ES | 左侧电压低 | 多灶及广泛性放电,左侧后头部显著 | 脑外伤 | 左侧半球 | 左侧半球离断 | Ⅰ | 4.5 |
| 19 | 女 | 0.60岁 | 2.00 | ES+PS+AA | 对称,慢波 | 多灶放电,右侧额、颞区为著 | FCD Ⅱa | 右侧盖部,岛叶 | 右侧盖部、岛叶切除 | Ⅱ | 4.4 |
| 20 | 男 | 1 d | 4.10 | ES+PS | 左侧慢波 | 左侧半球持放电 | FCD Ⅱb | 左侧额+顶+颞 | 左侧半球离断 | Ⅰ | 4.4 |
| 21 | 女 | 0.50岁 | 2.00 | ES+MS | 右侧慢波 | 右侧颞区慢波及放电 | FCD Ⅱb | 右颞 | 右颞切除 | Ⅰ | 4.4 |
| 22 | 男 | 0.50岁 | 2.00 | ES+PS | 正常 | 右侧颞、顶区放电 | FCD Ⅰ | 右侧颞+顶 | 右侧颞顶枕离断 | Ⅰ | 4.4 |
| 23 | 女 | 0.10岁 | 1.00 | ES+PS | 正常 | 左侧额、颞区放电 | FCD Ⅱa | 左额 | 左额切除 | Ⅰ | 4.4 |
| 24 | 男 | 0.50岁 | 5.00 | ES | 左侧慢波 | 多灶放电,左侧额及中线区显著 | 脑外伤 | 左侧半球 | 左侧半球离断 | Ⅰ | 4.3 |
| 25 | 男 | 0.50岁 | 1.50 | ES+PS | 左侧波幅低 | 多灶放电,左侧显著 | FCD Ⅱb | 左顶 | 左侧顶叶切除 | Ⅰ | 4.0 |
注:ES:癫痫性痉挛;PS:局灶性发作;MS:肌阵挛发作;AA:不典型失神发作;AS:失张力发作;MAS:肌阵挛-失张力发作;HIE:缺氧缺血性脑病;FCD:局灶性皮质发育不良;DNET:胚胎发育不良性神经上皮瘤 ES:epileptic spasms;PS:partial seizure;MS:myoclonic seizure;AA:atypical absence;AS:atonic seizure;MAS:myoclonic-atonic seizure;HIE:hypoxic-ischemic encephalopathy;FCD:focal cortical dysplasia;DNET:dysembryoplastic neuroepithelial tumor
25例患儿均有ES,其中4例(16.0%)只有ES。12例患儿(48.0%)为对称性ES发作,13例患儿(52.0%)为不对称性ES发作,且有定侧价值。除ES外,局灶性发作最常见,共19例(76.0%)患儿。6例(24.0%)有"全面性发作",与真正的全面性发作可能机制不同,但在症状学和EEG上无发作区分,故在本研究中亦称之为"全面性发作"。结果见表1。
背景及间期脑电图特点见表1。发作期EEG特点:(1)ES发作期EEG中7例(28.0%)有定侧意义;(2)局灶性发作期EEG:在19例(76.0%)有局灶性发作的患儿中,7例(36.8%)发作起始EEG具有定侧意义,10例(52.6%)患儿具有定侧和定位意义,其中额起始4例(21.1%),颞起始3例(15.8%),额颞起始2例(10.5%),顶、枕及后颞起始1例(5.3%);(3)"全面性发作"发作期脑电图:无定侧和定位意义。
患儿均行头颅MRI,均有病变,其中11例(44.0%)累及1个脑叶,14例(56.0%)累及多脑叶或半球。18例行病理检查。根据病因不同将其分为获得性病因和先天性病因(表1):(1)获得性病因,即既往各种脑损伤因素导致的结构性改变,共9例(37.5%)。(2)先天性病因共16例(62.5%),其中局灶性皮质发育不良(FCD)13例(81.2%),发育性肿瘤3例(18.8%)。胚胎发育不良性神经上皮瘤(DNET)2例,节细胞胶质瘤1例。
25例患儿均行切除性手术,其中病变切除3例(12.0%),单脑叶切除9例(36.0%),多脑叶离断3例(12.0%),大脑半球离断10例(40.0%)。
25例患儿术后随访4.0~5.5年,其中随访时间≥5年者4例(16.0%),随访时间4~<5年者20例(80.0%),1例患儿失访。随访的24例患儿中,手术时病程为0.5~7.0年[(2.17±1.48)年],其中20例患儿手术时病程<36个月,其无发作率为75%,3例患儿手术时病程>50个月,但术后均无发作。24例患儿末次随访时,Engel Ⅰ级18例(75.0%),Engel Ⅱ级2例(8.3%),Engel Ⅳ级4例(16.7%)。比较癫痫发作预后良好组和预后不良组的临床及脑电指标,发现发作间期脑电图有定侧意义(P=0.006),与预后良好相关(表2)。
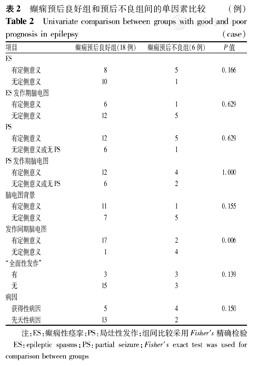
癫痫预后良好组和预后不良组间的单因素比较(例)
Univariate comparison between groups with good and poor prognosis in epilepsy(case)
癫痫预后良好组和预后不良组间的单因素比较(例)
Univariate comparison between groups with good and poor prognosis in epilepsy(case)
| 项目 | 癫痫预后良好组(18例) | 癫痫预后不良组(6例) | P值 | |
|---|---|---|---|---|
| ES | ||||
| 有定侧意义 | 8 | 5 | 0.166 | |
| 无定侧意义 | 10 | 1 | ||
| ES发作期脑电图 | ||||
| 有定侧意义 | 6 | 1 | 0.629 | |
| 无定侧意义 | 12 | 5 | ||
| PS | ||||
| 有定侧意义 | 12 | 5 | 0.629 | |
| 无定侧意义或无PS | 6 | 1 | ||
| PS发作期脑电图 | ||||
| 有定侧意义 | 12 | 4 | 1.000 | |
| 无定侧意义或无PS | 6 | 2 | ||
| 脑电图背景 | ||||
| 有定侧意义 | 11 | 1 | 0.155 | |
| 无定侧意义 | 7 | 5 | ||
| 发作间期脑电图 | ||||
| 有定侧意义 | 17 | 2 | 0.006 | |
| 无定侧意义 | 1 | 4 | ||
| "全面性发作" | ||||
| 有 | 3 | 3 | 0.139 | |
| 无 | 15 | 3 | ||
| 病因 | ||||
| 获得性病因 | 5 | 4 | 0.150 | |
| 先天性病因 | 13 | 2 | ||
注:ES:癫痫性痉挛;PS:局灶性发作;组间比较采用Fisher′s精确检验 ES:epileptic spasms;PS:partial seizure;Fisher′s exact test was used for comparison between groups
ES是低龄儿童常见的癫痫发作症状。导致ES的病因复杂多样,可为遗传性、代谢性病因,亦可为结构性病因。对于结构性病因所致的药物难治性ES患者,其术后的无发作率与局灶性发作患者相似[10,11,12,13,14,15]。
本研究是一个随访时间较长的关于具有ES的药物难治性癫痫的术后疗效及临床特点研究。Barba等[11]及Chipaux等[16]分别报道了80例和68例行手术治疗的以ES为主要发作形式的患儿预后情况,术后无发作率分别为61.3%和74.6%,研究结果与本研究相似。Chipaux等[16]在研究中发现术后预后与病程相关,手术时病程<36个月的患者其术后无发作率可达87.9%,但若手术时病程>50个月其无发作率为64.7%。Chugani等[17]的研究也得到了类似结果。本研究随访的24例患儿中,手术时病程为0.5~7.0年[(2.17±1.48)年],其中20例患儿手术时病程<36个月,其无发作率为75%,3例患儿手术时病程>50个月,但术后均无发作。这提示如患儿选取合适,即使其病程较长仍可取得较好的预后。伴ES的患儿多伴发育落后甚至倒退,Asarnow等[18]研究发现此类患儿术后认知可得到较明显的进步。本研究25例患儿术前有22例(88.0%)智力运动发育落后于同龄儿,3例患儿术前发育正常。在术后随访到的24例患儿中,3例术前发育正常的患儿术后发育仍正常。余21例患儿中,18例(75.0%)患儿术后智力运动仍较同龄差,但较术前有进步。故对于此类患儿,虽然有多种药物可试用,但若符合药物难治性癫痫应考虑是否有手术的可能,尽早行术前评估。
对ES的认识是一个逐渐深入的过程,ES最初被认为是全面性癫痫发作的一种,有ES的患者不建议手术治疗。Branch和Dyken[19]在1979年对1例由脉络丛乳头状瘤导致的以ES为主要表现的7月龄婴儿实施手术,术后无发作,之后不同的研究证实ES也可局灶起始[8,16]。2017年的国际抗癫痫联盟(ILAE)分类中,将ES归为运动性发作的一种既可为局灶性发作,也可为全面性发作或起始不明的发作[20,21]。ES在术前评估中所占权重较小,虽然部分ES不对称有一定的定侧价值,但多数痉挛发作无定位价值。本研究25例患儿中,有13例(52.0%)患儿的痉挛发作有定侧价值,但不同患儿的病变累及多个部位,无定位价值。除ES发作外,具有ES的患者常有多种发作形式[8,16],如局灶性发作、肌阵挛发作、强直发作等。虽然肌阵挛发作等"全面性发作"无定侧及定位价值,但局灶性发作对于此类患者在术前评估有重要意义。在临床工作中,若发现患者有刻板的不对称痉挛和/或局灶性发作,提示ES有局灶性起源的可能,对是否能手术治疗具有重要提示意义。
药物难治性具有ES的患者应由癫痫团队仔细评估。头颅MRI、头皮EEG、正电子发射断层扫描(PET)等非侵入性检查在ES患者的术前评估定位中具有重要意义[16]。研究发现,约50%的ES患者有MRI上可辨认的病变。一项纳入了216例具有ES的患者研究中,93例(43.1%)有MRI可见的病变[22]。而在ES患者手术的报道中,MRI的阳性率更高(72.3%~96.3%)[8,11,16,17]。且MRI是否能发现异常与术后的无发作率密切相关,Hur等[23]随访了9例MRI阴性患者,术后无发作率从术后1年的77.7%下降至术后3年的28.6%。头颅MRI异常与手术预后密切相关,但部分弥漫或双侧脑损伤/脑结构异常不适合做切除性手术,所以在术前评估过程要证实神经影像学异常与症状学、EEG异常是否一致。研究发现在一侧或局灶性放电的患者中,其术后的无发作率达70%以上,发作间期放电和影像学一致性与术后的预后呈正相关[8,23]。本研究亦发现了这一特点,预后良好组和预后不良组发作间期EEG异常与病变部位相一致与预后良好密切相关。这一结论对如何确定致痫区具有指导意义,对术后的预后也有预测价值。
综上,局灶起源的ES术后效果与局灶性发作的术后效果相似。间期EEG异常与头颅影像学病灶相一致与术后预后相关。在临床工作中,如发现患者有刻板的不对称痉挛和/或有局灶性发作,提示ES有局灶性起源的可能;如符合药物难治性癫痫,应尽早排查结构性病因,实施手术治疗。本研究的局限性在于:(1)研究为回顾性研究,样本量较小,应扩大样本量,进一步探讨影响癫痫预后的相关因素;(2)术前术后的功能评估大部分是通过门诊问诊、电话随访获得,未行详细发育评估量表,应增加详细的发育评估量表进行评估。
所有作者均声明不存在利益冲突



























