
了解儿童裂隙脑室综合征(SVS)的临床特点,提高儿科医师对SVS的认识。
回顾性收集2015年6月至2019年5月首都医科大学附属北京儿童医院急诊科确诊的SVS患儿病历资料,分析其临床特点。
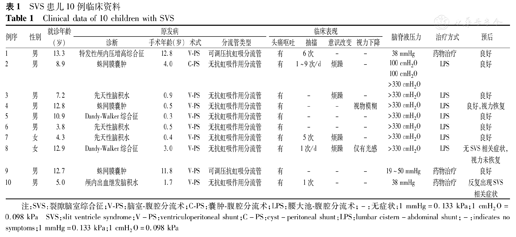
共纳入10例患儿,原发病分别为蛛网膜囊肿3例、先天性脑积水3例、Dandy-Walker综合征2例、特发性颅内压增高综合征1例、颅内出血后继发脑积水1例。首次分流手术年龄为1.3(0.3~12.8)岁,确诊SVS时的年龄为9.9(3.8~13.3)岁,分流术后4.4(0.5~12.0)年出现SVS相关症状:不同程度的间断头痛(10/10例)、呕吐(10/10例)、精神烦躁(4/10例)、抽搐发作(5/10例)、视力下降(2/10例)、颅内压增高(10/10例)等。SVS发生时,患儿脑室形态均呈裂隙样。3例经甘露醇治疗症状缓解后未行手术,7例内科治疗无效后急诊行腰大池-腹腔分流术。随访1~5年,9例未再出现SVS相关症状,1例内科治疗患儿的病情多次反复。
SVS系分流术后的罕见并发症,主要临床特点为间断头痛、分流管泵充盈迟缓;影像学示脑室呈裂隙样改变。分流术后出现颅高压征象,且影像学未见脑室扩张时,需高度警惕SVS。SVS患儿如药物治疗无效,应尽早手术,以改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
裂隙脑室综合征(SVS)是脑室-腹腔分流术、囊肿-腹腔分流术后,由于脑脊液过度引流而导致的一种严重的、急性期可危及生命的并发症。间断性头痛、分流管泵充盈迟缓、影像学示脑室呈裂隙样改变为SVS三联征[1]。迄今为止,国内外关于SVS的报道较少,由于临床医师对其临床症状、影像学特点认识不足,易漏诊或误诊,从而延误治疗使得预后不良。本研究回顾性收集10例SVS患儿的临床资料,并分析总结其临床特点,以期提高儿科医师对该病的认识。
选取2015年6月至2019年5月就诊于首都医科大学附属北京儿童医院急诊科,确诊为SVS的10例患儿为研究对象。其中男8例,女2例;均接受囊肿-腹腔分流术和/或脑室-腹腔分流术。患儿原发病分别为蛛网膜囊肿3例、先天性脑积水3例、Dandy-Walker综合征2例、特发性颅内压增高综合征1例、颅内出血后继发脑积水1例。患儿因原发病首次行分流手术的年龄为1.3(0.3~12.8)岁,其中5例为1岁以内即行首次手术;分流术后4.4(0.5~12.0)年开始出现SVS相关症状,确诊SVS时的年龄为9.9(3.8~13.3)岁;首次出现SVS相关症状至确诊为SVS的时长为1.5(0.3~6.0)个月,患儿均在就诊2~7次后方确诊SVS。纳入标准:既往曾行脑室-腹腔分流术或囊肿-腹腔分流术,同时满足间断性头痛、分流管泵充盈迟缓、影像学上脑室呈裂隙样改变3个主要特征诊断为SVS的患儿[1]。排除标准:(1)分流管已拔除者;(2)颅内感染者;(3)分流管堵塞、脱落者。本研究通过首都医科大学附属北京儿童医院医学伦理审查委员会批准(批准文号:2020-Z-032),并豁免监护人知情同意。
采用回顾性方法对SVS患儿临床资料进行总结分析。随访以门急诊随访为主,电话随访为辅。随访间隔为每0.5年1次,随访内容包括是否有头痛、呕吐、抽搐、视觉症状。观察指标:(1)一般资料:性别、年龄、原发病诊断、原发病分流手术时间、术式及分流管类型;(2)临床表现,包括头痛、呕吐、抽搐、意识改变、视觉症状等;(3)实验室检查:脑脊液压力、细胞数、生化以及病原学检测;颅内压监测;(4)影像学检查:分流术前、术后,以及SVS发作时的头颅电子计算机断层扫描(CT)、头颅磁共振成像(MRI)改变;(5)干预方案及预后。
本研究为描述性分析,其中计量资料用中位数(范围)表示。
共纳入10例SVS患儿,其中8例植入无抗虹吸作用的普通分流管,另2例为抗虹吸作用的可调压分流管。患儿临床资料、分流手术术式、手术时间、分流管类型等见表1。
SVS患儿10例临床资料
Clinical data of 10 children with SVS
SVS患儿10例临床资料
Clinical data of 10 children with SVS
| 例序 | 性别 | 就诊年龄(岁) | 原发病 | 临床表现 | 脑脊液压力 | 治疗方式 | 预后 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 诊断 | 手术年龄(岁) | 术式 | 分流管类型 | 头痛呕吐 | 抽搐 | 意识改变 | 视力下降 | ||||||
| 1 | 男 | 13.3 | 特发性颅内压增高综合征 | 12.8 | V-PS | 可调压抗虹吸分流管 | 有 | 6次 | - | - | 38 mmHg | 药物治疗 | 良好 |
| 2 | 男 | 8.9 | 蛛网膜囊肿 | 4.0 | C-PS | 无抗虹吸作用分流管 | 有 | 1~9次/d | 烦躁 | - | 100 cmH2O | LPS | 良好 |
| 100 cmH2O | |||||||||||||
| >330 cmH2O | |||||||||||||
| 3 | 男 | 7.2 | 先天性脑积水 | 0.9 | V-PS | 无抗虹吸作用分流管 | 有 | - | 烦躁 | - | >330 cmH2O | LPS | 良好 |
| 4 | 男 | 12.8 | 蛛网膜囊肿 | 0.5 | V-PS | 无抗虹吸作用分流管 | 有 | - | - | 视物模糊 | >330 cmH2O | LPS | 良好,视力恢复 |
| 5 | 男 | 10.9 | Dandy-Walker综合征 | 0.3 | V-PS | 无抗虹吸作用分流管 | 有 | - | - | - | >330 cmH2O | LPS | 良好 |
| 6 | 男 | 3.8 | 先天性脑积水 | 0.5 | V-PS | 无抗虹吸作用分流管 | 有 | - | - | - | >330 cmH2O | LPS | 良好 |
| 7 | 女 | 4.3 | 先天性脑积水 | 0.4 | V-PS | 无抗虹吸作用分流管 | 有 | 5次 | 烦躁 | - | >330 cmH2O | LPS | 良好 |
| 8 | 女 | 12.9 | Dandy-Walker综合征 | 3.0 | V-PS | 无抗虹吸作用分流管 | 有 | 1次/d | 烦躁 | 仅有光感 | >330 cmH2O | LPS | 无SVS相关症状,视力未恢复 |
| 9 | 男 | 12.7 | 蛛网膜囊肿 | 11.8 | V-PS | 可调压抗虹吸分流管 | 有 | - | - | - | 19~50 mmHg | 药物治疗 | 良好 |
| 10 | 男 | 5.0 | 颅内出血继发脑积水 | 1.7 | V-PS | 无抗虹吸作用分流管 | 有 | 1次 | - | - | 38 mmHg | 药物治疗 | 反复出现SVS相关症状 |
注:SVS:裂隙脑室综合征;V-PS:脑室-腹腔分流术;C-PS:囊肿-腹腔分流术;LPS:腰大池-腹腔分流术;-:无症状;1 mmHg=0.133 kPa;1 cmH2O=0.098 kPa SVS:slit ventricle syndrome;V-PS:ventriculoperitoneal shunt;C-PS:cyst-peritoneal shunt;LPS:lumbar cistern-abdominal shunt;-:indicates no symptoms;1 mmHg=0.133 kPa;1 cmH2O=0.098 kPa
10例患儿在分流术后4.4(0.5~12.0)年开始出现SVS相关症状,包括不同程度的间断头痛(10/10例)、呕吐(10/10例)、精神烦躁(4/10例),其他原因无法解释的抽搐发作(5/10例)、视力下降(2/10例)、颅内压增高(10/10例)等。10例患儿的首发症状均为头痛,初期通过卧床休息头痛可缓解;但随时间进展,头痛逐渐剧烈,且持续时间长、难以缓解。3例患儿剧烈头痛时出现心动过缓和高血压。6例患儿行眼底检查,未发现视乳头水肿和/或眼底出血;但病例8术前出现视力下降,仅有光感,术后眼底检查及视觉诱发电位显示为双侧视神经萎缩改变;病例4术前出现视物模糊,经手术干预后恢复正常。
患儿均在急诊就诊期间行头颅CT检查,多数患儿急诊就诊时头痛剧烈难以耐受MRI,故仅个别患儿(例10)急诊完善头颅MRI检查。SVS发生时,头颅CT示脑室形态呈裂隙样、分流管位置贴壁。患儿脑室-腹腔分流术前、术后以及发生SVS时的头颅影像学表现见图1,图2。
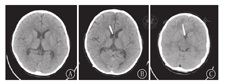

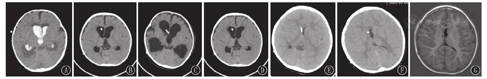

患儿均在出现头痛期间行脑脊液检查,脑脊液细胞数、生化结果均正常,病原学检测阴性。7例腰椎穿刺时行脑脊液测压,其压力均>330 cmH2O(1 cmH2O=0.098 kPa);其中例2行3次腰椎穿刺测压,2次头痛缓解时测压为100 cmH2O,第3次在抽搐发作停止后1 h测压,压力>330 cmH2O。另3例行连续颅内压监测,压力为19~50 mmHg(1 mmHg=0.133 kPa),经甘露醇治疗后颅内压均恢复正常。
患儿均接受过静脉注射甘露醇治疗。其中7例因外院已予甘露醇治疗较长时间,症状仍无改善,故确诊SVS后即行腰大池-腹腔分流术;术后48 h,头痛、呕吐症状均缓解。例1、9、10予甘露醇治疗,头痛有所缓解,颅内压监测也显示压力曾降至正常。因例1、9均植入了可调压抗虹吸作用分流管,且确诊SVS时间距分流术尚不足1年,故暂未予手术干预;病例10症状有反复,每次仍予甘露醇治疗。所有患儿随访至2020年5月,随访时间1~5年。7例手术治疗的患儿未再出现头痛、呕吐及抽搐等症状。3例内科治疗患儿中,例1、例9也未出现相关症状;但例10于出院后6个月、17个月再次出现头痛、呕吐及抽搐等症状,但监护人拒绝手术干预。伴视觉改变的患儿中,例4视力恢复正常,而例8双眼仅有光感。
SVS是脑室-腹腔分流、囊肿-腹腔分流术后出现的罕见并发症。目前公认间断头痛、分流管泵充盈迟缓、影像学脑室呈裂隙样改变为SVS临床表现三联征。由于既往对SVS的认识存在差异,其发病率目前尚不清楚,现有文献报道SVS发病率为0.9%~37.0%[2,3]。
SVS仅发生在植入分流管的患儿中,发病机制尚未完全清楚。越来越多的学者认为SVS是多因素共同作用的结果,其中虹吸作用导致脑脊液过度引流、脑脊液静脉系统血流动力学改变是其主要病理生理学基础[4]。脑脊液引流至颅外可使颅骨-脑比例失调,导致脑室形态改变,从而使脑室壁易塌陷而堵塞脑室内分流管;而分流产生的虹吸作用会使脑脊液长期过度引流,脑室变小,分流管脑室端可发生功能性梗阻;随着脑脊液不断蓄积、颅内压逐渐升高,可出现颅高压症状[1]。早期时,脑室顺应性尚可,脑室压力升高到一定程度后,脑室可轻微扩张,分流管功能恢复、梗阻缓解,颅高压症状可短暂消失;但长时间反复出现的颅高压使得室管膜纤维化、神经胶质增生、脑室壁硬度增加[5],此时脑室顺应性下降、扩张受限,梗阻难以缓解,导致颅内压持续恶性升高。此外,脑脊液过度引流者的颅内静脉可扩张,跨壁压波动时,大静脉比小静脉的管腔变化更明显,即使是跨壁压轻微改变也可使大静脉迅速塌陷[6];颅内静脉管腔塌陷使得急性静脉流出梗阻、静脉压升高,导致颅内压力升高;颅高压又会加重静脉窦受压,形成恶性循环。
本研究10例患儿中,5例首次行分流术时<1岁,8例最初选择无抗虹吸作用的分流管。研究发现,首次分流术的年龄偏小,因颅内感染、颅脑外伤、导水管狭窄所致的继发性脑积水,以及植入功能单一的分流管者更易发生SVS[7,8]。分流术后可出现脑脊液过度引流,尤其是应用无抗虹吸分流管者,且随患儿身高的增加,其虹吸效应逐渐增大。因此,SVS一般于分流术后数月至数年出现,平均为分流术后6.5年[9]。本研究10例患儿出现SVS症状时间为分流术后4.4(0.5~12.0)年,与既往报道[9]基本一致。
SVS患儿临床症状常间断出现,与颅内压反复异常波动有关,包括间断性头痛、呕吐,严重时可有烦躁、抽搐发作、视力下降等。本研究10例患儿在症状发作时均测得颅内压增高,其中7例行腰椎穿刺测脑脊液压力>330 cmH2O,另3例行颅内压监测示颅内压为19~50 mmHg。虽然本研究并未观察到低颅压表现,但方铁等[10]和Laura等[4]研究显示,SVS症状缓解时颅压可呈负值,可能与脑脊液过度引流有关。SVS的间断头痛与间断出现的高颅压或低颅压有关。颅高压所致的头痛等症状早期多可自行缓解,但颅内压反复增高到一定程度后,因大脑顺应性进一步下降,分流管功能性梗阻无法解除,加之脑静脉的血流动力学变化,颅高压症状渐加重且难以缓解。部分患儿的脑顺应性非常差,对分流管梗阻异常敏感,在SVS早期就出现严重的临床症状。需注意的是,除了SVS,分流术后出现头痛的原因还有分流管堵塞、脱落、移位、感染等,应予以鉴别[11]。
本研究中有2例患儿出现视力下降,1例术后恢复正常,另1例后期双侧视神经萎缩,仅存光感。关于儿童SVS眼部并发症的研究也显示,部分患儿后期可出现视神经萎缩[12],系因颅高压影响前、后视觉通路和动眼神经,还可压迫小脑幕边缘的大脑后动脉,导致枕叶缺血,出现单眼或双眼同侧偏盲[13]。视乳头水肿亦提示分流障碍可能,但也有研究认为视乳头水肿可能并非儿童颅高压的敏感指标,可能会延误对极高颅压的判断[14]。本研究中6例行眼底检查的患儿也并未发现明显视乳头水肿,可能与颅内压升高是逐步发生、而非短期内快速升高有关。因SVS的颅高压可致永久性视力丧失,故应重视分流术后出现的任何视觉症状,必要时可能需要急诊手术干预。
本研究10例患儿诊断时头颅影像学均示脑室呈裂隙样,即SVS独特的影像学特征。通常脑脊液长期过度引流导致脑室缩小,急性静脉梗阻迅速进展时,脑室并不会扩大;若静脉窦压力高于分流泵压力时,分流泵开放、脑脊液引流,脑室进一步缩小,最终呈裂隙样脑室。可采用额枕角比率(FOHR)评估裂隙样脑室,即轴位侧脑室层面额角与枕角最大宽度的平均值/双顶径。FOHR正常值约为0.37,与年龄无关;FOHR≤0.2时,考虑裂隙样脑室[7]。值得注意的是,并非所有脑室呈裂隙样的患儿均为SVS,SVS诊断须具备相应临床症状。研究显示,分流术后超过50%的患儿可能会出现裂隙样脑室的征象,但仅6%~22%最终为SVS[15,16]。
本研究中的患儿确诊SVS年龄为9.9(3.8,13.3)岁,从出现症状至确诊SVS的时长为1.5(0.3~6.0)个月,辗转就诊多次(2~7次)后确诊,考虑系临床医师对SVS临床表现及影像学特点认识不足所致。临床中,当分流术后患儿出现头痛、呕吐等颅高压症状,且头颅影像学提示脑室无增大或呈裂隙样,应高度警惕SVS的可能。
SVS治疗包括药物治疗和外科干预,药物治疗可缓解症状,但不能根本性解决脑脊液引流障碍;外科干预目的是重建脑脊液生理循环通路。关于药物选择和手术策略尚有争议。呋塞米、甘露醇、地塞米松和抗偏头痛药物可能在一定程度缓解症状[17]。过量静脉补液和卧床对部分病例有效,而脱水疗法存在争议[9,18]。本研究中有3例患儿仅药物治疗,其中2例(例1、9)为植入可调压抗虹吸作用分流管后1年内发生SVS,虽目前内科治疗有效,但仍需进一步随访观察;另1例(例10)首次诊断SVS后监护人一直要求药物治疗,拒绝手术干预,故症状多次反复,这也反映SVS症状药物治疗可能暂时有效,但随着脑顺应性下降,后期症状会反复、病情加重。本研究治疗经验建议药物治疗后仍有病情反复者,应尽早考虑手术干预,以减少颅内压异常波动和脑组织顺应性下降的风险。
外科手术方式很多,包括更换为可调压抗虹吸分流泵、再次脑室-腹腔分流、腰大池-腹腔分流等,具体术式依病情而定。本研究中7例手术患儿均采用腰大池-腹腔分流术,系因单纯更换分流泵不能确保原脑室端引流管的通畅性良好,且因脑室缩小,重置分流管常需术中导航,手术繁琐、花费大、脑室穿刺造成脑组织损伤的风险也相对较大。腰大池-腹腔分流术操作相对简单,损伤及风险较低,但术前需确保侧脑室与腰大池间的通畅[19]。应用抗虹吸作用的分流管可降低因过度引流导致的并发症[20]。基于生理学考量,越来越多的外科医师常规选择抗虹吸作用分流管。理论上抗虹吸作用分流管会避免脑脊液过度引流,但实际并没未完全阻止SVS的发生。本研究中2例患儿植入抗虹吸作用分流管后仍然发生SVS。
综上,SVS发生于脑室-腹腔分流、囊肿-腹腔分流术后,间断头痛、分流管泵充盈迟缓、影像学示脑室呈裂隙样改变为其临床表现三联征。临床医师要对分流术后出现颅高压征象的患儿给予充分重视,尤其是影像学未见脑室扩张时需高度警惕SVS。颅内压极高者一旦药物治疗无效,应尽早手术、重建脑脊液循环通路,从而改善预后。
所有作者均声明不存在利益冲突



























