随着社会的发展及经济条件的改善,我国儿童常见呼吸道病原免疫预防水平取得了长足的进步,儿童呼吸道感染发病率及死亡率在过去十几年中大幅下降,但与国际领先水平国家相比,尚存在一定差距,这与公众对疫苗接种认知不足、接种人员预防接种服务水平参差不齐等诸多因素有关。本共识在综合分析国内外儿童常见呼吸道病原免疫预防临床证据的基础上,结合我国临床现状及专家临床经验,就儿童常见呼吸道病原传播特点、临床表现、免疫预防等提出了建议,为进一步指导儿童常见呼吸道病原免疫预防工作提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
呼吸道感染(respiratory tract infections,RTI)是儿童常见的呼吸系统疾病,可引起机体产生不受控制的全身性炎症反应,进而发生感染性休克、急性呼吸窘迫综合征、肺炎、脑炎、多器官衰竭等症状。RTI常与呼吸道病原相关,主要包括麻疹病毒(measles virus,MeV)、流感病毒(influenza virus)、水痘-带状疱疹病毒(varicella-zoster virus,VZV)、冠状病毒(coronavirus,CoV)、呼吸道合胞病毒(respiratory syncytial virus,RSV)、腺病毒(adenovirus,AdV)、百日咳杆菌(bordetella pertussis)、白喉杆菌(corynebacteriums diphtheria)、流感嗜血杆菌(haemophilus influenzae,Hi)、结核分枝杆菌(mycobacterium tuberculosis,MTB)、脑膜炎奈瑟菌(neisseria meningitidis,Nm)及肺炎链球菌(streptococcus pneumonia,Spn)等。呼吸道病原的流行给人类带来了巨大的疾病负担,正如全球大流行的新型冠状病毒(SARS-CoV-2),截至2021年7月8日,全球累计确诊病例184 820 132例,死亡4 002 209例[1]。疫苗接种是RTI及其严重并发症预防,减少病原传播的最经济、有效的手段,如流感疫苗、麻腮风疫苗、百白破疫苗、Hi疫苗、Spn疫苗等儿童常见呼吸道病原预防疫苗均可为儿童提供较好的免疫保护。近年来,我国各级疾病预防控制中心(简称疾控中心)在疫苗接种知识宣传、接种技术培训以及疫苗相关不良反应的管理上发挥了重要作用,我国儿童常见呼吸道病原免疫预防水平取得了长足的进步。然而,相较于国家免疫规划疫苗,非免疫规划疫苗接种率仍普遍较低。因此,提高公众对疫苗接种的认知,规范疫苗接种服务,制定相应的疫苗接种指导意见尤为必要。在综合分析国内外儿童常见呼吸道病原免疫预防临床证据的基础上,结合我国临床现状及专家临床经验,制定了《儿童常见呼吸道病原免疫预防专家共识》。本共识适用于从事相关病原防控的各级疾控中心工作人员,预防接种点的接种人员,各级医疗机构儿科、呼吸科、感染科等医务人员。根据国内外研究进展,本共识今后亦需要定期更新、完善。
麻疹、风疹和流行性腮腺炎均是儿童常见的急性传染病,其中麻疹和风疹为发疹性传染病。这3种疾病不仅在全球流行广泛,而且也是威胁我国儿童健康的重要传染病。三者的病原体均为RNA病毒,且均只有1个血清型。
麻疹的病原体为MeV,MeV属副黏病毒科MeV属。目前全球发现A~H 8个进化枝至少24个基因型[2],我国流行的优势基因型为H1型。世界卫生组织(World Health Organization,WHO)估计2018年全球约近1 000万例麻疹病例和约14.2万死亡病例[3]。麻疹可有喉炎、肺炎、心肌炎、脑炎及亚急性硬化性全脑炎等多种并发症,其中肺炎是导致麻疹患儿死亡的最主要原因。
流行性腮腺炎的病原体为腮腺炎病毒(mumps virus,MuV),属副黏病毒科MuV属,MuV根据SH蛋白基因的差异分为A、B、C、D、F、G、H、I、J、K、L、N 12个基因型,中国的主要流行毒株为F基因型,目前全球范围内正在使用的减毒活疫苗毒株主要是A基因型,不同基因型病毒抗原产生的抗体具有交叉保护性[4,5]。MuV可引起脑膜脑炎、睾丸炎、心肌炎、胰腺炎、肾炎等严重并发症。2008年起含腮腺炎成分疫苗加入国家计划免疫,2008年我国共报告流行性腮腺炎310 826例,2009年共报告299 329例,2020年共报告129 120例,患病人数呈下降趋势[6,7,8]。
风疹也称为德国麻疹,由风疹病毒(rubella virus,RV)引起,RV为披膜病毒科RV属,RV有2个分支共13个基因型,其中12个为正式基因型(1B、1C、1D、1E、1F、1G、1H、1I、1J、2A、2B、2C),另外1个为临时基因型(1a)。当前我国流行的优势基因型为1E、2B基因型[9]。风疹通常是一种自限性疾病,但可以并发心肌炎、关节炎、肾炎、肝炎及脑炎等。妊娠前12周的RV感染对宫内发育的胎儿可能是灾难性的,可导致流产、早产、宫内胎儿死亡、宫内发育迟缓和先天性风疹综合征(congenital rubella syndrome,CRS),出生的第1年死亡率很高,85%有低出生体质量。2008年起含风疹成分疫苗加入国家计划免疫,2009年共报告风疹69 860例,发病率较2008年降低42.25%;虽然2019年较2018年风疹感染人数增加28 609例,但在2020年又降至2 201例,发病率为0.156 8/10万[6,7,8,10,11]。
麻疹和风疹传染源均为感染病毒的患者,流行性腮腺炎传染源为腮腺炎患者和健康病毒携带者,3种疾病均主要通过呼吸道飞沫传播,也可通过接触传播。
麻疹在人群中普遍易感,冬春季是发病高峰。麻疹好发于6月龄~5岁儿童。我国1978年开展计划免疫后,麻疹的发病率得到了有效控制,然而局部地区仍有小范围流行,主要与少数儿童未接种麻疹疫苗或未进行强化再接种有关。麻疹的潜伏期为6~18 d,平均为10 d左右,前驱期主要为发热和上呼吸道及眼结膜炎所致的卡他症状,此期具有诊断意义的是麻疹黏膜斑(Koplik斑)。出疹期体温升高,淡红色斑丘疹自耳后发际开始,渐及额、面、颈,延至躯干及四肢,疹间皮肤正常。恢复期皮疹按出疹的先后顺序消退,疹退后皮肤有棕色色素沉着。出疹前后5 d有传染性,有并发症患者可延长至出疹后10 d。
流行性腮腺炎终年均有发病,在春、冬季节多发,主要发生在3~16岁的儿童和青少年,我国流行性腮腺炎疫情呈现高度散发与局部暴发并存状态,学校为该病的主要发生场所[12]。造成该病流行的主要因素为该病的疫苗接种率低,且该病疫苗首次接种的保护效果不稳定。流行性腮腺炎潜伏期为14~25 d,平均18 d。腮腺炎早期为一些非特异的症状,如发热、头痛、呕吐、肌痛、厌食和全身不适等。随后出现腮腺肿痛,可表现为单侧,70%~80%的患者双侧腮腺肿大,腺体肿胀约3 d内达到峰值,维持2 d后慢慢消退。
风疹一年四季均可发病,但以冬春季为主,多见于学龄前期或学龄期儿童。传染源为风疹患者,潜伏期一般为14~21 d。前驱期症状轻微,可出现低热、头痛、眼痛、咽喉痛,耳后和枕部淋巴结大是风疹最具特征性的临床表现。发热1~2 d后出现淡红色斑丘疹,最早见于面部,1 d内可遍布全身,多在3 d内消退,疹退后不留色素沉着。孕早期RV感染可导致多种出生缺陷,白内障、先天性心脏缺陷和感觉神经性耳聋是CRS的典型三联征,还可致视网膜病变、腭裂或唇裂、小头畸形以及肝炎、间质性肺炎和脑膜炎等[13]。
MeV、RV和MuV具有稳定的抗原性,接种疫苗是预防这3种传染性疾病最有效的措施。WHO建议所有儿童接种2剂次含麻疹疫苗(measles vaccine,MCV),在麻疹死亡风险性高的国家,推荐9月龄接种第1剂MCV,15~18月龄接种第2剂MCV(2剂间隔最短为4周);在婴儿麻疹感染危险性较低的国家,可在12月龄接种第1剂MCV,15~18月龄接种第2剂MCV[14]。但近年数据显示,在已经消除或接近消除国家及地区出现了疫情反弹的情况[15],2016年至2017年全球报告的麻疹病例增加了31%[16]。
儿童进行风疹疫苗接种减少RV传播,更重要的是预防CRS。自1969年风疹减毒活疫苗问世,到2016年将风疹疫苗作为儿童期免疫计划的WHO成员国数量达到152/194个(78.4%)[17]。目前的策略是在适当的时间间隔接种2剂,很多国家的经验表明,由于风疹的既往病史不是免疫的可靠指标,所有没有疫苗禁忌的儿童均应该接种。维持儿童风疹疫苗的高接种率可降低其流行,减少育龄期妇女的感染机会。风疹疫苗可以作为单一成分皮下注射,1971年美国默克公司研制并推广了麻疹-流行性腮腺炎-风疹(measles-mumps-rubella vaccine,MMR)三联疫苗,并具有很高的稳定性和安全性,目前更多使用的是MMR组合疫苗。美国儿科学会(American Academy of Pediatrics,AAP)推荐接种2剂次疫苗用于风疹预防,12~15月龄接种第1剂,4~6岁接种第2剂[18]。
流行性腮腺炎疫苗使用前,超过90%的儿童在20岁前都感染过,而在全球范围内引入腮腺炎疫苗后,大大降低了感染的发生以及引起严重并发症的风险,流行性腮腺炎疫苗最初以单价疫苗的形式生产,目前绝大部分国家使用MMR。我国于2002年开始生产MMR疫苗,由于MMR具有一次接种可预防3种疾病的优点,同年便获批在国内上市使用,2008年加入国家计划免疫。2剂MMR疫苗至少间隔1个月皮下注射。据报道,单剂MMR疫苗的有效率为85.4%(95%CI:67.3%~93.4%),对防控腮腺炎感染作用有限。2剂MMR疫苗的有效率为88.5%(95%CI:78.1%~93.9%)[19],不如预期的高。因此,即使发达国家疫苗覆盖率高的青少年人群中也时有MuV感染暴发。已有文献提及对风险人群使用第3剂MMR来控制腮腺炎暴发[20]。
孕妇意外接种麻疹、风疹及腮腺炎减毒活疫苗不是终止妊娠的绝对指征,但2017年WHO关于MCV的意见书指出,慎重起见妊娠期间避免接种MCV及其联合疫苗。夏蝉等[21]报道对近3个月无生育计划的育龄期妇女接种MMR,可提升其待产时麻疹IgG抗体水平,并有利于提升出生婴儿的胎传麻疹抗体水平。对于麻疹抗体阴性或低IgG抗体水平(<200 IU/mL)的育龄妇女建议接种MCV,接种后3个月内避免怀孕。鉴于RV有致胎儿畸形的风险,对育龄期妇女血清RV-IgG检测未达到有效抗体滴度水平者,建议强化接种1剂MMR[22],接种后至少1个月内避免妊娠。参考《国家免疫规划疫苗儿童免疫程序及说明(2020版)》及特殊状态儿童预防接种的专家共识[23]。
建议
(1)如无禁忌证,建议8月龄儿童接种第1剂MMR,18月龄儿童接种第2剂MMR。
(2)扩大国家免疫规划前出生的<18周岁人群,如未完成2剂含麻疹成分的疫苗接种,建议补种MMR。
(3)MMR疫苗可与其他国家免疫规划疫苗同时在不同部位接种,特别是免疫月龄有交叉的甲肝疫苗、百白破疫苗等。
(4)如需接种多种疫苗但无法同时完成接种时,则优先接种MMR疫苗,若未能与其他注射类减毒活疫苗同时接种,则需间隔≥28 d。
(5)注射免疫球蛋白者应间隔≥3个月接种MMR,接种MMR后2周内避免使用免疫球蛋白。
(6)对已知疫苗成分过敏或既往接种同种疫苗后有严重过敏反应;对于原发性免疫缺陷病(补体缺陷除外);母亲感染人类免疫缺陷病毒(HIV)所生儿童或有其他暴露风险并经医疗机构诊断出有获得性免疫缺陷综合征(AIDS)或免疫抑制相关症状的原则上不予接种。
(7)正在接受化疗、放疗及中等或大剂量全身糖皮激素[泼尼松及其他等效药物≥2 mg/(kg·d)或≥20 mg/d]治疗的儿童,MMR减毒活疫苗暂缓接种。
(8)中度或严重感染性疾病通常推迟接种,待恢复后再进行接种。
流感病毒属于正黏病毒科,是分节段的单股、负链RNA病毒,根据病毒核蛋白和基质蛋白,分为甲、乙、丙、丁(A、B、C、D)4型,根据表面血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)的不同,甲型流感病毒可分为多个亚型[24]。目前引起全球和我国流感季节性流行的病毒包括2009新型甲型H1N1、甲型H3N2、乙型Victoria系和Yamagata系。每年流感季节性流行在全球可导致300万~500万重症病例,29万~65万呼吸道疾病相关死亡[25]。不同流感病毒的型别和亚型之间无交叉免疫,人群可反复感染发病。每年流感流行季节,儿童流感罹患率为20%~30%,在暴发流行季节,儿童流感的感染率可高达50%左右[25]。一项关于流感罹患率(包括有症状和无症状的感染)的系统性回顾性研究提示,18岁以下儿童流感罹患率约为22.5%,而成人流感罹患率约为10.7%[26]。与其他人群相比,学龄儿童的流感感染率最高,尤其在流感流行初期,多数流感病例发生于学龄儿童,而且儿童感染流感后排泄病毒时间较长,因此,流感在社区、学校和家庭的持续流行和传播中,儿童起了重要作用[27]。我国每年报告的流感暴发疫情中,90%以上均发生在学校和托幼机构[25]。大量证据表明,流感是导致儿童就诊和住院的重要原因。据估计,每年有10%~15%的儿童因流感感染而需就诊,国内一系列儿童急性呼吸道感染的病原学研究表明,门急诊就诊的儿童流感样病例或急性呼吸道感染病例中流感检测阳性率为3.2%~25.8%,住院儿童急性呼吸道感染病例中为1.4%~35.4%[28]。流感相关住院集中在0~5岁儿童和≥65岁老年人,季节性流感导致的儿童死亡率为<1/10万人年,而超额死亡集中在≥65岁老年人[28]。孕妇患流感可对胎儿和新生儿产生影响,出现死产、婴儿死亡、早产和出生低体质量等[29]。
流感病毒潜伏期1~7 d,常见1~4 d,平均2 d,从潜伏期末至发病急性期均具传染性,儿童及免疫力低下的人传染期更长。流感患者和隐性感染者为主要传染源,可通过飞沫传播,或直接/间接接触患者口、鼻、眼分泌物传播,人群普遍易感。我国流感病毒通常每半年或1年流行1次,流行高峰多发于冬春季,甲型H3N2在冬、夏季最为流行,甲型H1N1pdm09、乙型Yamagata和Victoria则常在冬、春季流行[30,31]。由于流感的表现与普通感冒及上呼吸道感染十分相似,无十分明显的特征。因此最初发生的病例不易诊断,需要根据流行病史、临床症状、体征及病原学检验综合进行诊断。流感确诊有赖于实验室诊断,主要方法包括病毒核酸检测、病毒分离培养、抗原检测和血清抗体检测。临床实验室一般采用病毒核酸检测和病毒抗原检测的方法,用于快速检测流感病毒,血清抗体一般用作回顾性检测。
儿童患流感时其临床症状常因年龄不同而各具特点,年长儿症状与成人相似,多表现为普通流感型,起病急骤,有高热、畏寒、头痛、背痛、四肢酸痛、疲乏等,不久即出现咽痛、干咳、流鼻涕、眼结膜充血、流泪、畏光以及局部淋巴结大,肺部可出现粗啰音,可伴随腹痛、恶心、腹泻、腹胀等消化道表现,在婴幼儿和学龄前儿童更常见。婴幼儿临床表现与其他呼吸道病毒感染相似,不易区分,炎症涉及上呼吸道、喉部、气管、支气管、毛细支气管及肺部,病情较严重,幼小婴儿可有严重的喉、气管、支气管炎伴黏稠痰液,甚至发生呼吸道梗阻现象。新生儿患者往往出现嗜睡、拒食及呼吸暂停,婴儿流感表现易激惹、喂养困难或单纯发热,临床类似细菌感染所致脓毒症,学龄前和学龄儿童流感以发热和呼吸道症状常见。儿童甲型和乙型流感临床症状和表现无明显差异,丙型流感大多表现为轻症上呼吸道感染。无并发症的流感发热一般持续3~4 d,热退后全身中毒症状减轻,但干咳及体力衰弱可持续1~2周。
流感可引起多种并发症,常见并发症主要包括中耳炎、鼻窦炎、细支气管炎、喉气管支气管炎和肺炎,在婴幼儿更常见,还可引起热性惊厥和脑病等神经系统并发症、心脏损伤、急性良性肌炎等,罕见并发横纹肌溶解综合征。危重症患者可发展为多器官衰竭、坏死性脑病和弥散性血管内凝血(DIC)等,导致死亡。
每年接种流感疫苗是预防流感最有效的手段,可明显降低流感发病率,还可降低流感相关并发症发生率,减少流感相关住院及死亡[32,33,34]。随机对照试验显示,接种灭活流感疫苗对于儿童实验室确诊流感的保护效力为43%~91%[35],2012年Meta分析显示,6月龄~7岁儿童接种流感疫苗的保护效果为83%[36]。开展基于学校的流感疫苗接种可有效减少学龄儿童流感感染的发生,在流感病毒疫苗株与流行主导株匹配的流行季,开展北京市流感疫苗大规模集中接种,可使流感集中发热疫情的发生风险大幅降低(OR=0.111)[37]。中国香港特区2017年至2018年季节研究中纳入1 078名6月龄~17岁儿童,研究对象接种的大多为四价灭活流感疫苗,结果显示流感疫苗对确诊流感住院总的保护效果为65.6%,对甲型流感的保护效果为66.0%,对乙型流感的保护效果为65.3%[38]。美国开展的一项病例对照研究分析了2010年至2014年间流感疫苗对儿童的免疫保护作用,发现流感疫苗可以减少65%的流感确诊病例的死亡,且对健康儿童的保护效果高于伴有基础疾患的儿童[39]。
全球已上市的流感疫苗主要分为流感灭活疫苗(inactivated influenza vaccine,IIV)和流感减毒活疫苗(live attenuated influenza vaccine,LAIV)[25]。根据生产工艺,又可分为基于鸡胚、基于细胞培养和基因重组的流感疫苗,其中基因重组流感疫苗尚未在我国上市。按照疫苗所含组分,流感疫苗包括三价和四价疫苗,三价疫苗组分含有A(H3N2)亚型、A(H1N1)亚型和B型毒株的一个系,四价疫苗组份含A(H3N2)亚型、A(H1N1)亚型和B型Victoria系、Yamagata系毒株。LAIV在欧美被批准用于2~49岁健康人群,2014年美国疫苗接种咨询委员会(Advisory Committee on Immunization Practices,ACIP)推荐三价LAIV用于儿童接种,2018年至2019年季节四价LAIV被美国ACIP推荐用于2~17岁儿童接种[35,40]。2019年经美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于6~35个月婴幼儿高剂量(0.5 mL)四价灭活疫苗(Fluzone)[41]。流感病毒不断变化,通常每年至少需更换一种疫苗株组分,因此流感疫苗需每年接种[42]。AAP推荐所有无医学禁忌证的6月龄以上儿童每年接种流感疫苗,可用疫苗包括四价灭活流感疫苗(IIV4,如Fluzone、FluLaval、Fluarix、Afluri)、三价灭活流感疫苗(IIV3)、四价流感喷雾疫苗(FluMist)[41]。儿童流感疫苗接种次数主要基于儿童年龄及既往疫苗接种史,9岁以上儿童只需接种1剂次;而6月龄~8岁儿童首次接种或既往接种2剂次以下流感疫苗的应接种2剂次,间隔≥4周,对IIV或LAIV均建议上述原则[25]。
我国批准上市的流感疫苗为IIV3、IIV4和鼻喷LAIV。IIV3包括裂解疫苗和亚单位疫苗,可用于≥6月龄人群接种;IIV4为裂解疫苗,可用于≥36月龄人群接种。IIV3、IIV4对A、B型流感均具保护力[43,44],但IIV4对B型流感的免疫原性优于IIV3。我国一项随机、双盲、对照Ⅲ期研究显示,IIV4相较于IIV3,具有良好的免疫原性和安全性,对B/Victoria和B/Yamagata毒株的免疫原性优于IIV3[45]。2020年至2021年国内批签发的流感疫苗供应主要来自华兰生物疫苗有限公司、深圳赛诺菲巴斯德生物制品有限公司、长春生物制品研究所有限责任公司等9家公司。目前国内使用的IIV4来自华兰生物疫苗有限公司,自2018年至2019年流感季节开始在成人中使用,尚未批准用于儿童接种[28]。2020年我国新上市冻干鼻喷三价减毒活疫苗(LAIV3)被推荐用于3~17岁儿童接种,由长春白克生物科技股份有限公司生产。鼻喷是呼吸道黏膜免疫主要的接种方式,该免疫方式通过模拟自然感染的过程进行免疫,可同时诱导黏膜局部及全身免疫应答。我国一项多中心、随机、双盲、安慰剂对照Ⅲ期临床研究数据显示,3~17岁受试者接种1剂次LAIV3对A、B型流感总体疫苗效力为36.0%(95%CI:12.2%~53.3%),不良反应多为发热、流涕/鼻塞等[46]。
我国推荐首次接种或既往接种2剂次以下流感疫苗的6月龄~8岁儿童应接种2剂次(间隔≥4周);2019年至2020年或以前接种过2剂或以上流感疫苗的6月龄~8岁儿童,则建议接种1剂;9岁及以上儿童仅需接种1剂,并建议最好在10月底前完成免疫接种[25]。对于6月龄及以下婴儿,目前尚无可直接接种的流感疫苗,该人群可通过母亲孕期接种和对婴儿的家庭成员、看护人员接种流感疫苗,以预防流感[25]。孕妇罹患流感及严重并发症风险直接影响胎儿健康。相较于未感染流感的孕妇,流感感染者早产及新生儿低出生体质量风险显著增加[47]。西班牙一项回顾性研究显示,孕妇于孕期进行流感疫苗接种,可有效预防≤6月龄婴儿流感感染,有效率为61%(95%CI:27%~79%)[48]。
灭活流感疫苗可与其他灭活疫苗及减毒活疫苗同时或依次接种,而LAIV则需要间隔一定时间后才能接种其他减毒活疫苗[25]。流感疫苗接种是安全的,但也可见不良反应,通常是轻微的,并在几天内自行消失,极少出现严重异常反应。接种IIV部位可发生红晕、肿胀、硬结等局部反应以及发热、头痛、头晕、恶心、呕吐等全身反应,接种LAIV后可发生发热、流涕、鼻塞等类似上呼吸道感染等反应。流感疫苗接种禁忌证为对疫苗中所含任何成分(包括佐剂、甲醛、裂解剂及抗生素)过敏者。此外,LAIV接种禁忌证包括基础免疫力低下或者免疫缺陷者及其密切接触者、2~4岁患有哮喘的儿童、接种LAIV可能诱发喘息发作的人群、孕妇和使用阿司匹林或含有水杨酸成分药物治疗的儿童及青少年。《中华人民共和国药典》(2015版和2020版)均未将对鸡蛋过敏者作为禁忌。对于伴或不伴发热症状的轻中度急性疾病患者,建议症状消退后再接种,既往接种流感疫苗后6周内出现吉兰-巴雷综合征不是禁忌证,应特别注意[25]。
流感疫苗在我国大多数地区属于非免疫规划疫苗,除北京、青海、深圳等地对部分高危人群实施免费接种外,其余地区公民需自愿、自费接种。2018年开展的一项调查研究显示,我国6个省份全人群最近1年流感疫苗接种率为5.7%(570/10 037)[49]。北京市自2007年起在全市中小学校开展流感疫苗免费接种,覆盖率维持在50%左右,但国内大部分地区儿童流感疫苗接种率不容乐观[50]。成都市6~35月龄儿童季节性流感疫苗接种率2015年至2018年分别为22.41%、16.26%、21.64%和10.63%[51]。山东滨州市5岁以下儿童流感疫苗接种率从2015年的42.29%下降至2017年的20.21%[52]。儿童流感疫苗接种率与当地的经济水平、卫生政策、宣传、家长认识水平等有关[53]。对2011年至2016年国家健康访问调查数据显示,接种流感疫苗的父母其子女接种可能性更高,疫苗费用纳入保险也增加接种可能性,而家庭成人受教育程度和丧偶/离婚/分居的婚姻状况与儿童接种疫苗意愿呈负相关[54]。即家庭因素、疫苗费用是影响我国儿童流感疫苗接种覆盖率的最主要原因,将流感疫苗纳入免疫规划或是解决措施之一。
建议
(1)如无流感疫苗接种禁忌证,6月龄以上的儿童每年应接种流感疫苗,尤其是重点场所的托幼机构儿童和中小学生。
(2)6月龄~8岁儿童首次接种或既往接种2剂次以下流感疫苗时,应接种2剂次流感疫苗,间隔≥4周;既往接种过2剂次或以上流感疫苗的儿童,则建议接种1剂次;9岁及以上儿童仅需每年接种1剂次。
(3)6月龄及以下婴儿:由于现有流感疫苗不可以直接给6月龄以下婴儿接种,该人群可通过母亲孕期接种和对婴儿的家庭成员和看护人员接种流感疫苗,以预防流感[25]。
(4)孕妇:孕妇罹患流感后发生重症、死亡和不良妊娠结局的风险更高。虽然国内缺乏孕妇接种流感疫苗的安全性评价数据,但国外对孕妇在孕期任何阶段接种流感疫苗的安全性证据充分,同时接种疫苗对预防孕妇罹患流感及通过胎传抗体保护6月龄以内婴儿的效果明确。因此,建议孕妇或在流感季节备孕女性接种流感疫苗,孕妇可在妊娠任何阶段接种[25]。
(5)我国各地每年流感活动高峰出现时间及持续时间不同,为保证受种者在流感高发季节前获得免疫保护,建议最好在10月底前完成免疫接种[25]。
(6)通常接种流感疫苗2~4周后可产生具有保护水平的抗体,6~8月后抗体滴度开始衰减,因此,流感疫苗需要每年接种[25]。
VZV属疱疹病毒属,α疱疹病毒亚科。VZV感染局限于人类及部分高级灵长类动物,仅有1个血清型。VZV可引起2种不同的疾病,即水痘(varicella)和带状疱疹(herpes zoster)。VZV原发感染引起水痘,水痘愈后残余的病毒可在背根神经和颅神经节内潜伏,当机体抵抗力降低时,VZV特异性细胞免疫下降,潜伏的病毒再激活则引起带状疱疹。水痘病情通常是轻微的,但也可能导致严重并发症,如继发细菌感染(蜂窝组织炎、肺炎等)和神经系统并发症(脑膜炎),甚至致命[55]。据保守估计,全球每年水痘发病患者预计1.4亿,140万例可能发生严重并发症(需住院治疗),死亡4 200例[56]。我国最新传染病监测数据显示,2005年至2015年共报告水痘3 394 432例,年均发病率为23.04/10万,发病率从2005年的3.17/10万上升至2015年的33.86/10万,水痘发病呈上升趋势[57]。带状疱疹通常伴有神经病理性疼痛,而疱疹感染后神经痛(post-herpetic neuralgia,PHN)是最常见的并发症,疼痛可持续数月,严重影响患者生活质量。
水痘是一种高度传染性疾病,在全球均有发生。VZV潜伏期为10~21 d,水痘及带状疱疹患者为传染源,主要经飞沫及接触传播,但一般认为带状疱疹主要因婴幼儿期患水痘后病毒潜伏性感染的再激活所致。人群普遍易感,一年四季均可发病,以冬春季为高峰。对我国2005年至2015年水痘的发病特征进行分析,每年4-6月份和11月-次年1月份为发病高峰,0~4岁、5~9岁、10~14岁、≥15岁人群发病率分别为85.25/10万、153.78/10万、71.01/10万、4.53/10万,即5~9岁为易感高发人群,多为学龄期、托幼和散居儿童[57]。典型水痘可分为前驱期和出疹期,前驱期常无症状或症状轻微,可有低热、烦躁易激惹等。出疹期皮疹首先见于躯干部,以后延及面部及四肢。初为红色斑疹,数小时后变为丘疹并发展成疱疹,常伴瘙痒。1~2 d后疱疹从中心开始干枯、结痂,红晕消失。通常情况下,患儿发热程度越高,皮疹范围越大,病程一般为5~7 d。1周左右痴皮脱落愈合,一般不留瘢痕。水痘多为自限性疾病,10 d左右可自愈。儿童患水痘通常症状不严重,但偶尔可出现多种皮肤外表现或并发症[58],包括肺炎、脑炎、小脑共济失调、关节炎、阑尾炎、肝炎、肾小球肾炎、心包炎以及睾丸炎。儿童中最常见的并发症为皮肤的继发性细菌感染[59]。成人患者症状较重,易并发水痘肺炎。
疫苗接种是控制水痘传播最经济有效的手段。目前已上市可用于水痘预防的疫苗均为水痘减毒活疫苗及水痘联合疫苗(麻腮风水痘疫苗)(measles-mumps-rubella-varicella vaccine,MMRV),在研的疫苗包括新型减毒活疫苗、灭活疫苗、核酸疫苗和联合疫苗等。Meta分析显示,接种1剂次水痘疫苗对不同程度水痘发病的有效性(vaccine effectiveness,VE)为81%(95%CI:78%~84%),对中、重度水痘为98%(95%CI:97%~99%),接种2剂次水痘疫苗对不同程度水痘发病的VE为92%(95%CI:88%~95%)[60],但仍存在疫苗制备成本高、不适用于免疫缺陷患者及VZV潜伏、重新活化引起带状疱疹潜在风险等缺陷。AAP推荐儿童常规接种水痘疫苗,12~15月龄接种第1剂,4~6岁接种第2剂[18],WHO建议12~18月龄接种第1剂,共接种1或2剂,2剂接种间隔4周~3个月(以具体接种疫苗说明书为准)[61]。目前在中国上市的减毒活疫苗推荐接种方式均为皮下注射。健康儿童接种水痘疫苗后不良反应大多比较轻微,包括注射部位疼痛与发红、发热和轻度皮疹[62],多数情况下为一过性,于2~3 d后便自行消失。
带状疱疹给患者家庭和社会带来了严重的经济负担,欧美国家通过接种带状疱疹疫苗预防疾病流行,目前全球上市的带状疱疹疫苗主要为减毒活疫苗、佐剂带状疱疹亚单位疫苗2种,佐剂带状疱疹亚单位疫苗也于近期在我国上市,但两类疫苗均用于老年人群。带状疱疹疫苗生产工艺与水痘减毒活疫苗类似,其标准为每剂病毒量19 400空斑形成单位(pock-forming unit,PFU),约为水痘减毒活疫苗的10倍,高滴度的病毒量能诱导一定程度的病毒特异性T细胞免疫反应。目前尚无适用于儿童的带状疱疹疫苗。
我国于1997年引进水痘疫苗,2000年国产疫苗上市,截至目前我国尚未将其纳入免疫规划。国外一项研究显示,将水痘疫苗纳入国家免疫计划后,≤5岁儿童水痘的年发病率从2011年的290/10万显著下降至2019年的24/10万(P=0.000 1)[63]。对我国1~12岁健康儿童接种1剂水痘减毒活疫苗的保护效果进行系统评价,结果显示1~12岁健康儿童接种1剂次水痘减毒活疫苗VE值为75%(95%CI:68%~80%),<6岁儿童VE[84%(95%CI:77%~89%)]高于≥6岁儿童VE[60%(95%CI:51%~68%)],即1剂次水痘减毒活疫苗可提供中等水平保护力,但≥6岁儿童VE明显降低,建议对<6岁儿童开展2剂次水痘疫苗接种[64]。杭州市2014年开始对3岁或4岁儿童接种第2剂水痘疫苗,2019年调查结果显示,1剂水痘疫苗VE为91.0%(95%CI:81.6%~95.8%),而2剂VE为98.0%(95.5%~99.2%)[65]。因此,建议将2剂次水痘疫苗接种程序纳入国家免疫规划。
对于孕妇,WHO建议孕期禁止接种水痘疫苗,若育龄期女性接种则应推迟4周怀孕[56]。因接种活疫苗或减毒疫苗后可能存在风险[66]。美国疾控中心(Centers for Disease Control and Prevention,CDC)也建议孕妇禁用水痘疫苗[67]。妊娠早期无意接种水痘疫苗后不需要终止妊娠[68]。一项为期10年的调查数据显示,尚无证据表明活产儿罹患先天性水痘综合征,或先天性出生缺陷风险与孕妇接种水痘疫苗相关,但仍需大样本研究数据证实[69]。
建议
(1)如无禁忌证,推荐1岁及以上健康儿童接种2剂次水痘减毒活疫苗。建议12~24月龄接种第1剂,4~6岁接种第2剂。
(2)未完成2剂者,补齐2剂(≤14岁人群2剂至少间隔3个月,≥15岁人群2剂至少间隔4周)。
(3)孕妇禁用水痘疫苗;若育龄期女性接种则应推迟4周怀孕。
CoV属于巢状病毒属(Nidovirales)冠状病毒科家族,可分为α-冠状病毒、β-冠状病毒、γ-冠状病毒和δ-冠状病毒。目前已知的可感染人的冠状病毒包括α属HCoV-229E、HCoV-NL63,β属HCoV-OC43、HCoV-HKU1、MERS-CoV、SARS-CoV和SARS-CoV-2[70]。SARS-CoV、MERS-CoV及SARS-CoV-2均属于高致病性人冠状病毒(human coronavirus,HCoVs),可致严重呼吸窘迫综合征,具有较高的病死率。WHO将SARS-CoV-2感染引起的疾病命名为冠状病毒疾病-2019(corona virus disease-19,COVID-19),并于2020年3月11日认定COVID-19为大流行。截至2021年7月8日,COVID-19在全球的感染人数超过18 482万例,死亡超过400万例,其中美国感染人数超过3 360万,死亡人数超过60.3万[1,71]。一项系统综述显示,7 480例SARS-CoV-2感染儿童主要表现为轻度(42.5%)、中度(39.6%)感染,约2%需进行重症监护,预计死亡率为0.08%;新生儿病情较为严重,常见症状为呼吸困难[72]。我国报道的儿童SARS-CoV-2感染病例多数为无症状感染者和轻症,重症较为少见。武汉儿童医院收治的确诊SARS-CoV-2感染儿童中,15.8%的患儿未表现出任何感染症状,且未见肺炎影像学特征[73]。2020年4月27日以来,欧美国家陆续报道了SARS-CoV-2感染儿童重症病例,出现了类似不完全川崎病或中毒性休克综合征的症状,即儿童多系统炎症综合征(multisystem inflammatory syndrome in children,MIS-C)[74]。MIS-C患儿可出现循环、呼吸、肾脏、消化道或神经系统等多系统症状[75]。主要表现为发热伴皮疹、非化脓性结膜炎、黏膜炎症、低血压或休克、凝血障碍、急性消化道症状等。一旦发生,病情可在短期内急剧恶化[76]。
SARS-CoV-2自2019年12月出现以来,目前仍在全球绝大多数国家流行。SARS-CoV-2传染性强,有症状感染者为主要传染源,无症状感染者也可成为传染源。主要传播途径为飞沫和密切接触传播,密闭空间、通风不良的房间可经气溶胶传播,粪口传播有待证实。人群普遍易感。与成年感染者相比,儿童患病率低、症状较轻、致死率也相对较低[73,77,78]。中国CDC对我国72 314例COVID-19病例进行分析显示,总病例中10岁以下儿童占比不到1%[78]。我国儿童SARS-CoV-2感染病例多以男童为主,1~12岁为高发人群,多数患儿与确诊或疑似患者有密切接触史,且多数为家庭聚集性发病[79]。SARS-CoV-2感染潜伏期为1~14 d,一般为3~7 d。临床可表现为无症状,或表现为发热、乏力、干咳,少数患者伴有鼻塞、流涕、咽痛等上呼吸道症状,也可能出现腹部不适、恶心、呕吐、腹痛、腹泻等消化道症状,部分出现嗅觉、味觉障碍。重症者多在发病1周后出现呼吸困难和/或低氧血症,严重者可快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和凝血功能障碍及多器官衰竭等。胸部影像学显示早期呈现多发小斑片影及间质改变,以肺外带明显,进而发展为双肺多发磨玻璃影、浸润影,严重者可出现肺实变,胸腔积液少见。目前,尚无针对SARS-CoV-2感染的特效药物,疫苗研发正在进行之中。我国"新型冠状病毒肺炎诊疗方案"推荐的治疗方法主要包括一般常规治疗、抗病毒治疗、抗菌治疗、免疫调节治疗等[76,80]。恢复期血浆治疗为免疫调节治疗中的一种方式,通过采集康复患者恢复期血浆,制备获得安全、高滴度中和抗体的生物制品,并将其输注给患者,以达到降低病毒载量的目的。主要适用于病情进展较快、重症和早期危重症患者,但其疗效和安全性尚需进一步的临床研究予以证实[80,81]。
疫苗已经被证实是最具成本效益的疾病预防和控制措施,为全球公共卫生做出了巨大贡献。虽然儿童SARS-CoV-2感染重症病例较为少见,但因MIS-C以及伴有基础疾病的儿童重症风险高,儿童接种疫苗仍是必要的。SARS-CoV-2疫苗研发正快速进展中,疫苗研发技术路线几乎涵盖了现有疫苗研发的绝大多数技术类型,包括灭活疫苗、RNA疫苗、DNA疫苗、病毒载体疫苗(非复制型或复制型载体疫苗)、减毒活疫苗、蛋白亚单位疫苗和病毒样颗粒(VLP)疫苗等。WHO官方数据显示,截至2021年7月6日,全球共105种疫苗进入临床研究,184种正在开展临床前研究[82]。辉瑞/BioNTech研发的脂质纳米颗粒包裹的核苷酸RNA修饰的疫苗BNT162b2,其Ⅲ期临床研究数据显示,接种2剂BNT162b2对16岁或以上人群SARS-CoV-2感染预防的有效性达到95%[83];对于12~15岁人群预防有效率可达到100%,且耐受性良好[84]。2020年12月初英国率先授权BNT162b2在紧急状态下使用;12月12日FDA批准了该疫苗紧急使用授权申请;12月21日欧盟委员会批准该疫苗有条件上市许可。目前BNT162b2可在英国、巴林、加拿大、墨西哥、美国、新加坡、瑞士、马来西亚、德国、法国、奥地利、意大利等国家使用。Moderna公司研发的mRNA疫苗mRNA-1273,其Ⅲ期临床结果显示mRNA-1273疫苗的有效率为94.1%[85],可100%预防重症COVID-19,且未增加血栓风险[86]。2020年12月18日,FDA批准了mRNA-1273的紧急使用授权申请;2021年1月6日,欧盟委员会批准了该疫苗有条件上市许可。
我国研发的SARS-CoV-2疫苗也取得快速进展。目前国家药品监督管理局批准附条件上市新冠疫苗有5款,分别为国药集团下属武汉生物研究所研发的灭活疫苗、国药集团下属北京生物研究所的灭活疫苗、中国人民解放军军事科学院联合康希诺公司研发的腺病毒载体疫苗、安徽智飞龙科马生物制药有限公司的重组蛋白疫苗以及北京科兴中维生物技术有限公司的灭活疫苗。我国第1个评估候选非复制型腺病毒载体(recombinant adenovirus type-5-vectored,Ad5)COVID-19疫苗免疫原性和安全性的随机对照试验,即重组新冠疫苗(腺病毒载体)Ⅱ期临床试验结果显示,受试者单次接种疫苗28 d后,99.5%产生了特异性抗体,95.3%产生了中和抗体,89%产生了特异性T细胞免疫反应,疫苗中、低剂量组血清抗体阳转率分别为96%和97%,安全性良好,为顺利开展Ⅲ期国际临床试验奠定了坚实基础[87]。中国第1个灭活病毒COVID-19疫苗的Ⅰ、Ⅱ期临床试验入组了320位受试者,Ⅰ期临床试验受试者接种3个剂量疫苗(2.5、5.0和10.0 μg/次),结果高、中、低接种剂量在接种后14 d的血清中和抗体滴度明显升高;Ⅱ期临床试验中,将接种中剂量疫苗的受试者分为两组,一组在初次免疫后第14天给予强化接种,另一组初次免疫后第21天给予强化接种,结果显示两组强化接种后的血清中和抗体滴度均明显升高。两项试验最常见的不良事件包括注射部位疼痛,其次是发热,多为轻度和自限性不良事件,未见严重不良反应[88]。境外开展的Ⅲ期临床研究结果显示,科兴中维SARS-CoV-2灭活疫苗(CoronaVac),按照0,14 d程序接种2剂疫苗,14 d后预防COVID-19的保护效力为91.25%。由中国工程院院士、军事科学院军事医学研究院与康希诺生物合作研发的腺病毒载体疫苗Ad5-nCoV在巴基斯坦进行的Ⅲ期临床试验中期分析结果显示,单针接种后对重症新冠肺炎的保护率为100%,总体保护率为74.8%。因SARS-CoV-2在流行过程中不断变异,据全球共享流感数据倡议组织(Global Initiative of Sharing All Influenza Data,GISAID)数据库显示,目前流行的突变株主要为Alpha、Beta、Gamma、Delta[89]。研究数据显示,北京生物研究所新冠疫苗BBIBP-CorV接种者血清对Alpha突变株的中和滴度与野生型相比有所提高(1.4倍),而对Beta突变株的中和滴度为野生型的0.4倍;科兴中维新冠疫苗CoronaVac接种者血清对Alpha突变株的中和滴度与野生型相比显著降低(0.5倍,P=0.004),对Beta突变株中和滴度为野生型的0.3倍(P<0.001)[90]。
建议
(1)接种疫苗是预防病毒感染的有效方法,国药集团中国生物新冠灭活疫苗获批在3~17岁人群中紧急使用,该疫苗基础免疫为2剂次,2剂之间的接种间隔建议≥3周,第2剂在8周内尽早完成。
(2)为减少医疗机构对呼吸道传染病和新冠病毒感染接诊叠加所造成的压力,儿童应做好其他常见呼吸道病原的免疫预防,包括常规接种流感疫苗、Hi疫苗、Spn疫苗、百日咳疫苗、麻疹-风疹-流行性腮腺炎疫苗等。MIS-C可能与新冠病毒感染引起的免疫失衡有关,应严密监测儿童接种疫苗后免疫相关的不良反应。
RSV为有包膜的单股负链RNA病毒,原归属副黏病毒科肺炎病毒属,2015年国际病毒分类委员会将RSV改划分至肺炎病毒科正肺病毒属[91],主要分为A、B两种亚型[92]。RSV是世界范围内引起5岁以下儿童急性下呼吸道感染(acute lower respiratory tract infections,ALRTI)最重要的病原,是造成婴幼儿病毒性呼吸道感染住院的首要因素,严重危害儿童健康,尤其是早产儿及患有先天性心脏病或原发免疫缺陷的婴幼儿[93]。一项荟萃分析显示,西太平洋地区15个国家196项研究中,呼吸道感染患者(全年龄)的RSV阳性率为16.73%,且儿童显著高于成人(20.72%比1.87%,P<0.001)[94]。一项基于全球RSV流行病学数据的模型估计显示,2015年全球5岁以下儿童RSV感染ALRTI新发病例3 310万例,其中住院患儿320万例,院内死亡59 600例;所有死亡病例中,99%的患儿来自于发展中国家。RSV感染发病率最高的5个国家依次为巴基斯坦、印度、尼日利亚、中国和印度尼西亚,贡献了全球近一半的RSV相关ALRTI的疾病负担[95,96]。RSV相关死亡年龄与经济水平相关,低收入国家、收入偏低的中等收入国家死亡中位年龄为5月龄,收入偏高的中等收入国家为4岁,高收入国家为7岁[95]。我国儿童RSV感染疾病负担较重。对我国48项5岁以下儿童社区获得性肺炎(community acquired pneumonia,CAP)相关研究进行系统回顾,100 151名CAP住院儿童中,RSV阳性检出率为17.3%[97]。2007年至2015年北京地区4 225例住院肺炎患儿中30%与RSV感染相关,其中至少一半的RSV相关肺炎住院发生在28 d~5月龄,即低龄是RSV相关肺炎发生的重要危险因素[98]。目前针对儿童RSV感染尚无安全有效的防治措施和特异性治疗方法,防治现状不容乐观,对社会和家庭均造成较大的经济负担。
RSV感染潜伏期为2~8 d,多为4~6 d[99],传染源为有症状的RSV感染者及无症状的隐性感染者,可通过飞沫、接触传播,传染性强。婴幼儿、老年人及免疫力低下者均为易感人群。RSV感染的流行与性别、年龄、季节和地域等因素有关。RSV感染具有明显的季节特征,我国北方、日本及美国等温带地区,以冬春为流行季节;许多热带国家RSV的流行发生在最热月份和雨季,RSV的流行季节一般持续4~5个月,一个流行季节A/B组RSV共同流行,以其中一组为主,A组多见。北京地区2007年7月至2015年6月住院肺炎患儿RSV感染相关数据显示,RSV流行具有季节性,RSV流行季节通常始于每年第41周(10月中旬),结束于次年第20周(5月中旬),整个RSV流行季节持续33周,约97%的RSV感染病例发生在该时间范围内,流行高峰位于次年第3周(1月中旬)[98]。RSV流行季节总体呈隔年高峰趋势,与气候因素有一定关系。RSV A、B亚型呈交替流行,优势亚型每隔两年转换一次,与B亚型占优势的年度比较,A亚型高流行的年份RSV季节开始时间提前3~5周,季节持续时间也相应延长约6周[98]。RSV感染可引起支气管炎、毛细支气管炎和间质性肺炎,或仅表现为较轻的"感冒"症状。儿童患者症状较为明显,可有鼻塞、咳嗽(干咳为主)、发热症状,并可伴发轻度结膜炎、咽炎等。中、重症感染者可有明显的呼吸困难、喘憋、口唇发绀、鼻翼扇动及三凹征等症状。
目前尚无获得许可的RSV疫苗用于预防接种。RSV融合蛋白人源化鼠单克隆抗体帕利珠单抗(Palivizumab)是目前唯一经FDA批准使用的单克隆抗体,但未在国内上市。AAP推荐帕利珠单抗用于孕周<29周早产儿和高危婴幼儿(如患先天性心脏病、慢性肺部疾病、免疫缺陷病等);或在RSV流行季节,给予上述适应证出生后第1年婴儿,最多给予5剂帕利珠单抗(每剂15 mg/kg;1剂/月;肌内注射);出生后第2年不推荐使用,除非出生后需要至少28 d吸氧或仍需医疗支持(吸氧、糖皮质激素治疗或利尿剂长期治疗等)[100]。多中心随机、对照试验表明,35周前出生、伴或不伴支气管肺发育不良儿童在RSV流行季给予帕利珠单抗可使RSV相关住院率降低55%[101]。回顾性分析数据显示,帕利珠单抗预防性使用可将RSV感染相关的住院率从2012年至2013年度的9.23%降至2016年至2017年度的0.67%[102]。在帕利株单抗结构基础上研发的第二代人源化lgG抗体莫维株单抗,虽被证明比帕利珠单抗具有更高的病毒中和作用,但因其皮肤致敏不良反应未能得到FDA批准。
Nirsevimab是正在开发的重组人源化IgG1κ单克隆抗体,通过靶向RSV融合蛋白(Fusin)融合前构象中和RSV病毒,具有比帕利珠单抗更高的效力和更长的半衰期(平均59.3 d)。一项干预性、随机、双盲Ⅱb期试验,1 453例胎龄29~35周的健康早产儿于RSV流行季开始时分别接受了单次肌内注射Nirsevimab(n=969)50 mg或安慰剂(n=484),在给药后150 d内,Nirsevimab组就医的RSV相关下呼吸道感染发生率(2.6%比9.5%;P<0.001)比安慰剂组低70.1%(95%CI:52.3%~81.2%),RSV相关下呼吸道感染住院率也降低了78.4%(95%CI:51.9%~90.3%),预防效果不受地域及RSV流行亚型影响,且安全性与安慰剂组相似,未观察到显著的超敏反应[103]。Nirsevimab在RSV流行季前通过单次给药可有效中和RSV A和RSV B亚型,能够在RSV的不同的亚型流行季提供保护作用,从而降低RSV疾病负担、提高RSV预防成本效益及依从性。目前Nirsevimab已被FDA授予了快速通道资格及突破性药物资格。
建议
(1)目前国内尚无RSV疫苗用于预防接种。"社会疫苗"是RSV预防的有效手段,包括健康的生活方式、良好的卫生习惯及个人日常防护,通过戴口罩、洗手、保持安全社交距离等方式切断传播途径。
(2)应做好其他常见呼吸道病原的免疫预防,包括常规接种流感疫苗、Hi疫苗、Spn疫苗等,以减轻或减少RSV与其他呼吸道病原感染造成的多重混合感染。
目前,通过全基因组序列分析定义了90多个人腺病毒(human adenovirus,HAdV)血清型,被分为7个种属(HAdV A~G)。其中A、B、C、D、E、F种属在全球传播,血清型1~5、7、21、41与人类疾病相关[104]。HAdV不同的血清型表现出不同的组织嗜性及临床表现。RTI主要由B(包括3、7、11、14、21和55型)、C(1、2、5和6型)和E(4型)类引起[105]。成人血清型1、7、14和21型最常见,而儿童最常见的是1~7型和55型[104]。多数HAdV感染发生在6月龄~5岁患者中[106],高峰出现在2岁之前,占整个呼吸道疾病的2%~7%和肺炎的4%~20%[107]。HAdV是引起儿童RTI的重要病原体之一,4%~10%的儿童病毒性呼吸道感染由HAdV引起[108]。马来西亚、越南等发展中国家,因急性病毒性呼吸道感染住院的儿童中,约5%由HAdV引起;法国、加拿大等发达国家,这一比例约为4%;但在中国这一比例高达13%[109]。HAdV感染多为自限性疾病,但小部分儿童仍可见严重呼吸道感染、急性呼吸衰竭,甚至死亡。特殊血清型、年龄<7岁、慢性基础疾病史、近期器官移植史、免疫功能低下均是严重HAdV呼吸道感染的危险因素。研究发现,HAdV-3和HAdV-7是目前中国儿童严重病例的主要病原;HAdV-7是严重腺病毒呼吸道感染的独立危险因素;突发的基因变异可能与更严重的疾病有关,如HAdV-14p1和HAdV-55等[108]。此外,HAdV肺炎患者中,14%~60%可能出现肺部后遗症[105],严重影响儿童的生活质量。
HAdV感染可由已感染个体(吸入雾化飞沫、分泌物接触、粪-口传播)、外源性(如枕头、床单等物品)或自身体内携带病毒再激活引起。HAdV的无症状携带可能持续数周或数月。潜伏的HAdV可能在淋巴组织、肾实质或其他组织中存在多年,当机体免疫功能严重抑制时可发生感染。HAdV感染可在封闭人群中迅速传播(如医院、托儿所、职业培训中心、寄宿学校或宿舍、军营、公共游泳池)[104]。绝大多数情况HAdV感染是自限性的,但在免疫抑制宿主中可能具有播散性和致命性。HAdV感染全年均可发生,多数发生在冬季和春季,在中国华南地区,夏季(5~8月)检出率最高[110]。在过去10年中,许多国家均报告了多次暴发HAdV相关急性呼吸道感染,最常见的病原类型为HAdV-C(HAdV-1、-2、-5、-6)和HAdV-B(HAdV-3、-7)[111]。不同类型HAdV流行在不同的地理区域,在亚洲,HAdV-B3是最常见的类型,其次是HAdV-C2和C1[110];但在南美洲许多国家,如巴西HAdV-7是主要菌株[104];在美国新兵中HAdV-4和HAdV-14是最常见类型[106]。此外,HAdV感染可能出现新菌株在国家间或跨大陆传播,优势血清型被新毒株所替代。2006年以来,世界范围报道了B种HAdV-14p1和HAdV-55引起的呼吸道疾病暴发,由于缺乏群体免疫,这2个毒株较其他HAdV感染临床表现更严重,传播更广泛[112]。同时,最近也有报道HAdV-5的流行,以及在中国和亚洲其他国家出现了与HAdV-B7基因变异的7d型毒株相关的严重呼吸系统疾病[113]。
HAdV可对机体大多组织和细胞进行侵袭,其中以RTI最为常见,主要侵犯6月龄~2岁婴幼儿。儿童腺病毒肺炎起病急、中毒症状明显,主要表现为高热、剧烈咳嗽、呼吸困难等症状。约1/3的腺病毒肺炎发展为重症肺炎[114],以3、7型HAdV感染最为常见[111],表现为呼吸系统症状,可有呼吸衰竭、肺不张、急性呼吸窘迫综合征等肺部并发症。胸部X线显示双肺弥漫性浸润影,甚至出现几乎全部肺泡塌陷,肺野呈均匀致密影,即"白肺"。重症腺病毒肺炎易遗留不同程度的肺部后遗症,如感染后闭塞性细支气管炎(postinfectious bronchiolitis obliterans,PIBO)、支气管扩张、单侧透明肺及肺纤维化等,尤其PIBO最为常见,15%~47%的重症腺病毒肺炎患者最终进展为PIBO[105,115],主要表现为感染后反复或持续气促、喘息或咳嗽,对支气管扩张剂无反应,CT显示典型的马赛克征,即肺密度不均匀,密度增高区与密度减低区形成补丁或地图状改变。
健康个体自然感染HAdV可以产生持久的特异性免疫,抗HAdV抗体可以对同一类型的HAdV提供长期和稳定的保护[116]。美国在军队使用了口服HAdV-4和HAdV-7二价活疫苗,有效降低了部队腺病毒感染发生率[117]。我国学者近几年也开始重视腺病毒疫苗的研发,尤其是针对HAdV-3、7和55引起重症呼吸道感染的型别,Liu等[116]构建了一种重组三价人腺病毒疫苗(rAdMHE3-h55),能够完全保护分别用HAdV-3,HAdV-7或HAdV-55攻击的小鼠。Tian等[118]通过制备了rAd3H7、rAd3H14和rAd3H55重组病毒,成功在小鼠中诱导了针对HAdV-3、7、14和55高滴度的中和抗体。
近年来,儿童HAdV呼吸道感染在我国呈高发态势,部分引起严重并发症甚至危及生命,因此,研制人类的腺病毒疫苗迫在眉睫。但由于HAdV分型较多,因此对于疫苗开发存在一定的难度。由于HAdV属于DNA病毒,基因变异率较低,基于目前对HAdV抗原表位的研究,整合各个型别的抗原表位,进而开发多价疫苗,可能是今后腺病毒疫苗研究的主要方向。
建议
目前尚无批准用于儿童预防HAdV感染的HAdV疫苗,"社会疫苗"是其预防的有效手段。
百日咳是由百日咳杆菌引起急性传染病。百日咳杆菌具有很多抗原和生物活性物质,包括百日咳毒素(PT)、丝状血凝素(FHA)、凝集原(AGG)、腺苷酸环化酶(AC)、外毒素(HLT)、气管细胞毒素(TCT)。这些物质引起百日咳的临床症状,并诱导宿主产生保护性抗体。百日咳的发病机制尚不完全清楚,目前认为,百日咳杆菌感染造成的免疫力并不持久。百日咳感染者可出现多种并发症,如肺炎、眼结膜下出血、肺动脉高压、脑病等,其中肺炎为百日咳患者最常见的并发症。研究数据显示百日咳住院患儿肺炎确诊率高达62.0%[119],5月龄百日咳肺炎病死率高达12.5%(95%CI:4.2%~26.8%)[120]。
百日咳潜伏期为6~20 d,一般为9~10 d。患者、隐性感染者、带菌者均为传染源,从潜伏期末1~2 d至发病后6周均具传染性,尤以病初1~3周内传染性最强。主要经飞沫、气溶胶传播,家庭内传播是人际传播的重要途径。WHO数据显示,2018年全球报告有151 074例百日咳病例,且近年来全球多个国家百日咳发病出现反弹,呈明显上升趋势[121]。美国2006年至2015年共报告11 378例百日咳病例,发病率为15.55/10万,显著高于1976年报告的0.47/10万[122]。我国2018年、2019年、2020年分别报告百日咳病例22 057例、30 027例、4 475例,发病率分别为1.587 9/10万、2.150 1/10万、0.318 8/10万,2019年高于其他年份[8,10,11]。我国百日咳流行呈全年散发,在大部分地区夏季为高峰期,男性偏多,病例多为儿童,且近几年我国发病也呈上升趋势[123]。2005年至2017年浙江省共报告百日咳病例1 475例,年均发病率为0.21/10万,主要于3-8月发病,散居儿童为主要人群(93.90%),尤以<1岁患儿发病率最高(16.53/10万)[124]。对西安地区2015年至2016年收治的857例百日咳患儿病例分析发现,百日咳病例中<6月龄未完成基础免疫者多见,农村儿童多见,且家庭成员是儿童百日咳感染的重要传染源[125]。不同地区百日咳流行菌株毒力抗原基因型不同,目前欧美国家流行的主要基因型为ptxP3/ptxAl/prn2,我国为ptxP1/prn1,但在北京、深圳等地也发现了ptxP3/prn2百日咳菌株基因型[126,127,128]。
百日咳感染一般分为卡他期(1~2周)、痉咳期(2~6周)和恢复期(2~3周)。卡他期症状类似感冒,可有低热、咳嗽、喷嚏、流泪和乏力等症状,起始为单声干咳,后期加剧尤以夜晚为甚,3~4 d后热退;痉咳期可见阵发性、痉挛性咳嗽,痉挛性咳嗽发作时,患儿表情痛苦、面红耳赤,频繁者可见颜面水肿等;恢复期时,痉挛性咳嗽次数逐渐减少,食欲、精神状况逐渐恢复正常。婴幼儿临床表现较典型,但青少年及成人临床症状不典型,或仅表现为迁延性或慢性咳嗽。
WHO认为接种含百日咳成分疫苗的目的是降低婴幼儿罹患严重疾病的风险。百日咳疫苗可分为全细胞百日咳疫苗(whole-cell pertussis vaccine,wP)及无细胞百日咳疫苗(acellular pertussis vaccine,aP)。wP、aP分别与白喉类毒素和破伤风类毒素联合组成全细胞百白破联合疫苗(diphtheria,tetanus and whole-cell pertussis combined vaccine,DTwP)及无细胞百白破联合疫苗(diphtheria,tetanus and acellular pertussis combined vaccine,DTaP)。1978年我国实施国家免疫规划后,DTwP在全国范围内普及,2011年基本完成DTaP对DTwP的替代。目前常用的含百日咳成分联合疫苗主要包括DTaP以及以DTaP为基础制备的DTaP-b型Hi(结合)联合疫苗(DTaP-haemophilus influenzae type b vaccine,DTaP-Hib)、DTaP-灭活脊髓灰质炎-b型Hi(结合)联合疫苗(DTaP-inactivated polio-haemophilus influenzae type b vaccine,DTaP-IPV-Hib)。我国一项开放、随机、对照Ⅲ期临床研究结果显示,吸附无细胞百白破、灭活脊髓灰质炎和b型Hi(结合)联合疫苗(DTaP-IPV//PRP~T联合疫苗)对每种抗原的血清保护率/血清转换率均与DTaP、Hib结合疫苗和灭活脊髓灰质炎疫苗(inactivated polio vaccine,IPV)等效,且安全性相似[129]。在免疫原性及安全性相当的情况下,多联疫苗的使用可简化免疫程序,并提高接种疫苗的依从性和覆盖率。DTaP具有良好的安全性,局部和全身不良反应一般是轻微、短暂的。WHO推荐所有儿童进行百日咳预防接种,接种起始年龄为≥6周龄,且不晚于8周龄,6月龄内完成3剂基础免疫[130]。
我国现行国家免疫规划中,含百日咳成分的免疫规划疫苗接种程序为4剂次,基础免疫阶段为3、4、5月龄各接种1剂次,加强免疫阶段为18月龄接种1剂次。我国含百日咳成分的免疫规划疫苗首剂接种明显滞后,而且较其他国家少了第5剂(4~6岁)和第6剂(11~18岁)加强,导致国内DTaP接种率虽然维持在较高水平,但百日咳发病呈上升趋势[123]。美国ACIP推荐2月龄~6岁儿童常规接种5剂次DTaP,接种年龄分别在2、4、6、15~18月龄和4~6岁;≥11岁人群接种1剂次白喉类毒素减量的吸附无细胞百白破联合疫苗(Tdap),接种年龄最好在11~12岁,每10年再加强接种1剂[131]。一项调查研究显示,我国北方一所小学百日咳疫情暴发,患儿百日咳疫苗接种完成率高,这项调查表明,完成末次疫苗接种时间>4年的学生罹患百日咳风险是末次疫苗接种时间≤4年学生的3倍[132]。另一项Meta分析结果显示,末次DTaP接种完成后,随着时间推移百日咳患病风险每年可增加1.33倍(95%CI:1.23~1.43),假设疫苗保护力为85%,预计末次DTaP接种8.5年后儿童DTaP疫苗免疫保护力仅有10%[133]。因此,儿童常规4剂次DTaP接种后,可考虑对6岁儿童增加1剂次以加强免疫;≥12岁人群推荐接种含百日咳成分疫苗。
深圳市一项百日咳病例的疫苗免疫史回顾性调查显示,百日咳患儿主要集中在1岁以内,73.05%的患儿未接种过含抗百日咳成分的疫苗。该年龄段的儿童与家庭成员关系最为密切,其活动能力及范围有限,需警惕"成人/青少年-婴幼儿"传播模式的发生,即对<12月龄婴儿的所有密切接触者接种疫苗以降低百日咳传播风险[134],即所谓"蚕茧策略"。目前,美国、法国、瑞士、德国等已开始实施"蚕茧策略"[135]。但因推广疫苗接种操作难度大,难以达到预期目标。"母体免疫"是另一种降低婴幼儿百日咳感染的策略。全球约40多个国家建议孕妇接种DTaP疫苗预防百日咳,以保护出生后的婴儿[136]。孕妇接种DTaP疫苗可预防<3个月婴儿约70%~90%的百日咳感染以及降低90.5%的百日咳相关住院[136]。但我国尚缺乏孕妇接种DTaP疫苗的大样本研究数据。
建议
建议对儿童及时和全程接种DTaP成分疫苗,包括3、4、5月龄基础免疫3剂,18~24月龄加强免疫1剂。将百白破疫苗基础免疫程序首剂次调整到2月龄,以及将6岁白破疫苗调整为DTaP疫苗。≥12岁以上人群的推荐接种含百日咳成分疫苗。
白喉是由产生毒素的白喉杆菌所引起的一种急性呼吸道传染病。白喉杆菌为革兰染色阳性需氧菌,按细菌的形态、菌落、生化特性和对动物的致病力,分为重型(gravis)、中间型(intermedius)、轻型(mitis)和belfanti型,4种生物型均可引起白喉流行。白喉曾给人类带来了极大危害,尤其是儿童。19世纪80年代欧美白喉大流行期间,部分地区病死率高达50%。20世纪70年代前,在低、中等收入国家白喉病例每年达100万例,死亡病例为5万~6万。随着疫苗的广泛覆盖,全球白喉病例已大幅下降,从20世纪中期的每年100万例降至2016年报告的7 097例,但白喉病死率下降不明显,在过去50年里白喉总死亡率为5%~10%,疫苗覆盖率较低的国家报告的病死率超过10%[137,138,139]。
我国自1962年以来,尤其是1987年实施计划免疫以后,白喉的发病率大幅度下降,从以往每年数以10万计儿童发病,到2006年后至今全国已无白喉病例报告[140],达到了控制发病以致基本消除白喉的水平。但是,我国长期实施儿童免疫规划,成人自然感染白喉机会较少,也未进行加强免疫,可能造成成人对白喉杆菌的免疫力减弱而成为易感者。近年来,在疫苗接种覆盖率未达标的国家仍有白喉地方性流行,全球白喉病例主要集中在我国周边的印度、尼泊尔、印度尼西亚、泰国等国家,我国存在白喉病例输入并引起局部暴发流行的风险。因此,白喉仍然是一个重大的潜在的传染病防控问题,仍需得到重视。
人类是白喉杆菌的唯一已知宿主,白喉杆菌通过飞沫和接触皮肤破损部位的分泌物传播。传染源为白喉患者或带菌者,潜伏期大多为2~5 d(范围1~10 d),白喉患者在潜伏期末即有传染性。流行期间典型病例仅占全部患者的2%~6%,无症状带菌者和轻症病例在白喉的传播中具有重要意义。人群普遍易感,儿童易感性最高,新生儿可通过胎盘及母乳获得被动免疫,到1岁时被动所获得的抗体几乎消失,随着年龄的增长易感性逐渐增高。广泛推行免疫接种以前,白喉在学龄前儿童发病率最高,2~5岁为高峰,近年来年龄分布发生了变化,在高发病率国家(2000年至2015年期间≥3年内每年病例超过10例),60%的病例年龄<15岁;低发病率国家(2000年至2015年期间≥3年内每年病例少于10例)则相反,66%的病例年龄>15岁,这表明由于儿童疫苗接种覆盖率的提高,白喉在儿童中发病率有所下降,而在15岁以上的青少年和成人中发病率有所增加[141]。
白喉可能累及任何组织器官黏膜,包括鼻、咽、扁桃体、喉、皮肤、眼和生殖器等。白喉杆菌产生的外毒素又称白喉毒素(diphtheria toxin)是致病的主要因素,可引起组织炎症性坏死,大量炎症细胞浸润,纤维蛋白渗出,局部形成特征性白喉假膜,按发生率依次分为咽白喉、喉白喉、鼻白喉和其他部位的白喉,成人和年长儿童以咽白喉居多,其他类型的白喉较多见于幼儿。白喉毒素从局部经淋巴组织和血液散布全身,对心脏、肾脏和周围神经等器官造成毒性损害。心脏受累是白喉杆菌感染的常见并发症,死亡率高。约1/2~2/3的白喉感染患者有心电图改变,包括非特异性ST-T波改变、心传导阻滞和心律失常[142]。白喉的神经系统并发症包括神经衰弱或麻痹,特别是累及脑神经,也可影响周围神经导致四肢肌无力,咽部和软腭肌肉受累引起食物反流,而导致儿童脑炎的报道罕见[143]。
预防白喉最有效的措施是广泛开展白喉类毒素的主动免疫。目前没有单一抗原的白喉类毒素疫苗,儿童用白喉类毒素疫苗大多与破伤风类毒素抗原联合组成DT疫苗,或与破伤风和百日咳抗原联合成为DTP(DTwP或DTaP)疫苗。WHO建议初免接种3剂含DTP疫苗,作为建立对抗白喉终身免疫力的基础,具体为6周龄时接种第1剂,之后2剂间隔至少4周,在6月龄前应完成初免的第3剂。如初免开始或结束时间推迟,缺少的剂次应尽早补种,2剂次间隔仍至少4周。此后应确保在儿童和青少年期加强接种3剂(分别在12~23月龄、4~7岁和9~15岁接种)含白喉类毒素抗原的联合疫苗,为青少年期和成年期提供免疫保护,理想情况下2次增强剂次间隔至少4年[61]。
我国目前对适龄儿童实施的是5剂次含白喉类毒素成分疫苗常规免疫程序,即在3、4、5和18~24月龄各接种1剂次DTaP疫苗,在6周岁时接种1剂次DT疫苗。有研究证实,给予成人3剂或婴儿4剂白喉类毒素抗原疫苗后,抗白喉毒素抗体水平>0.1 IU/mL可达到95%以上,预测白喉类毒素抗体的临床有效保护率为97%[138]。白喉类毒素疫苗是现有最安全疫苗之一,严重反应较罕见。孕妇和新生儿中也未发现因疫苗接种导致的严重不良反应,系统回顾性研究表明,接种与未接种DTaP母亲所生婴儿的孕龄、出生体质量、Apgar评分和新生儿并发症等差异均无统计学意义[144]。母体抗毒素抗体高滴度可能影响婴儿的免疫应答,或可导致婴儿期在接种前2剂含白喉类毒素疫苗后免疫应答降低,因此在2017年WHO白喉疫苗的意见书中指出,对新生儿白喉预防无需通过孕妇接种疫苗[137]。研究显示大多数婴儿完成3剂初免接种后可产生保护性抗体,含DTP疫苗初免完成后,94%~100%的儿童抗白喉抗体水平>0.01 IU/mL,可获得完全保护作用[137]。
截至2019年,全球约有85%的婴儿(1.16亿)接受了3剂DTP疫苗接种,包括中国在内的125个国家DTP疫苗覆盖率达到90%以上[16],但仍然有部分国家和地区的疫苗接种规划存在不足,2012年在欧盟地区出生的1 120万儿童中,仍有50多万名在1岁前未完成接种3剂DTP疫苗[145]。近年多个国家的白喉病例暴发反映出疫苗接种覆盖率仍需提高和完善。
建议
(1)分别于出生后的3、4、5月龄和18月龄婴幼儿推荐各接种1剂DTaP疫苗,6周岁时推荐接种1剂DT疫苗。
(2)不推荐通过孕妇接种DTaP疫苗方式预防新生儿白喉。
由MTB引起的结核病是严重危害人类健康的重要传染病之一,MTB是一种兼性胞内寄生菌,属于分枝杆菌属。2020年WHO全球结核病报告显示,2019年全球新发病例996万,其中儿童119万,占12%;约140万人死于结核病,其中儿童患者为19.4万[146]。结核病已经超越HIV/AIDS,成为导致死亡的第1位感染性疾病。其中印度(26.0%)、印度尼西亚(8.5%)、中国(8.4%)、菲律宾(6.0%)、巴基斯坦(5.7%)、尼日利亚(4.4%)、孟加拉国(3.64%)和南非(3.6%)等8个国家的结核病病例数占全球30个结核病高负担国家病例总数的2/3(67%)。结核病已经成为全世界由单一病原体导致高死亡率的传染病之一。中国是全球30个结核病高负担国家之一,同时我国是结核病发病率、多重耐药结核病(multidrug-resistant tuberculosis,MDR-TB)、结核/HIV共感染均高发的国家之一。我国2019年结核病新发病数约为83.3万,MDR-TB 5万,结核病死亡病例数为3.94万,估算15岁以下儿童结核病新发病数约9.9万[146]。目前,我国的结核病疫情和防控形势依然严峻,耐药问题突出,因此我国的结核病防治任务仍任重道远。
肺结核患者是结核病的主要传染源,肺结核主要通过呼吸道和空气飞沫传播,也可通过消化道传播。经呼吸道和空气飞沫传播仍是最主要的传播途径,而通过消化道和其他接触途径传播则较为罕见。具有家庭成员结核病接触史的儿童,患结核病的风险是无结核病接触史儿童的8~9倍;且初次感染后的12个月内进展为活动性结核病的风险较高,尤其是前6个月内。人群普遍易感,但年龄越小,感染MTB后发病风险越高。成人感染MTB后仅有5%~15%发展成为活动性结核病,而<1岁儿童感染MTB后,发病风险为40%~59%,1~2岁儿童发病风险为25.0%~43.8%,年长儿和青少年发病风险为10%~30%。先天性结核病主要通过母婴垂直传播,即胎儿在宫内经胎盘感染MTB或在生产过程中吸入或吞咽母体感染MTB的羊膜腔液体而感染。
先天性结核病可表现为喂养困难、反应淡漠、易激惹、咳嗽、发热等,随着疾病进展可出现呼吸困难、肝脾大、淋巴结大等症状。活动性结核病患者根据其发病部位,可分为肺结核和肺外结核。肺结核可分为原发性肺结核、血行播散性肺结核、继发性肺结核、气管/支气管肺结核和结核性胸膜炎等,儿童肺结核多为原发性肺结核,且易发展成粟粒型肺结核和干酪性肺炎。儿童肺结核的临床表现多不典型,轻者无症状,稍重者可以结核感染中毒症状为主,可伴有慢性咳嗽。婴幼儿可急性起病,持续2~3周高热后转为低热。部分患儿可出现眼疱疹性结膜炎、皮肤结节性红斑或多发性一过性关节炎。当胸腔内淋巴结肿大时可出现一系列压迫症状,如痉挛性咳嗽、喘鸣和呼吸困难等。
儿童典型的肺结核症状包括慢性咳嗽、不明原因的体质量不增或下降、间断性发热、盗汗以及咯血等。原发性肺结核病变可以吸收钙化,也可进展或恶化出现支气管结核、干酪性肺炎、结核性胸膜炎和血行播散性肺结核等。肺外结核常受累部位包括淋巴结、泌尿生殖系统、消化系统、浆膜腔、骨与关节、中枢神经系统和皮肤等。儿童肺结核患者更易合并肺外结核,约占儿童结核病例数的50%,如结核性脑膜炎和全身播散性结核病等,因此其临床症状取决于感染部位,往往缺乏特异性。
卡介苗(bacilli calmette-guerin,BCG)是唯一有效预防结核病的疫苗。BCG自问世以来,全球约40亿儿童受惠于该疫苗,研究证实BCG可有效地预防对婴幼儿具有高致死性的结核性脑膜炎和粟粒性肺结核。1974年,WHO的扩大免疫计划首次建议全球普遍接种BCG,至2017年,已有158个国家普遍接种BCG,其中120个国家BCG覆盖率>90%;在30个结核病高负担国家中,覆盖率从53%到99%不等,包括我国在内的21个国家的覆盖率>90%[146]。WHO建议[61],各个国家应该根据其结核病流行病学特点,选择更加合理的BCG接种计划;在结核病高负担国家(包括我国),所有新生儿出生后均应接种BCG;在结核病发病率较低的国家,BCG接种可仅限于高危人群的新生儿和婴儿,或结核菌素皮肤试验(tuberculin skin test,TST)阴性的年长儿童。目前多数发展中国家采取的是新生儿出生时即接种BCG的免疫策略;另外鉴于BCG对儿童和成年人群提供的保护力有限[147,148,149],同时基于疫苗的有效性和成本效益方面的考虑,多数国家取消了对儿童和成人的BCG接种和复种工作[150,151,152]。我国在1997年也停止了BCG的复种工作,但对TST阴性的入伍新兵仍实行BCG接种策略。因BCG是减毒活疫苗,孕期妇女接种后可能导致胎儿发育畸形,所以WHO不推荐孕妇接种[153]。
自1978年,我国将BCG接种纳入计划免疫。《国家免疫规划疫苗儿童免疫程序及说明(2020版)》中建议,新生儿出生时接种1剂,早产儿胎龄>31周且临床情况稳定时,可以接种BCG;胎龄≤31周的早产儿,临床情况稳定时可在出院前接种[154]。由于早产儿和低出生体质量儿BCG接种延迟现象在我国普遍存在,大多临床采用的是在新生儿体质量达到2 500 g启动接种BCG。最近一项系统综述和Meta分析显示,临床情况稳定的早产儿和低出生体质量儿早期接种BCG和延迟接种BCG的安全性、反应原性、TST阳性率是相似的[155]。
建议
(1)新生儿在出生后24 h之内皮内接种BCG(最好与乙肝疫苗同时接种),若未及时接种应在出生后3个月内补种。
(2)中晚期早产儿(胎龄>31周)和低出生体质量儿(<2 500 g),评估个体健康且临床状况稳定的,可以在出生或最迟出院时皮内接种BCG。胎龄≤31周的早产儿,临床情况稳定时可在出院前接种。
(3)如果家族中有免疫缺陷病患者,需要排除新生儿免疫缺陷病以后再接种BCG。
(4)对HIV感染母亲所娩出的新生儿,新生儿HIV病毒检测阴性的可予以接种BCG,HIV感染状况不详的新生儿暂缓接种,HIV病毒检测阳性的感染新生儿不接种BCG。
(5)接受免疫抑制剂治疗的患儿避免接种BCG。
(6)对TST阴性的儿童及青少年,可皮内补种BCG。
(7)不推荐孕妇接种BCG。
Nm通常也称为脑膜炎球菌(meningococcus N.meningitidis),按细菌荚膜多糖可以分为A、B、C、W、Y、X等至少13个血清群,基于主要外膜蛋白porA/porB特征可进一步进行血清型、血清亚型分组,目前已拥有包括100多种(属)分型和基因组数据。
Nm所致疾病在目前仍在全球流行。人感染Nm后可无症状,也可引起严重的侵袭性疾病,Nm感染的临床表现类型主要为脑膜炎和败血症,其中脑膜炎又称流脑,严重者可有脓毒性休克和脑实质损害,部分Nm感染患者表现为暴发起病,可导致迅速死亡。我国在历史上曾属流脑高发国家。每隔8~10年出现一次周期性流脑流行,1938、1949、1959、1967和1977年出现过5次全国性流行疫情,1967年发病率403/10万,发病数以百万计。70年代以后随着Nm多糖疫苗的应用,流脑的流行得到了很好的控制,发病率和死亡率明显降低,但包括我国在内的世界各地仍有中小流行。至今Nm感染仍是一个重要的全球感染性疾病,儿童属易感人群。
流脑传染源为患者或无症状带菌者。患者从潜伏期末至发病后10 d内具有传染性。由于Nm感染后仅1%为典型病例,60%~70%为带菌者,因此带菌者是需要重视的传染源。Nm经呼吸道飞沫及分泌物传播。人口稠密、居室拥挤、空气流通不足、阳光缺乏等均可增加为本病的传播。麻疹或流感感染后,呼吸道黏膜抵抗力降低,易继发流脑。在任何流行区域,婴幼儿、儿童、青少年均是高危人群,其中15岁以下儿童是主要的易感人群,5岁以下儿童更为多见。6个月~2岁的婴幼儿随着母传抗体保护水平下降,流脑发病率逐渐增高。
Nm感染危害着人类特别是儿童的健康。世界高发地区为非洲、亚洲和南美洲,平均发病10/10万。我国自1980年起接种A群Nm多糖疫苗后,发病率大幅度降低,近年来的发病率在0.5/10万。本病主要于冬春季流行,因各地地理位置不同,发病季节略有差异,北方地区每年自冬末开始,次年2-4月达最高峰,5月后渐下降;南方则略晚1~2个月。与国外以B群和C群菌株流行为主不同,我国目前流脑仍以A群和C群为主,不同地区流行血清群和克隆群存在差异[156],1968年之后我国开始出现B群Nm感染病例,近年来监测显示B群流脑呈流行上升态势[157],我国2006年后陆续出现W群、Y群和X群流脑病例报告。
Nm一般经呼吸道感染,感染后临床症状轻重悬殊,可表现为持续带菌状态,或上呼吸道炎症,少部分感染者Nm侵入血循环,发生侵袭性疾病[158]。最常见的Nm感染是急性细菌性脑膜炎,普通型病例初期表现为上呼吸道感染症状,持续1~2 d,此后迅速出现高热、寒战和全身中毒症状,并以皮肤瘀点或瘀斑为其特征性表现。随后出现剧烈头痛、呕吐及脑膜刺激征等表现。暴发型流脑起病急剧,病情凶险,可在24 h内死亡。暴发型可表现为以循环衰竭和DIC为主的休克型,也可表现为以严重神经症状为主的脑膜脑炎型,或者二者兼具的混合型[158]。Nm脑膜炎患者中,大约2/3的患者可出现瘀点瘀斑,除此之外,其临床表现与其他病原引起的细菌性脑膜炎类同[159]。患儿通常以发热、寒战、呕吐、畏光和严重头痛起病,最常见的临床特征是发热、头痛、颈项强直和呕吐。年长儿较年幼儿临床特征更典型,婴儿及新生儿症状可表现为渐起的发热、拒食、易激惹、嗜睡,前囟饱满可能是神经系统受累的主要体征[159]。30%~50%的患者可只有脑膜脑炎,40%的患者同时具有脓毒血症的某些临床表现[159]。暴发型脑膜脑炎者可能发生大片的皮肤坏死,指/趾或肢体的坏疽造成组织缺失或肾上腺皮质出血等并发症[158]。流脑后遗症包括颅神经受损导致耳聋(以单侧居多)、失明、眼球运动神经麻痹,脑实质受损可出现瘫痪、癫痫、智力低下及精神异常。单纯脑膜脑炎死亡多与颅内压升高和脑干受累有关[159]。
除中枢神经系统外,Nm菌血症也可以导致细菌在机体各个组织或器官发生定植繁殖,常见的感染部位包括心包和关节,引起心包炎和化脓性关节炎。慢性脑膜炎奈瑟菌菌血症(chronic meningococcemia)很少被诊断,临床表现为反复瘀点瘀斑,伴有发热、关节痛、关节炎和脾大,如果不治疗,可能进展为急性的脓毒血症[160]。Nm的黏膜感染也可能发生在局部所侵犯的组织,如上呼吸道和下呼吸道、泌尿生殖道和肛门。因为细菌并不通过血液循环到达致病部位,其致病机制与脑膜炎发生机制不同。Nm局部感染可引起黏膜炎症,临床可表现为结膜炎、角膜炎、中耳炎、唾液腺炎、会厌炎、肺炎、子宫颈炎、尿道炎、输卵管炎/骨盆炎、肛门生殖道感染等[161]。Nm感染恢复期的一些并发症与免疫复合物形成相关,包括血管炎(8.4%)、胸膜炎(3.8%)和关节炎(13.8%),这些并发症发生于全身性感染后的第4~10天,通常伴有再次发热和白细胞计数升高[162]。早期诊断和选择敏感抗生素治疗可改善预后。普通型如及时治疗,预后良好,并发症和后遗症少见。但暴发型病例病死率高,脑膜脑炎型及混合型预后较差。<1岁儿童或老年患者预后差。
脑膜炎球菌疫苗种类包括荚膜多糖疫苗、多糖-蛋白偶联疫苗及B群蛋白疫苗。其中多糖疫苗用于控制暴发,包括:A群、两价(AC)、三价(ACW)、四价(ACWY)等疫苗,多糖疫苗对2岁以下人群无效,有效保护期约3年,无群体性免疫效果。结合疫苗(用于常规免疫和控制暴发)可产生5年以上的免疫保护,可清除携带病菌,并产生群体性免疫效果,1岁以内婴幼儿可以使用的结合疫苗包括:C群、A群、AC群、ACWY群等;B群蛋白疫苗包括外膜蛋白的外膜囊(outer membrane vesicles,OMV)疫苗、重组蛋白疫苗(B群,英国常规免疫),主要用于控制暴发。
适龄儿童接种脑膜炎球菌疫苗应遵照《国家免疫规划疫苗儿童免疫程序及说明(2020年版)》的规定执行:A群脑膜炎球菌多糖疫苗(MPSV-A)接种2剂次,分别于6月龄、9月龄各接种1剂;A群C群脑膜炎球菌多糖疫苗(MPSV-AC)接种2剂次,分别于3周岁、6周岁各接种1剂。针对流脑疫情开展应急接种时,应根据引起疫情的菌群和流行病学特征,选择相应种类流脑疫苗;对于<24月龄儿童,如已按流脑结合疫苗说明书接种了规定剂次,可视为完成A群流脑疫苗免疫剂次;在3岁和6岁时按程序各接种1剂流脑多糖疫苗。
孕妇接种脑膜炎球菌疫苗是预防婴幼儿脑膜炎的有效措施,目前该类研究数据主要来自小样本临床研究[163]。一项系统综述汇总了孕妇接种脑膜炎球菌疫苗相关临床研究,其中包括3项对照试验、1项随机对照试验、6项观察性试验,结果均显示孕期接种脑膜炎球菌疫苗未增加不良事件风险[164]。2011年WHO相关文件中指出,脑膜炎球菌结合疫苗及多糖疫苗均可安全用于孕妇[165]。2015年WHO关于A群脑膜炎球菌结合疫苗指南指出,孕妇接种A群脑膜炎球菌结合疫苗是安全的[166]。孕期旅行若前往Nm流行地区或孕妇本身具有Nm感染高风险时,建议接种脑膜炎球菌疫苗[167]。
我国B群流脑呈流行上升态势,但尚无B群疫苗,流脑结合疫苗替代多糖疫苗的科学性和可行性,以及ACWY疫苗的使用策略等仍需要持续进行疫苗应用效果监测与评价。
建议
(1)MPSV-A接种2剂次,分别于6月龄、9月龄各接种1剂次;MPSV-AC接种2剂次,分别于3周岁、6周岁各接种1剂次。
(2)2剂次MPSV-A间隔≥3个月;第1剂MPSV-AC与第2剂MPSV-A,间隔≥12个月;2剂次MPSV-AC间隔≥3年,3年内避免重复接种。
(3)当针对流脑疫情开展应急接种时,应根据引起疫情的菌群和流行病学特征,选择相应种类流脑疫苗。
(4)对于<24月龄儿童,如已接种了规定的流脑结合疫苗剂次,可视为完成A群流脑疫苗免疫接种;在3岁和6岁时按程序各接种1剂流脑多糖疫苗。
(5)孕期妇女有感染风险或到流脑流行地区旅行时,可接种脑膜炎球菌疫苗。
Hi是儿童呼吸道和生殖道标本中经常可以分离到的致病菌之一,属嗜血杆菌属,一般分为可分型有荚膜及未分型无荚膜(non-typable Hemophilus influenzae,NTHi)两类。其中可分型Hi依据荚膜多糖抗原的差异又分为a、b、c、d、e、f 6型,即Hia、Hib、Hic、Hid、Hie、Hif,其中Hib致病力强,常引起侵袭性脑膜炎、肺炎、鼻窦炎和会厌炎等疾病。全球儿童疾病负担调查结果显示,2015年未感染HIV病毒的1~59月龄儿童中,已完成接种Hib疫苗仍有34万Hib感染重症病例,死亡病例29 500例[168]。大多数国家和地区Hib仍是儿童肺炎的主要病原体。对我国202例重症肺炎死亡患儿进行尸检研究,发现15.3%的患儿肺组织存在Hib感染依据[169]。北京、合肥两家医院152例住院肺炎患儿血清学检测发现,细菌感染患儿中Hib感染约占10%[170]。我国儿童脑膜炎中近1/3~1/2的发病都是由Hib感染引起[171,172]。
Hi传染源为Hi感染者及鼻咽部带菌者,Hi可通过飞沫及接触传播,人群普遍易感,尤其是出生后数周至2~3岁的儿童。Hi流行呈季节性分布,以春、冬两季为感染高发期,因气候条件存在差异,各地区Hi感染的高峰季节可能会有所差异[173]。近年来,随着Hib疫苗的广泛接种,Hib感染大量减少,而NTHi已成为全球Hi感染最常见的病原,2007年至2014年间12个欧洲国家侵袭性Hi感染患者中NTHi约占78%[174];浙江地区2012年至2016年收治的1 514例呼吸道Hi感染患儿中NTHi高达93.57%[175]。一项新生儿Hi感染的前瞻性、多中心流行病学调查研究显示,川西地区4家医院确诊Hi肺炎患儿均为NTHi感染[176]。此外,Hia、Hie、Hif菌株感染也陆续被报道[177]。
Hi感染常见的临床表现为脑膜炎、会厌炎、肺炎、蜂窝织炎、血行感染等,脑膜炎临床表现与其他化脓性脑膜炎相仿,常见症状为发热,中枢神经系统临床表现通常缺乏颈项强直体征,随病情进展可出现抽搐或昏迷;1岁以内儿童病程可呈暴发型;起病急骤,患儿可于数小时内死亡;会厌炎以突发会厌水肿为特点,可导致喘鸣、呼吸困难;肺炎起病较缓,常有发热、咳嗽、气促等表现,可出现百日咳样痉挛性咳嗽,有时伴喘息;蜂窝织炎表现为发热、局部组织肿胀、压痛,皮肤呈红蓝色,常见于颊部和眼眶周围;软组织受累可在数小时内迅速进展,由于常合并血行感染,部分患儿可伴有其他感染灶。
预防儿童Hi感染疫苗包括Hib单苗和Hib联合疫苗,如流脑-Hib疫苗、DTaP-Hib疫苗、DTaP-IPV-Hib疫苗、DTaP-IPV-Hib-HepB疫苗等,其中DTaP-IPV-Hib-HepB疫苗尚未在我国上市。Hib单苗及Hib联合疫苗对Hib感染相关疾病具有很好的保护作用,很少发生注射部位局部及全身反应。一项Meta分析显示,Hib结合疫苗预防侵袭性Hib疾病、Hib脑膜炎及Hib肺炎的保护效力分别为84%、75%、69%[178]。对DTaP-IPV-Hib疫苗上市后安全性监测数据进行分析,广州市2011年至2017年DTaP-IPV-Hib疫苗接种后不良反应(adverse events following immunization,AEFI)报告率为72.8/10万,其中大多数AEFI为轻微不良反应[179]。ACIP推荐Hib疫苗常规推荐接种4剂次,接种年龄分别在2、4、6、12~15月龄[18]。
含Hib疫苗在我国属于非免疫规划疫苗,较免疫规划疫苗而言接种率偏低。一项Meta分析显示,截至2016年12月31日,国内12个省份Hib结合疫苗的总覆盖率为54.9%(95%CI:52.9%~57.0%);1、2、3、4剂疫苗覆盖率分别为26.7%、14.8%、13.5%、14.3%,东部地区高于中西部地区[180]。WHO数据显示,2019年189个成员国已将Hib疫苗纳入免疫规划,全球3剂次Hib疫苗覆盖率为85%[181]。对杭州市4个区(县)的多级抽样调查结果显示,户籍为常住儿童并收到推荐接种Hib疫苗告知通知是接种Hib疫苗的促进因素,而Hib疫苗价格高被认为是接种Hib疫苗的阻碍因素[182]。
建议
(1)如无禁忌证,建议5岁以下儿童及时尽早接种含Hib疫苗。
(2)Hib疫苗免疫程序如下:①对于2~6月龄婴儿,推荐每隔1个月或2个月接种1剂,共3剂次,18月龄进行第4剂次加强免疫;②对于6~12月龄婴儿,推荐每隔1个月或2个月接种1剂,共2剂次,18月龄进行第3剂次加强免疫;③对于1.5~5.0岁儿童,仅需接种1剂。
(3)流脑-Hib疫苗、DTaP-Hib疫苗、DTaP-IPV-Hib疫苗等接种程序可参照各生产厂商疫苗说明书。
Spn系α溶血性链球菌一个种属,荚膜多糖为其主要毒力因子,也是其血清分型的依据,没有荚膜的为未分型(non-typable)。目前已鉴定血清型90多种,其中20余种为易感菌株,尤其是儿童和老年群体。Spn相关疾病是导致全球儿童发病率和死亡率居高不下的常见原因,已成为严重的公共卫生问题。2016年全球疾病、伤害和风险因素负担研究显示,Spn是下呼吸道感染发病和死亡的最主要原因[183]。2015年全球范围内1~59月龄未感染HIV儿童中,Spn导致的死亡病例为294 000例,其中81%为肺炎[168]。目前尚缺乏我国儿童Spn疾病的确切流行病学数据[184]。
20%~60%的健康儿童在鼻咽部定植有Spn,定植菌移位导致上下呼吸道感染,也可入侵血流成为侵袭性感染。Spn主要由呼吸道飞沫传播,人群普遍易感,尤以<5岁儿童为甚。Spn感染多流行于冬季及初春,不同国家/地区流行的Spn血清型有所不同,我国儿童当前流行的血清型主要为19A、19F、14、23F和6B等菌株[185]。近年来,随着抗菌药物的广泛使用,Spn耐药迅速出现并持续增多,Spn对多种抗菌药物的耐药为感染防治带来了严峻的挑战。国内的一项对Spn的抗药性Meta分析报告显示,我国大陆儿童侵袭性肺炎链球菌性疾病(invasive pneumococcal disease,IPD)分离的Spn对青霉素、红霉素、克林霉素耐药率分别为32.0%、94.4%和92.3%[186]。Spn引起的感染,依据感染部位不同可分为非侵袭性Spn疾病(non-invasive pneumococcal disease,NIPD)和IPD。NIPD主要包括急性中耳炎、鼻窦炎和非菌血症性肺炎等,而IPD主要包括菌血症、脑膜炎和菌血症性肺炎等。Spn肺炎在年长儿中多表现为典型的大叶性肺炎,年幼儿则多为支气管肺炎;Spn脑膜炎是IPD中最严重的常见疾病,常急性起病,多以发热为首发症状,于发病后不久即出现昏迷、惊厥、休克、脑膜炎及肺炎的临床症状和体征。引起细菌性脑膜炎的3种细菌(外加Hib、Nm)中,Spn脑膜炎病死率最高,后遗症最多[184]。
疫苗接种是Spn肺炎预防的最有效途径。儿童主要用肺炎球菌结合疫苗(pneumococcal conjugate vaccine,PCV),7价(PCV7)已经退出市场,代之以10价和13价苗(PCV10、PCV13)。另外还有肺炎球菌多糖疫苗(pneumococcal polysaccharide vaccine,PPV),目前市场上只有23价PPV23。PCV和PPV单独接种、与其他疫苗同时接种及复种的安全性均良好[187],且可降低Spn鼻咽部定殖率及耐药性。常见不良反应,如接种部位发红、肿胀、疼痛以及发热、寒战、头痛等全身反应均为一过性,多数情况下1~2 d可自然消失。PCV13、PPV23是目前临床使用最为广泛的Spn疫苗,PCV13适用于6周龄~18月龄婴幼儿,覆盖的血清型包括1、3、4、5、6A、6B、7F、9V、14、18C、19F和23F型;PPV的免疫原性不如PCV,故PPV23不适用于幼小婴儿,只适用于2岁以上Spn感染高风险人群,覆盖的血清型包括1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19A、19F、20、22F、23F和33F型[187]。新Spn疫苗仍在不断研发中,包括扩大覆盖15~20种血清型的多价PCV、DNA疫苗和蛋白等其他抗原疫苗。
目前,PCV13在我国属于非免疫规划疫苗,需要按照知情同意、自愿自费的原则进行接种。推荐儿童免疫接种程序按2、4、6月龄或3、4、5月龄进行基础免疫,12~15月龄加强免疫。基础免疫首剂最早可以在6周龄接种,之后各剂间隔4~8周。PPV23只需接种1剂次,最早可在2岁接种[18]。对我国Spn引起侵袭性疾病的血清型分布进行的Meta分析结果显示,PCV13对儿童常见侵袭性Spn血清型的覆盖率为90.0%以上,其中大多为抗菌药物耐药的血清型[187]。我国多中心Ⅲ期临床试验显示,PPV23在>2岁的健康人群中免疫原性及安全性良好,接种1剂次后,49.71%~90.96%的受种者23种Spn血清型抗体呈2倍以上增长,不良反应多为轻、中度[188]。
建议
(1)PCV13:推荐常规免疫接种程序为2、4、6月龄各接种1剂,12~15月龄增强接种1剂。首剂最早可在6周龄接种,之后各剂间隔4~8周。未按免疫接种程序接种疫苗的大龄婴儿及儿童:推荐7~11月龄婴儿接种2剂,每剂次接种至少间隔1个月,12月龄后接种第3剂,与第2剂次接种至少间隔2个月;推荐12~23月龄儿童接种2剂,每剂次接种至少间隔2个月;24月龄至5岁儿童只需接种1剂。
(2)PPV23:推荐2岁及以上合并Spn疾病风险的儿童接种1剂次PCV13,后8周再接种1剂次PPV23,以扩大Spn血清型免疫保护范围。如需复种,复种间隔至少为5年。
随着社会的发展、经济条件的改善、管理和护理措施的有效实施以及疫苗的应用,儿童呼吸道感染发病率及死亡率在过去十几年中大幅下降。疫苗是现代预防医学最成功的发现之一,其免疫预防接种是预防、控制和消灭儿童常见呼吸道病原感染的有效手段。全球范围内,已超过10亿儿童接种了疫苗,预计每年可避免200万~300万人死亡[16]。根据免疫方式不同,疫苗可分为主动免疫和被动免疫;按疫苗抗原种类及数量,疫苗又可分为单价疫苗、多价疫苗以及联合疫苗等。我国自2007年开始扩大国家免疫规划范围,疫苗种类由原来的6种扩大至14种,可预防传染病扩大至15种,儿童若需完成全部免疫接种,2岁前需接种疫苗20余剂次,接种针次过多,不但增加社会成本,还增加疑似预防接种异常反应风险。发展联合疫苗是方向,可减少注射次数,降低漏种、迟种率,获得更高的依从性及免疫覆盖率,并降低管理、储存及运输成本。严格来说PCV和PPV也是一种联合疫苗。目前国外已上市六联疫苗,如DTaP-IPV-Hib-HepB疫苗能同时预防百日咳、白喉、破伤风、脊髓灰质炎、乙肝及b型Hi感染,而国内目前只有五联疫苗在上市使用,而纳入免疫规划的疫苗仅有百白破、麻腮风三联疫苗,与国际领先水平尚有一定差距。
流感疫苗、Hib疫苗、Spn疫苗等在我国大多数地区均为非免疫规疫苗,需自费、自愿接种。早日将这些疫苗纳入国家免疫规划中是我们努力的目标。为促进我国儿童疫苗接种覆盖率,降低常见呼吸道病原对公众健康的危害和经济负担,各级疾控中心发挥了积极的作用:一方面组织开展科学普及、健康教育、风险沟通和疫苗政策推进活动;另一方面制定并实施了疫苗接种计划,组织并指导疫苗接种,包括剂型选择、接种程序、接种时机等技术环节的把控。随着社会经济的增长、卫生保健水平的提高以及免疫预防意识的升级,大量未满足的免疫预防需求亟待填补。尚需充分发挥已有疫苗作为公共卫生卫士的潜力,构建呼吸道病原感染屏障,尚需政府部门、疾控中心、社区卫生中心、儿童家长等多方携手,助力预防先行,广泛提高疫苗接种覆盖率。
参加本共识讨论及撰写的专家(按姓氏拼音排序):冯铁建(深圳市疾病预防控制中心);关文达(国家呼吸医学中心,广州呼吸健康研究院);何剑峰(广东省疾病预防控制中心);蒋荣猛(首都医科大学附属北京地坛医院);刘钢(首都医科大学附属北京儿童医院);卢根(广州市妇女儿童医疗中心);陆权(上海交通大学附属儿童医院);申阿东(首都医科大学附属北京儿童医院);申昆玲(首都医科大学附属北京儿童医院);孙丽红(国家呼吸医学中心,广州呼吸健康研究院);孙晓冬(上海市疾病预防控制中心);杨永弘(首都医科大学附属北京儿童医院);杨子峰(国家呼吸医学中心,广州呼吸健康研究院);曾玫(复旦大学附属儿科医院);钟南山(国家呼吸医学中心,广州呼吸健康研究院);周久顺(四川省疾病预防控制中心)
所有作者均声明不存在利益冲突
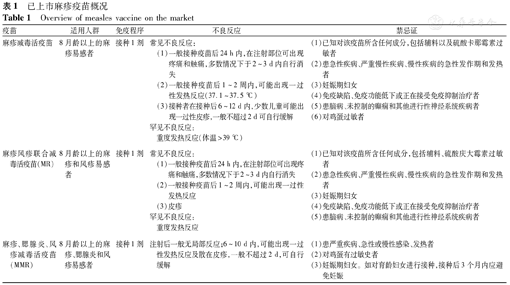
已上市麻疹疫苗概况
Overview of measles vaccine on the market
已上市麻疹疫苗概况
Overview of measles vaccine on the market
| 疫苗 | 适用人群 | 免疫程序 | 不良反应 | 禁忌证 |
|---|---|---|---|---|
| 麻疹减毒活疫苗 | 8月龄以上的麻疹易感者 | 接种1剂 | 常见不良反应:(1)一般接种疫苗后24 h内,在注射部位可出现疼痛和触痛,多数情况下于2~3 d内自行消失(2)一般接种疫苗后1~2周内,可能出现一过性发热反应(37.1~37.5 ℃) (3)接种者在接种后6~12 d内,少数儿童可能出现一过性皮疹,一般不超过2 d可自行缓解罕见不良反应:重度发热反应(体温>39 ℃) | (1)已知对该疫苗所含任何成分,包括辅料以及硫酸卡那霉素过敏者(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者(3)妊娠期妇女(4)免疫缺陷、免疫功能低下或正在接受免疫抑制治疗者(5)患脑病、未控制的癫痫和其他进行性神经系统疾病者(6)对鸡蛋过敏者 |
| 麻疹风疹联合减毒活疫苗(MR) | 8月龄以上的麻疹和风疹易感者 | 接种1剂 | 常见不良反应:(1)一般接种疫苗后24 h内,在注射部位可出现疼痛和触痛,多数情况下于2~3 d内自行消失(2)一般接种疫苗后1~2周内,可能出现一过性发热反应(3)皮疹罕见不良反应: 重度发热反应 | (1)已知对该疫苗所含任何成分,包括辅料、硫酸庆大霉素过敏者(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者(3)妊娠期妇女(4)免疫缺陷、免疫功能低下或正在接受免疫抑制治疗者(5)患脑病、未控制的癫痫和其他进行性神经系统疾病者 |
| 麻疹、腮腺炎、风疹减毒活疫苗(MMR) | 8月龄以上的麻疹、腮腺炎和风疹易感者 | 接种1剂 | 注射后一般无局部反应;6~10 d内,可能出现一过性发热反应及散在皮疹,一般不超过2 d,可自行缓解 | (1)患严重疾病、急性或慢性感染、发热者(2)对鸡蛋有过敏史者(3)妊娠期妇女。如对育龄妇女进行接种,接种后3个月内应避免妊娠 |
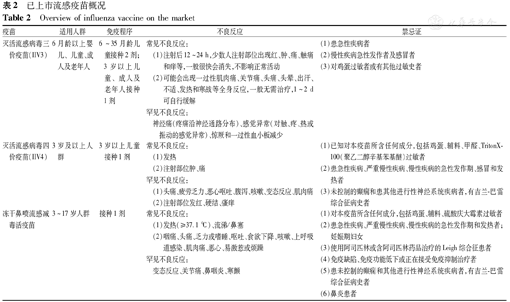
已上市流感疫苗概况
Overview of influenza vaccine on the market
已上市流感疫苗概况
Overview of influenza vaccine on the market
| 疫苗 | 适用人群 | 免疫程序 | 不良反应 | 禁忌证 |
|---|---|---|---|---|
| 灭活流感病毒三价疫苗(IIV3) | 6月龄以上婴儿﹑儿童、成人及老年人 | 6~35月龄儿童接种2剂;3岁以上儿童﹑成人及老年人接种1剂 | 常见不良反应:(1)注射后12~24 h,少数人注射部位出现红、肿、痛、触痛和痒等,一般很快会消失,不影响正常活动(2)可能会出现一过性肌肉痛、关节痛、头痛、头晕、出汗、不适、发热和寒战等全身反应,一般无需治疗,1~2 d可自行缓解罕见不良反应:神经痛(疼痛沿神经通路分布)、感觉异常(对触、疼、热或振动的感觉异常)、惊厥和一过性血小板减少 | (1)患急性疾病者(2)慢性疾病急性发作者及感冒者(3)对鸡蛋过敏者或有其他过敏史者 |
| 灭活流感病毒四价疫苗(IIV4) | 3岁及以上人群 | 3岁以上儿童接种1剂 | 常见不良反应:(1)发热(2)注射部位肿、痛罕见不良反应:(1)头痛、疲劳乏力、恶心呕吐、腹泻、咳嗽、变态反应、肌肉痛(2)注射部位发红、硬结、瘙痒 | (1)已知对本疫苗所含任何成分,包括鸡蛋、辅料、甲醛、TritonX-100(聚乙二醇辛基苯基醚)过敏者(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期、感冒和发热者(3)未控制的癫痫和患其他进行性神经系统疾病者,有吉兰-巴雷综合征病史者 |
| 冻干鼻喷流感减毒活疫苗 | 3~17岁人群 | 接种1剂 | 常见不良反应:(1)发热(≥37.1 ℃)、流涕/鼻塞(2)咽痛、头痛、乏力或嗜睡、呕吐、食欲下降、咳嗽、上呼吸道感染、肌肉痛、恶心、易激惹或烦躁罕见不良反应:变态反应、关节痛、鼻咽炎、寒颤 | (1)对本疫苗所含任何成分,包括鸡蛋、辅料、硫酸庆大霉素过敏者(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;妊娠期妇女(3)使用阿司匹林或含阿司匹林药品治疗的Leigh综合征患者(4)免疫缺陷、免疫功能低下或正在接受免疫抑制治疗者(5)患未控制的癫痫和其他进行性神经系统疾病者,有吉兰-巴雷综合征病史者(6)鼻炎患者 |

已上市水痘疫苗概况
Overview of varicella vaccine on the market
已上市水痘疫苗概况
Overview of varicella vaccine on the market
| 疫苗 | 适用人群 | 免疫程序 | 不良反应 | 禁忌证 |
|---|---|---|---|---|
| 水痘减毒活疫苗 | 12月龄~12岁健康水痘易感者 | 12月龄~12岁接种1剂 | 常见不良反应:(1)发热(2)接种部位发红、肿胀、瘙痒、疼痛、硬结、腹泻、皮疹、哭闹、嗜睡、厌食、头痛、乏力罕见不良反应:变态反应、皮疹、硬结、触痛 | (1)已知对该疫苗所含任何成分,包括辅料以及红霉素过敏者(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者(3)妊娠期妇女(4)免疫缺陷、免疫功能低下或正在接受免疫抑制治疗者(5)患脑病、未控制的癫痫和其他进行性神经系统疾病者(6)有先天性免疫缺陷病史或密切接触的家庭成员中有先天性免疫缺陷病史的个体 |
| 疫苗研发者 | 疫苗平台 | 疫苗类型 | 剂次 | 接种时机 | 接种途径 | 研发阶段 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1期 | 1/2期 | 2期 | 3期 | 4期 | ||||||
| 牛津大学/阿斯利康 | 非复制型病毒载体 | ChAdOx1-S-(AZD1222) (Covishield) | 1~2 | 0、28 d | 肌内注射 | PACTR202005681895696 | PACTR2020069221651322020-001072-15 | NCT04686773 | ISRCTN89951424 | NCT04760132 |
| ISRCTN69254139 | NCT04516746 | NCT04775069 | ||||||||
| NCT04800133 | NCT04540393 | EUCTR2021-002327-38-NL | ||||||||
| NCT04568031 | NCT04860739a | NCT04536051 | ||||||||
| NCT04444674 | NCT04894435 | EUCTR2020-005226-28-DE | NCT04914832 | |||||||
| NCT04324606 | ISRCTN73765130a | ACTRN12621000661875 | ||||||||
| NCT04684446 | NCT04907331 | NCT04864561 | ||||||||
| ISRCTN15638344 | NCT04998240 | |||||||||
| NCT04760730 | ||||||||||
| 北京科兴中维生物技术有限公司 | 灭活 | CoronaVac;SARS-CoV-2灭活疫苗(Vero cell) | 2 | 0、14 d | 肌内注射 | - | NCT04383574 | NCT04800133 | NCT04456595 | NCT04756830a |
| NCT04352608 | NCT04884685 | NCT04508075 | NCT04747821a | |||||||
| NCT04551547 | NCT04979949 | NCT04582344 | NCT04775069 | |||||||
| NCT04992182 | NCT04617483 | NCTO4789356 | ||||||||
| NCT04651790 | NCT04754698 | |||||||||
| NCT04992260 | NCT04801888 | |||||||||
| NCT04894227 | ||||||||||
| NCT04892459 | ||||||||||
| NCT04911790 | ||||||||||
| NCT04953325 | ||||||||||
| NCT04962308 | ||||||||||
| NCT04993365 | ||||||||||
| 武汉生物制品研究所 | 灭活 | SARS-CoV-2灭活疫苗(Vero cell) | 2 | 0、14 d或0、21 d | 肌内注射 | - | ChiCTR2000031809 | - | ChiCTR2000034780 | - |
| ChiCTR2000039000 | ||||||||||
| NCT04510207 | ||||||||||
| NCT04612972 | ||||||||||
| 北京生物制品研究所 | 灭活 | BBIBP-CorV;SARS-CoV-2灭活疫苗(Vero cell) | 2 | 0、14 d或0、21 d | 肌内注射 | - | ChiCTR2000032459 | NCT04998240 | NCT04560881 | NCT04863638 |
| NCT04917523 | ||||||||||
| NCT04510207 | ||||||||||
| NCT04984408 | ||||||||||
| Moderna/美国国立过敏与传染病研究所 | RNA | mRNA-1273 | 2 | 0、28 d | 肌内注射 | NCT04283461 | NCTO4677660 | NCT04405076a | NCT04470427 | NCT04760132 |
| NCT04839315 | NCTO4712110 | NCT04761822 | NCT04811664 | NCT04792567 | ||||||
| NCT04889209 | NCT04894435 | NCT04805125 | NCT04885907 | |||||||
| ISRCTN73765130a | NCT04806113 | EUCTR2021-002327-38-NL | ||||||||
| NCT04930770 | NCT04860297 | EUCTR2021-003388-90-NL | ||||||||
| NCT04969263 | NCT04952402 | |||||||||
| EUCTR2021-003618-37-NO | ||||||||||
| NCT04969250 | ||||||||||
| BioNTech/复星医药/辉瑞 | RNA | BNT162b2(3 LNP-mRNAs) | 2 | 0、28 d | 肌内注射 | NCT04523571 | NCT04588480 | NCT04649021 | NCT04368728a | NCT04760132 |
| ChiCTR2000034825 | NCT04380701 | NCT04761822 | NCT04713553 | ACTRN12621000661875 | ||||||
| NCT04816643 | NCT04537949 | NCT04824638a | NCT04800133 | EUCTR2021-000412-28-BE | ||||||
| NCT04839315 | EUCTR2020-003267-26-DE | NCT04860739 | NCT04805125 | EUCTR2021-002327-38-NL | ||||||
| NCT04936997 | NCT04889209 | EUCTR2021-001978-37-ES | NCT04816669 | NCT04780659 | ||||||
| NCT04969601 | NCT04894435 | NCT04951323 | NCT04961229 | |||||||
| ISRCTN73765130a | NCT04775069 | |||||||||
| NCT04895982 | EUCTR2021- | |||||||||
| NCT04907331 | 000893-27-BE | |||||||||
| NCT04949490 | EUCTR2021- | |||||||||
| NCT04969263 | 000930-32-BE | |||||||||
| NCT04852861a | ||||||||||
| NCT04878211 | ||||||||||
| EUCTR2021-003388-90-NL | ||||||||||
| EUCTR2021-003618-37-NO | ||||||||||
| NCT04955626 | ||||||||||
| NCT04952766 | ||||||||||
| NCT04969250 | ||||||||||
| 安徽智飞龙科马/中国科学院微生物研究所 | 蛋白质亚基 | 重组SARS-CoV-2疫苗(CHO细胞) | 2~3 | 0、28 d或0、28、56 d | 肌内注射 | NCT04445194 | NCT04550351 | NCT04466085 | NCT04646590 | - |
| ChiCTR2000035691 | NCT04812562 | |||||||||
| NCT04636333 | ||||||||||
| 康希诺生物股份公司/北京生物技术研究所/中国人民解放军军事科学院 | 非复制型病毒载体疫苗 | 重组新型冠状病毒疫苗(5型腺病毒载体) | 1 | 0 | 肌内注射 | ChiCTR2000030906 | NCT04398147 | ChiCTR2000031781 | NCT04526990 | NCT04892459 |
| NCT04313127 | NCT04840992 | NCT04566770 | NCT04540419 | |||||||
| NCT04568811 | NCT04341389 | |||||||||
| NCT04552366 | NCT05005156 | |||||||||
| 中国医学科学院医学生物学研究所 | 灭活 | SARS-CoV-2疫苗(Vero cells) | 2 | 0、28 d | 肌内注射 | - | NCT04470609 | - | NCT04659239 | - |
| NCT04412538 | ||||||||||
| 赛诺菲巴斯德/葛兰素史克 | 蛋白质亚基 | VAT00002:SARS-CoV-2 s蛋白佐剂 | 2 | 0、21 d | 肌内注射 | - | NCT04537208 | NCT04762680 | PACTR202011523101903b | - |
| NCT04904549 | ||||||||||
| 四川大学华西医院 | 蛋白质亚基 | RBD(在Sf9细胞中表达杆状病毒) | 2 | 0、28 d | 肌内注射 | ChiCTR2000037518 | - | ChiCTR2000039994 | NCT04887207 | - |
| NCT04530656 | NCT04640402 | NCT04904471 | ||||||||
| NCT04718467 | ||||||||||
| 赛诺菲巴斯德/ Translate Bio | RNA | MRT 5500,mRNA候选疫苗 | 2 | 0、12 d | 肌内注射 | - | NCT04798027 | IRCT20210206050259N2 | - | - |
注:数据来源于世界卫生组织官网,数据收集截止日期2021年8月27日;a疫苗对SARS-CoV-2变异株的有效性评估试验;b待对注册表中未指明的研究阶段进行确认 The data comes from the World Health Organization official website,and the data collection deadline is August 27,2021;atrials that have indicated assessment of vaccine efficacy against SARS-CoV-2 variants;bpending confirmation on the phase of study which is not specified in the registry
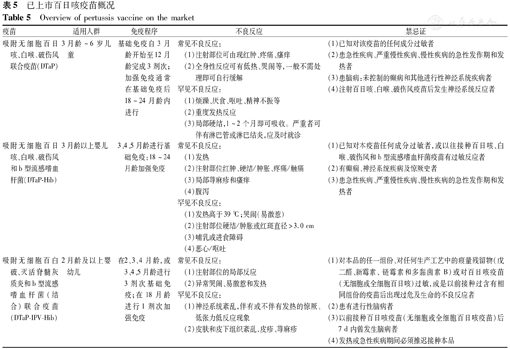
已上市百日咳疫苗概况
Overview of pertussis vaccine on the market
已上市百日咳疫苗概况
Overview of pertussis vaccine on the market
| 疫苗 | 适用人群 | 免疫程序 | 不良反应 | 禁忌证 |
|---|---|---|---|---|
| 吸附无细胞百日咳、白喉、破伤风联合疫苗(DTaP) | 3月龄~6岁儿童 | 基础免疫自3月龄开始至12月龄完成3剂次;加强免疫通常在基础免疫后18~24月龄内进行 | 常见不良反应:(1)注射部位可由现红肿、疼痛、瘙痒(2)全身性反应可有低热、哭闹等,一般不需处理即可自行缓解罕见不良反应:(1)烦躁、厌食、呕吐、精神不振等(2)重度发热反应(3)局部硬结,1~2个月即可吸收。严重者可伴有淋巴管或淋巴结炎,应及时就诊 | (1)已知对该疫苗的任何成分过敏者(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者(3)患脑病:未控制的癫病和其他进行性神经系统疾病者(4)注射百日咳、白喉、破伤风疫苗后发生神经系统反应者 |
| 吸附无细胞百日咳、白喉、破伤风和b型流感嗜血杆菌(DTaP-Hib) | 3月龄以上婴儿 | 3、4、5月龄进行基础免疫;18~24月龄加强免疫 | 常见不良反应:(1)发热(2)注射部位红肿、硬结/肿胀、疼痛/触痛(3)局部荨麻疹和瘙痒(4)腹泻罕见不良反应:(1)发热高于39 ℃;哭闹(易激惹) (2)注射部位硬结/肿胀或红斑直径>3.0 cm(3)哺乳或进食障碍(4)恶心/呕吐 | (1)已知对本疫苗任何成分过敏者,或以往接种百日咳、白喉、破伤风和b型流感嗜血杆菌疫苗有过敏反应者(2)有癫痫、神经系统疾病及惊厥史者(3)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者 |
| 吸附无细胞百白破、灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗(DTaP-IPV-Hib) | 2月龄及以上婴幼儿 | 在2、3、4月龄,或3、4、5月龄进行3剂次基础免疫;在18月龄进行1剂次加强免疫 | 常见不良反应:(1)注射部位的局部反应(2)异常哭闹、易激惹和发热罕见不良反应:(1)神经系统紊乱,伴有或不伴有发热的惊厥、低张力低反应现象(2)皮肤和皮下组织紊乱,皮疹、荨麻疹 | (1)对本品的任一组份、对任何生产工艺中的痕量残留物(戊二醛、新霉素、链霉素和多黏菌素B)或对百日咳疫苗(无细胞或全细胞百日咳)过敏,或是以前接种过含有相同组份的疫苗后出现过危及生命的不良反应者(2)患有进行性脑病者(3)以前接种百日咳疫苗(无细胞或全细胞百日咳疫苗)后7 d内曾发生脑病者(4)发热或急性疾病期间必须推迟接种本品 |
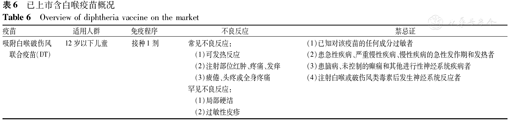
已上市含白喉疫苗概况
Overview of diphtheria vaccine on the market
已上市含白喉疫苗概况
Overview of diphtheria vaccine on the market
| 疫苗 | 适用人群 | 免疫程序 | 不良反应 | 禁忌证 |
|---|---|---|---|---|
| 吸附白喉破伤风联合疫苗(DT) | 12岁以下儿童 | 接种1剂 | 常见不良反应:(1)可发热反应(2)注射部位红肿、疼痛、发痒(3)疲倦、头疼或全身疼痛罕见不良反应:(1)局部硬结(2)过敏性皮疹 | (1)已知对该疫苗的任何成分过敏者(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者(3)患脑病、未控制的癫痫和其他进行性神经系统疾病者(4)注射白喉或破伤风类毒素后发生神经系统反应者 |
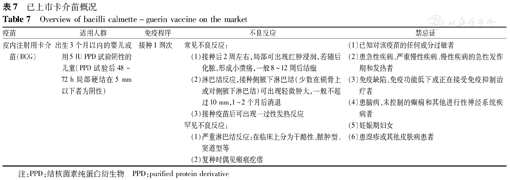
已上市卡介苗概况
Overview of bacilli calmette-guerin vaccine on the market
已上市卡介苗概况
Overview of bacilli calmette-guerin vaccine on the market
| 疫苗 | 适用人群 | 免疫程序 | 不良反应 | 禁忌证 |
|---|---|---|---|---|
| 皮内注射用卡介苗(BCG) | 出生3个月以内的婴儿或用5 IU PPD试验阴性的儿童(PPD试验后48~72 h局部硬结在5 mm以下者为阴性) | 接种1剂次 | 常见不良反应:(1)接种后2周左右,局部可出现红肿浸润,若随后化脓,形成小溃疡,一般8~12周后结痂(2)淋巴结反应,接种侧腋下淋巴结(少数在锁骨上或对侧腋下淋巴结)可出现轻微肿大,一般不超过10 mm,1~2个月后消退(3)接种疫苗后可出现一过性发热反应罕见不良反应:(1)严重淋巴结反应:在临床上分为干酪性、脓肿型、窦道型等(2)复种时偶见瘢痕疙瘩 | (1)已知对该疫苗的任何成分过敏者(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者(3)免疫缺陷、免疫功能低下或正在接受免疫抑制治疗者(4)患脑病、未控制的癫痫和其他进行性神经系统疾病者(5)妊娠期妇女(6)患湿疹或其他皮肤病患者 |
注:PPD:结核菌素纯蛋白衍生物 PPD:purified protein derivative
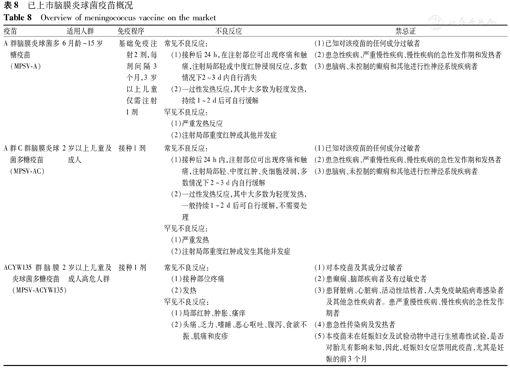
已上市脑膜炎球菌疫苗概况
Overview of meningococcus vaccine on the market
已上市脑膜炎球菌疫苗概况
Overview of meningococcus vaccine on the market
| 疫苗 | 适用人群 | 免疫程序 | 不良反应 | 禁忌证 |
|---|---|---|---|---|
| A群脑膜炎球菌多糖疫苗(MPSV-A) | 6月龄~15岁 | 基础免疫注射2剂,每剂间隔3个月,3岁以上儿童仅需注射1剂 | 常见不良反应:(1)接种后24 h,在注射部位可出现疼痛和触痛,注射局部轻或中度红肿浸润反应,多数情况下2~3 d内自行消失(2)一过性发热反应,其中大多数为轻度发热,持续1~2 d后可自行缓解罕见不良反应:(1)严重发热反应(2)注射局部重度红肿或其他并发症 | (1)已知对该疫苗的任何成分过敏者(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者(3)患脑病、未控制的癫痫和其他进行性神经系统疾病者 |
| A群C群脑膜炎球菌多糖疫苗(MPSV-AC) | 2岁以上儿童及成人 | 接种1剂 | 常见不良反应:(1)接种后24 h内,注射部位可出现疼痛和触痛,注射局部轻、中度红肿、炎细胞浸润,多数情况下2~3 d内自行缓解(2)一过性发热反应,其中大多数为轻度发热,一般持续1~2 d后可自行缓解,不需要处理罕见不良反应:(1)严重发热(2)注射局部重度红肿或发生其他并发症 | (1)已知对该疫苗的任何成分过敏者(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者(3)患脑病、未控制的癫痫和其他进行性神经系统疾病者 |
| ACYW135群脑膜炎球菌多糖疫苗(MPSV-ACYW135) | 2岁以上儿童及成人高危人群 | 接种1剂 | 常见不良反应:(1)接种部位疼痛(2)发热罕见不良反应:(1)局部红肿、肿胀、瘙痒(2)头痛、乏力、嗜睡、恶心呕吐、腹泻、食欲不振、肌痛和皮疹 | (1)对本疫苗及其成分过敏者(2)患癫痫、脑部疾病者及有过敏史者(3)患肾脏病、心脏病、活动性结核者,人类免疫缺陷病毒感染者及其他急性疾病者。患严重慢性疾病、慢性疾病的急性发作期者(4)患急性传染病及发热者(5)本疫苗未在妊娠妇女及试验动物中进行生殖毒性试验,是否对胎儿有影响未知,因此,妊娠妇女应禁用此疫苗,尤其是妊娠的前3个月 |

已上市含b型流感嗜血杆菌疫苗概况
Overview of haemophilus influenzae type b vaccine on the market
已上市含b型流感嗜血杆菌疫苗概况
Overview of haemophilus influenzae type b vaccine on the market
| 疫苗 | 适用人群 | 免疫程序 | 不良反应 | 禁忌证 |
|---|---|---|---|---|
| b型流感嗜血杆菌结合疫苗(Hib) | 3月龄~5岁儿童 | 自3月龄开始:每隔1个月或2个月接种1剂,共3剂,在18个月时进行加强接种1剂6~12月龄儿童:每隔1个月或2个月接种1剂,共2剂,在18个月时进行加强接种1剂1~5岁儿童:仅需接种1剂 | 常见不良反应:(1)接种部位轻微红肿、硬结、压痛(2)发热反应(多在38.5 ℃以下)罕见不良反应:(1)烦躁、嗜睡、呕吐、腹泻、食欲不振、非典型的皮疹(2)局部瘙痒感 | (1)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热(2)已知对本疫苗的任何成份过敏,特别对破伤风类毒素过敏者(3)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者(4)严重心脏疾病、高血压,患肝脏疾病、肾脏疾病者(5)已知既往接种b型流感嗜血杆菌结合疫苗后出现过敏反应者(6)在发热或急性疾病期间,应该推迟进行接种 |
| 吸附无细胞百日咳、白喉、破伤风和b型流感嗜血杆菌(DTaP-Hib) | 3月龄以上婴儿 | 3、4、5月龄进行基础免疫;18~24月龄加强免疫 | 常见不良反应:(1)注射部位红肿、硬结/肿胀、疼痛/触痛(2)发热(3)局部荨麻疹和瘙痒(4)腹泻罕见不良反应:(1)注射部位硬结/肿胀或红斑直径>3.0 cm(2)发热高于39℃;哭闹(易激惹) (3)哺乳或进食障碍(4)恶心/呕吐 | (1)已知对本疫苗任何成分过敏者,或以往接种百日咳、白喉、破伤风和b型流感嗜血杆菌疫苗有过敏反应者(2)有癫痫、神经系统疾病及惊厥史者(3)对中度或严重疾病的儿童,包括急性传染病(包括恢复期)及发热者应推迟接种本疫苗 |
| 吸附无细胞百白破、灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗(DTaP-IPV-Hib) | 2月龄及以上婴幼儿 | 在2、3、4月龄,或3、4、5月龄进行3剂次基础免疫;在18月龄进行1剂次加强免疫 | 常见不良反应:(1)注射部位的局部反应(2)异常哭闹、易激惹和发热罕见不良反应:(1)神经系统紊乱,伴有或不伴有发热的惊厥、低张力低反应现象(2)皮肤和皮下组织紊乱,皮疹、荨麻疹 | (1)对本品的任一组份、对任何生产工艺中的痕量残留物(戊二醛、新霉素、链霉素和多黏菌素B)或对百日咳疫苗(无细胞或全细胞百日咳)过敏,或以前接种过含有相同组分的疫苗后出现过危及生命的不良反应者(2)患有进行性脑病者(3)以前接种百日咳疫苗(无细胞或全细胞百日咳疫苗)后7 d内曾发生脑病者(4)发热或急性疾病期间必须推迟接种本品 |
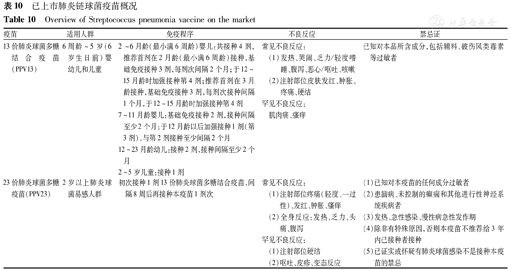
已上市肺炎链球菌疫苗概况
Overview of Streptococcus pneumonia vaccine on the market
已上市肺炎链球菌疫苗概况
Overview of Streptococcus pneumonia vaccine on the market
| 疫苗 | 适用人群 | 免疫程序 | 不良反应 | 禁忌证 |
|---|---|---|---|---|
| 13价肺炎球菌多糖结合疫苗(PPV13) | 6周龄~5岁(6岁生日前)婴幼儿和儿童 | 2~6月龄(最小满6周龄)婴儿:共接种4剂,推荐首剂在2月龄(最小满6周龄)接种,基础免疫接种3剂,每剂次间隔2个月;于12~15月龄时加强接种第4剂;推荐首剂在3月龄接种,基础免疫接种3剂,每剂次接种间隔1个月,于12~15月龄时加强接种第4剂7~11月龄婴儿:基础免疫接种2剂,接种间隔至少2个月;于12月龄以后加强接种1剂(第3剂),与第2剂接种至少间隔2个月12~23月龄幼儿:接种2剂,接种间隔至少2个月2~5岁儿童:接种1剂 | 常见不良反应:(1)发热、哭闹、乏力/轻度嗜睡、腹泻、恶心/呕吐、咳嗽(2)注射部位皮肤发红、肿胀、疼痛、硬结罕见不良反应:肌肉痛、瘙痒 | 已知对本品所含成分,包括辅料、破伤风类毒素等过敏者 |
| 23价肺炎球菌多糖疫苗(PPV23) | 2岁以上肺炎球菌易感人群 | 初次接种1剂13价肺炎球菌多糖结合疫苗,间隔8周后再接种本疫苗1剂次 | 常见不良反应:(1)注射部位疼痛(轻度、一过性)、发红、肿胀、瘙痒(2)全身反应:发热、乏力、头痛、腹泻罕见不良反应:(1)注射部位硬结(2)呕吐、皮疹、变态反应 | (1)已知对本疫苗的任何成分过敏者(2)患脑病、未控制的癫痫和其他进行性神经系统疾病者(3)发热、急性感染、慢性病急性发作期(4)除非有特殊原因,否则本疫苗不推荐给3年内已接种者接种(5)已证实或怀疑有肺炎球菌感染不是接种本疫苗的禁忌 |

儿童常见呼吸道病原免疫预防国内/外政策及指南
Domestic and foreign policies and guidelines of immunoprophylaxis vaccine of common respiratory pathogens in children
儿童常见呼吸道病原免疫预防国内/外政策及指南
Domestic and foreign policies and guidelines of immunoprophylaxis vaccine of common respiratory pathogens in children
| 编号 | 国内/外政策、指南 | 网址 | |
|---|---|---|---|
| 1 | 中国 | 中国流感疫苗预防接种技术指南(2020-2021) | http://www.chinacdc.cn/jkzt/crb/bl/lxxgm/jszl_2251/202009/W020200911453959167308.pdf |
| 2 | 中国疾控中心预防接种工作规范 | http://www.chinacdc.cn/jkzt/ymyjz/ymsysm_10961/201801/P020180104574666735075.pdf | |
| 3 | 国家免疫规划疫苗儿童免疫程序及说明(2021年版) | http://www.nhc.gov.cn/jkj/s3581/202103/590a8c7915054aa682a8d2ae8199e222.shtml | |
| 4 | 国家免疫规划疫苗儿童免疫程序及说明(2016版) | http://xxgk.zhoushan.gov.cn/art/2020/6/2/art_1229007389_44598579.html | |
| 5 | 中国儿童肺炎发病及疫苗普及白皮书 | https://v.qq.com/x/page/y095247z3e3.html | |
| 6 | 儿童新型冠状病毒感染诊断、治疗和预防专家共识 | http://rs.yiigle.com/CN101070202002/1185578.htm | |
| 7 | 儿童腺病毒肺炎诊疗规范(2019年版) | http://www.nhc.gov.cn/yzygj/s7653/201902/bfa758ad6add48a599bc74b588a6e89a.shtml | |
| 8 | 2019-2020 AAP儿童流感的预防与控制建议 | https://pediatrics.aappublications.org/content/144/4/e20192478.long | |
| 9 | 儿童流感嗜血杆菌感染诊断及治疗专家建议 | http://rs.yiigle.com/CN112140201909/1161597.htm | |
| 10 | 肺炎球菌性疾病免疫预防专家共识(2020版) | http://chinaepi.icdc.cn/zhlxbxen/ch/reader/view_abstract.aspx?file_no=085&flag=1 | |
| 11 | 中国脑膜炎球菌疫苗预防接种专家共识(2019版) | http://www.pubhealth.org.cn/cn/wxshow6053.html | |
| 12 | 中国儿童肺炎链球菌性疾病诊断、治疗和预防专家共识(2020版) | http://rs.yiigle.com/cn101070202007/1197848.htm | |
| 13 | WHO | WHO关于常规免疫接种的建议(WHO recommendations for routine immunization) | https://www.who.int/immunization/policy/immunization_tables/en/ |
| 14 | WHO关于儿童常规免疫接种的建议(Recommended Routine Immunizations for Children) | https://www.who.int/immunization/policy/Immunization_routine_table2.pdf?ua=1 | |
| 15 | 2017 WHO意见书:麻疹疫苗(Measles vaccines:WHO position paper) | https://apps.who.int/iris/bitstream/handle/10665/255149/WER9217.pdf;jsessionid=5D3BAAA0540D20C49E5 D4F75FFAFB6B7?sequence=1 | |
| 16 | 2017 WHO意见书:白喉疫苗(Diphtheria vaccine:WHO position paper) | http:// www.who.int/immunization/sage/meetings/2017/april/ presentations_background_docs/en/ | |
| 17 | 2015 WHO意见书:A群脑膜炎球菌结合疫苗(Meningococcal A conjugate vaccine:updated guidance) | https://www.who.int/wer/2015/wer9008.pdf?ua=1 | |
| 18 | 2019 WHO指南:结核感染的预防和控制(WHO guidelines on tuberculosis infection prevention and control 2019 update) | https://www.ncbi.nlm.nih.gov/books/NBK539297/ | |
| 19 | ACIP | 2019 ACIP建议:百日咳,破伤风和白喉疫苗的使用(Use of Tetanus Toxoid,Reduced Diphtheria Toxoid,and Acellular Pertussis Vaccines:Updated Recommendations of the Advisory Committee on Immunization Practices — United States,2019) | https://www.cdc.gov/mmwr/volumes/69/wr/mm6903a5.htm |
| 20 | 2020-2021 ACIP建议:流感季节流感疫苗防控(Prevention and Control of Seasonal Influenza with Vaccines:Recommendations of the Advisory Committee on Immunization Practices-United States,2020-21 Influenza Season) | https://www.cdc.gov/mmwr/volumes/69/rr/rr6908a1.htm?s_cid=rr6908a1_w | |
| 21 | 美国2020年18岁以下儿童及青少年免疫计划推荐(Recommended Child and Adolescent Immunization Schedule for ages 18 years or younger,United States,2020) | https://www.cdc.gov/vaccines/schedules/hcp/imz/child-adolescent.html | |
| 22 | 2020+ACIP建议:脑膜炎球菌疫苗接种(Meningococcal Vaccination:Recommendations of the Advisory Committee on Immunization Practices,United States,2020) | https://pubmed.ncbi.nlm.nih.gov/33417592/ |
注:AAP:美国儿科学会;WHO:世界卫生组织;ACIP:美国疫苗接种咨询委员会 AAP:American Academy of Pediatrics;WHO:World Health Organization;ACIP:Advisory Committee on Immunization Practices