
分析致密细斑点型抗核抗体(DFS)阳性患儿的临床特点及实验室检查指标差异,探讨DFS阳性在儿童免疫性疾病诊断中的价值。
回顾性分析2017年8月至2020年2月9 613例行抗核抗体(ANA)常规检测的儿童,其中197例DFS阳性,根据临床诊断分为自身免疫性疾病(AID)组(39例)和非AID组(158例),同期体检健康儿童作为健康对照组(40例)。采用t检验比较AID组与非AID组体液免疫等临床指标的检出差异,并比较DFS阳性病例在不同临床科室分布、首发症状、累及部位等差异。
9 613例儿童行自身抗体检测,ANA阳性2 654例(27.61%),其中斑点型检出最高,DFS阳性197例,在ANA阳性儿童中占7.42%;97例DFS阳性男童占ANA阳性男童的8.20%(97/1 183例);100例DFS阳性女童占ANA阳性女童的6.80%(100/1 471例),男女阳性检出率差异无统计学意义;ANA检出阳性占比较高科室为肾脏科(27.88%)、风湿免疫科(24.83%);而DFS阳性患儿检出率较高的科室为消化科(13.25%)、感染科(11.76%)。DFS抗体阳性患儿中,AID为39例,其中器官特异性AID患儿38例,幼年特发性关节炎(JIA)检出最高为13例;在158例非AID患儿中DFS阳性较高的疾病为过敏性紫癜(HSP)(46例);AID组患儿血清免疫球蛋白G(IgG)水平明显低于非AID组患儿;AID患儿血清IgM、C4水平明显低于非AID组及健康对照组儿童;DFS阳性患儿血清IgA水平明显高于健康对照组。DFS抗体阳性患儿全部无特异性自身抗体。
DFS抗体阳性对排除儿童系统性AID有重要意义,通过DFS及其他自身免疫抗体、体液免疫功能指标等联合检测,有助于早期鉴别诊断儿童AID。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
抗核抗体(ANA)作为自身免疫性疾病(AID)重要的生物学标志,是临床应用中最广泛、最基础的一组自身抗体[1]。以人喉癌上皮细胞(HEp-2细胞)为基质的间接免疫荧光法(IIF)检测一直被美国风湿病学会(American College of Rheumatology,ACR)、欧洲自身免疫标准化促进会( European Autoimmunity Standardization Initiative,EASI)等专业学会推荐为ANA检测的"参考方法"[2]。2014年国际自身抗体和自身免疫研讨会上,形成ANA HEp-2细胞间接免疫荧光染色模型命名标准化国际共识[3],将细胞核致密斑点型(DFS)作为必报荧光模型,而国内自身抗体检测实验室人员对该荧光模型认识严重不足,常将DFS作为细胞核均质型或细胞核斑点型报告。近年国外研究较多的DFS荧光模式,在ANA阳性者中多见,特别是在ANA阳性的健康者中可达24.0%~33.1%[4,5]。而国内对于ANA荧光模式为DFS的相关临床意义却少有报道,国内外在儿童中的报道更是少见。对此,本研究就DFS在儿科疾病中的阳性检出情况进行回顾性分析,并探讨其在儿童AID诊断中的价值。
本文为回顾性研究。回顾性分析2017年8月至2020年2月南京医科大学附属儿童医院门诊和住院的ANA常规检测者9 613例(排除重复病例)临床资料,其中男5 130例(53.37%),女4 483例(46.63%),年龄1 d~18岁,平均年龄6.85岁。健康对照组40例选自南京医科大学附属儿童医院同期保健科体检健康儿童,平均年龄4.10岁,男28例,女12例。2组儿童性别、年龄差异均无统计学意义(均P>0.05)。本研究通过医院医学伦理委员会批准(批准文号:202011098-1)。本研究不涉及患儿诊治干预,医学伦理委员会已通过免除知情同意书签署。
采用间接免疫荧光试剂盒(德国欧蒙医学诊断有限公司),以HEp-2细胞和猴肝组织冷冻切片为实验基质,对血清样本进行1∶100稀释。所有荧光显微镜判读结果(阴阳性、滴度、荧光模式)均由另一位高年资(ANA检测工作3年以上)检验主管技师进行核对确认。同时分别设置阴、阳性对照用于判断实验的有效性。
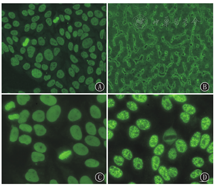
(1)HEp-2细胞[6]:分裂间期HEp-2细胞核浆呈现均匀一致的致密细斑点型的荧光染色,核仁区荧光染色与核浆类似或阴性;分裂期细胞浓缩的染色体区也呈现均匀一致的DFS荧光染色,染色体区域外荧光染色阴性。(2)猴肝组织冷冻切片:肝细胞核常呈现荧光染色阴性或细颗粒型荧光染色,荧光强度弱于HEp-2细胞(图1A、图1B)。(3)与细胞核均质型荧光模式鉴别要点:细胞核均质型在分裂间期HEp-2细胞呈均质型或均质周边型荧光染色,猴肝组织冷冻切片中肝细胞核常呈现均质型荧光染色,荧光强度与HEp-2细胞荧光强度基本一致。与典型的细胞核斑点型荧光模式鉴别要点:典型的细胞核斑点型在分裂期HEp-2细胞的浓缩染色体荧光染色阴性[7] (图1C、图1D)。

抗核抗体谱(ANAs)采用德国欧蒙医学实验诊断股份公司提供的免疫印迹法(EURO Line Immunoassay,LIA),检测项目包括以下15种特异性抗体:抗nRNP/Sm、Sm、SS-A、RO-52、SS-B、Scl-70、PM-Scl、Jo-1、着丝点蛋白B(CENP-B)、增殖细胞核抗原(PCNA)、双链DNA(dsDNA)、核小体(Nukleosome)、组蛋白(Histone)、核糖体(rRNP)、线粒体-M2(AMA-M2)抗体。德国西门子公司BNII全自动特定蛋白仪和配套免疫球蛋白G(IgG)、IgG4、IgM、IgA、补体C3、C4、类风湿因子(RF)、抗链球菌溶血素O抗体(ASO)试剂;德国罗氏公司E601全自动电化学发光仪以及配套IgE试剂。
197例DFS阳性患儿分为AID组(39例)和非AID组(158例)。详细收集相关临床和实验室资料,包括年龄、性别、科室、临床诊断、首发症状、累及部位、RF、ASO、ANAs、体液免疫功能(IgG、IgM、IgA、IgE、补体C3、C4)等。
采用SPSS 24.0软件、Excel进行统计学处理。数据以 ±s表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析;分类资料用率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
±s表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析;分类资料用率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
9 613例儿童行自身抗体检测,ANA阳性2 654例(27.61%),其中斑点型(包括细颗粒斑点型、粗颗粒斑点型)检出最高为1 609例(60.63%),均质型检出374例(14.05%),DFS阳性197例,在所有ANA检测儿童中占2.05%,在ANA阳性儿童中占7.42%,其他核型均有检出(表1)。DFS阳性患儿中,男97例,在ANA阳性男童(1 183例)中的检出率为8.20%;女100例,在ANA阳性女童(1 471例)中的检出率为6.80%,男女阳性检出率差异无统计学意义(χ2=1.874,P>0.05)。
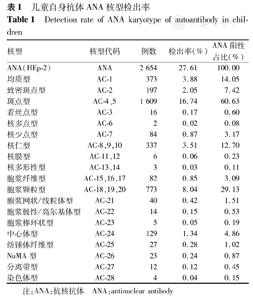
儿童自身抗体ANA核型检出率
Detection rate of ANA karyotype of autoantibody in children
儿童自身抗体ANA核型检出率
Detection rate of ANA karyotype of autoantibody in children
| 核型 | 核型代码 | 例数 | 检出率(%) | ANA阳性占比(%) |
|---|---|---|---|---|
| ANA(HEp-2) | ANA | 2 654 | 27.61 | 100.00 |
| 均质型 | AC-1 | 373 | 3.88 | 14.05 |
| 致密斑点型 | AC-2 | 197 | 2.05 | 7.42 |
| 斑点型 | AC-4、5 | 1 609 | 16.74 | 60.63 |
| 着丝点型 | AC-3 | 16 | 0.17 | 0.60 |
| 核多点型 | AC-6 | 2 | 0.02 | 0.08 |
| 核少点型 | AC-7 | 84 | 0.87 | 3.17 |
| 核仁型 | AC-8,9,10 | 337 | 3.51 | 12.70 |
| 核膜型 | AC-11,12 | 6 | 0.06 | 0.23 |
| 核多形性型 | AC-13,14 | 3 | 0.03 | 0.11 |
| 胞浆纤维型 | AC-15,16,17 | 82 | 0.85 | 3.09 |
| 胞浆颗粒型 | AC-18,19,20 | 773 | 8.04 | 29.13 |
| 胞浆网状/线粒体型 | AC-21 | 40 | 0.42 | 1.51 |
| 胞浆极性/高尔基体型 | AC-22 | 14 | 0.15 | 0.53 |
| 胞浆棒环状型 | AC-23 | 5 | 0.05 | 0.19 |
| 中心体型 | AC-24 | 129 | 1.34 | 4.86 |
| 纺锤体纤维型 | AC-25 | 27 | 0.28 | 1.02 |
| NuMA型 | AC-26 | 23 | 0.24 | 0.87 |
| 分离带型 | AC-27 | 12 | 0.12 | 0.45 |
| 染色体型 | AC-28 | 4 | 0.04 | 0.15 |
注:ANA:抗核抗体 ANA:antinuclear antibody
ANA阳性检出率前3位的科室分别为血液科(39.95%)、风湿免疫科(38.16%)、内分泌科(37.13%);ANA的阳性占比前3位的科室为肾脏科(27.88%)、风湿免疫科(24.83%)、儿内科(7.65%);而DFS阳性患儿在相应科室ANA阳性中检出率较高的前3位科室为消化科(13.25%)、感染科(11.76%)、呼吸科(11.29%);患儿DFS阳性例数占比较高的3个科室为肾脏科(28.43%)、风湿免疫科(22.84%)、神经科(7.61%),见表2。
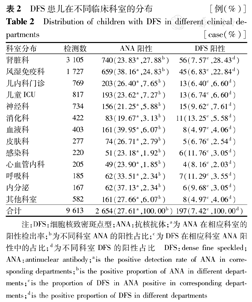
DFS患儿在不同临床科室的分布 [例(%)]
Distribution of children with DFS in different clinical departments [case(%)]
DFS患儿在不同临床科室的分布 [例(%)]
Distribution of children with DFS in different clinical departments [case(%)]
| 科室分布 | 检测数 | ANA阳性 | DFS阳性 |
|---|---|---|---|
| 肾脏科 | 3 105 | 740(23.83a,27.88b) | 56(7.57c,28.43d) |
| 风湿免疫科 | 1 727 | 659(38.16a,24.83b) | 45(6.83c,22.84d) |
| 儿内科门诊 | 769 | 203(26.40a,7.65b) | 13(6.40c,6.60d) |
| 儿童ICU | 817 | 193(23.62a,7.27b) | 13(6.74c,6.60d) |
| 神经科 | 734 | 156(21.25a,5.88b) | 15(9.62c,7.61d) |
| 消化科 | 422 | 83(19.67a,3.13b) | 11(13.25c,5.58d) |
| 血液科 | 403 | 161(39.95a,6.07b) | 8(4.97c,4.06d) |
| 皮肤科 | 277 | 74(26.71a,2.79b) | 5(6.76c,2.54d) |
| 感染科 | 220 | 51(23.18a,1.92b) | 6(11.76c,3.05d) |
| 心血管内科 | 205 | 49(23.90a,1.85b) | 4(8.16c,2.03d) |
| 呼吸科 | 185 | 62(33.51a,2.34b) | 7(11.29c,3.55d) |
| 内分泌 | 167 | 62(37.13a,2.34b) | 6(9.68c,3.05d) |
| 其他科室 | 582 | 161(27.66a,6.07b) | 8(4.97c,4.06d) |
| 合计 | 9 613 | 2 654(27.61a,100.00b) | 197(7.42c,100.00d) |
注:DFS:细胞核致密斑点型;ANA:抗核抗体;a为ANA在相应科室的阳性检出率;b为不同科室ANA的阳性占比;c为DFS在相应科室ANA阳性中的占比;d为不同科室DFS的阳性占比 DFS:dense fine speckled;ANA:antinuclear antibody;ais the positive detection rate of ANA in corresponding departments;bis the positive proportion of ANA in different departments;cis the proportion of DFS in ANA positive in corresponding departments;dis the positive proportion of DFS in different departments
在197例DFS抗体阳性患儿中,AID 39例(19.80%),包括系统性AID患儿1例(结缔组织病),器官特异性AID患儿38例,其中JIA为13例。在158例(80.20%)非AID疾病中排前3位的分别是为过敏性紫癜(HSP) 46例,肾炎、肾病综合征16例、关节炎14例,见表3。AID、非AID患儿中DFS滴度1∶100分别为84.62%(33/39例)和94.94%(150/158例),差异有统计学意义(χ2=5.54,P<0.05);DFS滴度1∶320分别为15.38%(6/39例)和4.43%(7/158例),差异有统计学意义(χ2=6.09,P<0.05),1例HSP患儿DFS滴度为1∶1 000。
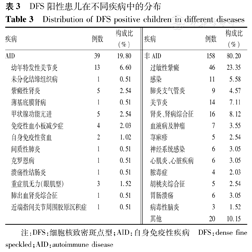
DFS阳性患儿在不同疾病中的分布
Distribution of DFS positive children in different diseases
DFS阳性患儿在不同疾病中的分布
Distribution of DFS positive children in different diseases
| 疾病 | 数 | 构成比(%) | 疾病 | 数 | 构成比(%) | ||
|---|---|---|---|---|---|---|---|
| AID | 39 | 19.80 | 非AID | 58 | 80.20 | ||
| 幼年特发性关节炎 | 13 | 6.60 | 过敏性紫癜 | 46 | 23.35 | ||
| 未分化结缔组织病 | 1 | 0.51 | 感染 | 11 | 5.58 | ||
| 紫癜性肾炎 | 5 | 2.54 | 肺炎支气管炎 | 9 | 4.57 | ||
| 薄基底膜肾病 | 1 | 0.51 | 关节炎 | 14 | 7.11 | ||
| 甲状腺功能亢进 | 5 | 2.54 | 肾炎、肾病综合征 | 16 | 8.12 | ||
| 免疫性血小板减少症 | 4 | 2.03 | 血液病及肿瘤 | 7 | 3.55 | ||
| 自身免疫性贫血 | 2 | 1.02 | 荨麻疹 | 5 | 2.54 | ||
| 间质性肺炎 | 1 | 0.51 | 神经系统感染 | 6 | 3.05 | ||
| 克罗恩病 | 1 | 0.51 | 心肌炎、心脏疾病 | 6 | 3.05 | ||
| 溃疡性结肠炎 | 1 | 0.51 | 脓毒症 | 4 | 2.03 | ||
| 重症肌无力(眼肌型) | 3 | 1.52 | 胡桃夹综合征 | 5 | 2.54 | ||
| 肺出血肾炎综合征 | 1 | 0.51 | 胃肠溃疡 | 6 | 3.05 | ||
| 近端指间关节周围胶原沉积症 | 1 | 0.51 | 病毒性脑炎 | 3 | 1.52 | ||
| 其他 | 20 | 10.15 | |||||
注:DFS:细胞核致密斑点型;AID:自身免疫性疾病 DFS:dense fine speckled;AID:autoimmune disease
197例DFS阳性患儿中的首发症状分别是发热(48例,24.37%),皮疹(39例,19.80%),关节痛(35例,17.77%),紫癜(25例,12.69%),血尿(14例,7.11%),腹痛、呕吐、腹泻(14例,6.09%),咳嗽(9例,4.57%),颈部增粗(5例,2.54%),水肿(5例,2.54%),抽搐(3例,1.52%);累及部位(包括累及多个部位)分别是皮肤48例(24.37%),四肢关节(41例,20.81%),肾脏(32例,16.24%),肺部、支气管(23例,11.68%),神经(15例,7.61%),胃肠道(14例,7.11%),甲状腺(6例,3.05%),扁桃体(5例,2.54%),心脏(4例,2.03%),血液系统(4例,2.03%),肝脏(3例,1.52%),眼部(2例,1.02%)。
DFS阳性AID组患儿血清IgG水平明显低于非AID组患儿,差异有统计学意义(P<0.05),与健康对照组比较,差异无统计学意义(P>0.05);AID组患儿血清IgM、C4水平明显低于非AID组患儿及健康对照组儿童,差异有统计学意义(P<0.05);DFS阳性患儿血清IgA水平明显高于健康对照组儿童,差异有统计学意义(P<0.05),而AID组与非AID组患儿比较,差异无统计学意义(P>0.05);DFS阳性患儿血清C3水平与健康对照组儿童比较,差异无统计学意义(P>0.05)(表4)。
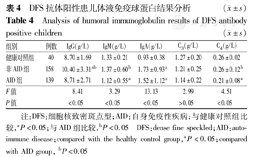
DFS抗体阳性患儿体液免疫球蛋白结果分析 ( ±s)
±s)
Analysis of humoral immunoglobulin results of DFS antibody positive children ( ±s)
±s)
DFS抗体阳性患儿体液免疫球蛋白结果分析 ( ±s)
±s)
Analysis of humoral immunoglobulin results of DFS antibody positive children ( ±s)
±s)
| 组别 | 例数 | IgG(g/L) | IgM(g/L) | IgA(g/L) | C3(g/L) | C4(g/L) |
|---|---|---|---|---|---|---|
| 健康对照组 | 40 | 8.70±1.69 | 1.33±0.21 | 0.93±0.38 | 1.27±0.20 | 0.26±0.02 |
| 非AID组 | 158 | 10.40±3.31ab | 1.37±0.60b | 1.73±0.93a | 1.21±0.25 | 0.26±0.12b |
| AID组 | 139 | 8.71±2.71 | 1.12±0.55a | 1.52±1.12a | 1.14±0.22 | 0.21±0.08a |
| F值 | 8.41 | 3.29 | 13.13 | 2.99 | 4.51 | |
| P值 | <0.05 | <0.05 | <0.05 | >0.05 | <0.05 |
注:DFS:细胞核致密斑点型;AID:自身免疫性疾病;与健康对照组比较,aP<0.05;与AID组比较,bP<0.05 DFS:dense fine speckled;AID:autoimmune disease;compared with the healthy control group,aP<0.05;compared with AID group, bP<0.05
197例患儿中ASO阳性率为34.44%(31/90例),IgE阳性率为48.72%(19/39例),IgG4阳性率为16.67%(10/60例),RF阳性率为3.6%(2/56例);在DFS阳性患儿中,混合细胞质颗粒型ANA核型3例,抗中性粒细胞胞质抗体(P-ANCA)3例;ANAs检测结果中,特异性抗体均为阴性。
HEp-2细胞具有人源性、核抗原种类丰富、特异性强、含量高、核大、细胞结构清晰、易于结果观察及荧光染色模型分析,IIF检测以HEp-2细胞为基质的ANA,可呈现形态各异的荧光模式。除常见的核斑点型、核均质型、核仁型及胞质型等外,DFS荧光模式近年不断见于国外报道[8,9,10]。此荧光核型见于抗DFS70抗体,其靶抗原为晶状体上皮细胞衍生生长因子[11]和/或DNA结合转录共激活因子P75[12],该抗体可见于各种AID、慢性感染性疾病、慢性疲劳综合征及健康人群[3]。
在9 613例儿童中,ANA阳性为27.61%,DFS阳性为2.05%,与国内报道的成人DFS阳性1.81%结果相近;2 654例ANA阳性者中占7.42%,低于国内成人8.79%[7],明显低于国外文献报道的24.0%[5]及ANA阳性健康者中的33.1%[4],表明DFS是ANA阳性者中的常见荧光模式之一,儿童DFS阳性低于成人。同时本研究结果也表明儿童DFS阳性在男女检出率中差异无统计学意义。在ANA阳性检出科室中,主要是以肾脏科、风湿免疫科为主,而DFS阳性检出主要以非免疫疾病科室为主,消化科、感染科、呼吸科排在前3位,也表明DFS70抗体状态与系统性自身免疫性风湿性疾病(SARD)不相关,尤其是在缺乏SARD特异性自身抗体的情况下[13]。
随着对DFS的认识不断深入,DFS的临床意义与细胞核均质型或细胞核斑点型完全不同,而DFS并不作为AID存在的标志[14] 。但是在本研究中,197例DFS70抗体阳性患儿中,1例结缔组织病为系统性AID,38例儿童为器官特异性AID,其中JIA为13例。非AID患儿中,HSP最多(46例),HSP是儿童时期最常见的一种自身免疫性血管炎性疾病,发病机制迄今未明,研究认为与机体免疫异常、炎症细胞因子释放及凝血系统异常等因素有关[15],与DFS抗体的关系有待进一步研究。因此,在儿童疾病中,DFS抗体阳性能够较好地提示非系统性AID。滴度1∶320的AID儿童高于非AID儿童,中高滴度的细胞核均质型或细胞核斑点型提示AID的可能性较大。
DFS抗体阳性患儿,首发症状主要以儿童常见的发热、皮疹、关节痛等为主,并无典型特异性临床症状;累计部位主要是皮肤、四肢关节、肾脏等,主要是与疾病本身相关。DFS抗体阳性AID及非AID患儿与健康对照组儿童的免疫球蛋白IgG、IgM、IgA、补体C4比较存在一定差异,其差异机制有待进一步研究。在本研究中197例进行ANAs(IgG)检测,DFS抗体阳性患儿均无特异性自身抗体,需要进一步检测其特异性DFS70抗体,ASO、IgE、P-ANCA等实验室指标可能与疾病本身相关,与DFS抗体的关系有待进一步研究。
随着对DFS抗体的认识以及临床广泛应用,DFS抗体在越来越多的ANA阳性患儿中检出,DFS抗体主要出现在非系统性AID患儿中;而且低滴度的DFS抗体阳性主要出现在非AID患儿中,DFS阳性患儿ANAs特异性抗体为阴性。因此检测DFS ANA核型及滴度并联合其他试验室指标对AID尤其是非系统性AID的早期鉴别诊断有重要临床意义。
所有作者均声明不存在利益冲突



























