
研究睾丸扭转患儿血液学参数与睾丸活性的相关性,探讨术前预测扭转睾丸活性或睾丸萎缩的指标。
回顾性分析2006年1月至2020年1月于首都医科大学附属北京儿童医院泌尿外科行急诊手术治疗的173例睾丸扭转患儿的临床资料,根据手术方式分为睾丸复位固定术组83例,睾丸切除术组90例,采用独立样本t检验、χ2检验、Mann-Whitney U检验法对比2组患儿的发病时长、精索扭转度数和血液学参数等指标,对睾丸切除的危险因素行多因素Logistic回归分析。随访睾丸复位固定术组的83例患儿,术后6个月复查双侧阴囊彩超患儿共30例,分为睾丸萎缩组13例(43.3%),睾丸非萎缩组17例,采用独立样本t检验、Mann-Whitney U检验法比较2组的各项参数,对发病时长为>6~<51 h患儿中差异有统计学意义的指标行受试者工作特征曲线(ROC)分析。
发病时长(9.3 h比51.0 h)(Z=-8.293,P<0.001)、精索扭转度数(360.0°比540.0°)(Z=-5.267,P<0.001)、平均血小板体积(MPV)(9.8 fL比10.1 fL)(Z=-2.018,P=0.044)和年龄(147.5个月比143.0个月)(Z=-2.165,P=0.030)在睾丸复位固定术组和睾丸切除术组间的差异均有统计学意义。多因素分析提示,发病时长(OR=1.033,P<0.001)、精索扭转度数(OR=1.004,P<0.001)和MPV(OR=1.662,P=0.044)与睾丸丢失均呈正相关。分析发病时长为>6~<51 h的患儿的发病时长、精索扭转度数和MPV的ROC曲线,三者的曲线下面积(AUC)分别为0.753、0.755、0.629。在睾丸萎缩组和睾丸非萎缩组的对比中,组间仅MPV的差异有统计学意义[(10.2±0.5) fL比(9.8±0.5) fL](t=2.426,P=0.022)。ROC曲线分析提示,MPV预测睾丸萎缩的截断值为9.9 fL,敏感性为83.3%,特异性为70.6%,AUC为0.752。
发病时长、精索扭转度数和MPV可作为术中睾丸活性的预测指标,有助于临床医师术前早期预测和判断睾丸扭转所致的睾丸坏死。此外,43.3%保留了扭转睾丸的患儿在睾丸复位固定术后最终发生了睾丸萎缩,而MPV可能是扭转睾丸保留后发生萎缩的预测指标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
睾丸扭转是常见的泌尿外科急症,也是小儿急性阴囊疼痛的主要原因,25岁以下男性睾丸扭转的发病率为1∶4 000,发病率的2个高峰出现在出生1年的婴儿及13~15岁的青少年中[1,2,3]。睾丸扭转一经确诊,需立即行急诊手术探查以挽救睾丸。术中睾丸的保留率随着扭转时间、扭转度数的增加而降低。研究表明,当发病时间>6 h时,睾丸切除的可能性明显升高[2,4]。此外,扭转睾丸复位后可能发生睾丸萎缩、生精功能障碍等[5,6,7]。临床常用阴囊彩色多普勒超声检查评估睾丸活性,但超声仅能提供睾丸体积、血供等数据,缺乏判断睾丸活性的量化指标,且准确度也受限于超声医师的经验、技术水平。目前尚缺乏术前预测和评估睾丸活性的客观指标,但已有研究表明,血液学参数可用于睾丸扭转与睾丸附睾炎的鉴别诊断[8,9,10]。因此,本研究探讨血液学参数与睾丸活性的相关性,寻找术前预测扭转睾丸能否存活或术后睾丸萎缩的指标,为临床睾丸扭转治疗提供参考。
回顾性研究。纳入2006年1月至2020年1月于首都医科大学附属北京儿童医院泌尿外科行急诊手术治疗的173例睾丸扭转患儿,年龄4.0~204.0个月,中位年龄144.0(9.5~10.5)个月。排除标准:(1)新生儿睾丸扭转;(2)扭转前即明确睾丸发育不良者;(3)家属拒绝行坏死睾丸切除术者。根据手术方式分为睾丸切除术组和睾丸复位固定术组。睾丸切除术组90例,中位年龄143.0(53.0~157.0)个月;睾丸复位固定术组83例,中位年龄147.5(130.5~168.0)个月。本研究通过医院医学伦理委员会批准[批准文号:(2022)-E-017-R],并豁免监护人知情同意。
患儿就诊后均立即行体格检查、阴囊彩色多普勒超声、血常规检查。收集患儿年龄、发病时长(症状出现到手术开始之间的时间)、就诊至开始手术之间时长、是否为隐睾睾丸扭转、血常规参数等。血常规参数包括白细胞计数(WBC)、中性粒细胞计数、中性粒细胞占比、淋巴细胞计数、淋巴细胞占比、单核细胞计数、单核细胞占比、血小板计数、平均血小板体积(MPV)。并根据这些结果计算中性粒细胞/淋巴细胞比值(NLR)和血小板/淋巴细胞比值(PLR)。
患儿均在完善检查后行急诊手术探查,手术由5年以上临床经验的小儿泌尿外科医师完成。术中证实均有不同程度的睾丸扭转,并记录扭转的方向及精索扭转度数。术中将睾丸复位后,予温盐水(9 g/L)热敷至少10 min,若睾丸色泽红润,血运恢复良好,则行睾丸复位固定术;若睾丸仍呈紫黑色,血运恢复不佳,则于睾丸白膜行一小切口,无新鲜血液流出即为睾丸坏死,行患侧睾丸切除术,反之则行睾丸复位固定术。
对睾丸复位固定术组患儿定期随访,随访时间6~33个月,复查双侧阴囊彩超,检查内容包括双侧睾丸体积、血供情况、实质回声是否均匀。根据临床经验,本研究将患侧与对侧睾丸体积之间差异>20%定义为睾丸萎缩。术后6个月复查双侧阴囊彩超的睾丸复位固定术组患儿共30例,睾丸萎缩者13例设为睾丸萎缩组,睾丸未萎缩者17例设为睾丸非萎缩组。
采用SPSS 23.0软件对数据进行分析。正态分布的计量数据用 ±s表示,偏态分布的计量数据用M(P25~P75)表示。根据数据分布不同,采用独立样本t检验、χ2检验和Mann-Whitney U检验对比睾丸切除术组和睾丸复位固定术组、睾丸萎缩组和睾丸非萎缩组的组间差异,在此基础上将P<0.05的变量纳入多因素Logistic回归分析,并行受试者工作特征曲线(ROC)分析,计算截断值和曲线下面积(AUC),分析影响睾丸活性的相关因素。P<0.05为差异有统计学意义。
±s表示,偏态分布的计量数据用M(P25~P75)表示。根据数据分布不同,采用独立样本t检验、χ2检验和Mann-Whitney U检验对比睾丸切除术组和睾丸复位固定术组、睾丸萎缩组和睾丸非萎缩组的组间差异,在此基础上将P<0.05的变量纳入多因素Logistic回归分析,并行受试者工作特征曲线(ROC)分析,计算截断值和曲线下面积(AUC),分析影响睾丸活性的相关因素。P<0.05为差异有统计学意义。
2组患儿的年龄、发病时长、精索扭转度数、MPV间差异均有统计学意义(均P<0.05),其他临床资料差异均无统计学意义(均P>0.05)(表1)。
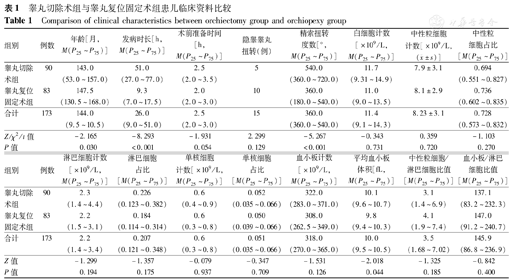
睾丸切除术组与睾丸复位固定术组患儿临床资料比较
Comparison of clinical characteristics between orchiectomy group and orchiopexy group
睾丸切除术组与睾丸复位固定术组患儿临床资料比较
Comparison of clinical characteristics between orchiectomy group and orchiopexy group
| 组别 | 例数 | 年龄[月,M(P25~P75)] | 发病时长[h,M(P25~P75)] | 术前准备时间[h,M(P25~P75)] | 隐睾睾丸扭转(例) | 精索扭转度数[°,M(P25~P75)] | 白细胞计数[×109/L,M(P25~P75)] | 中性粒细胞计数[×109/L,( ±s)] ±s)] | 中性粒细胞占比[M(P25~P75)] |
|---|---|---|---|---|---|---|---|---|---|
| 睾丸切除术组 | 90 | 143.0(53.0~157.0) | 51.0(27.0~77.0) | 2.5(2.0~3.5) | 5 | 540.0(360.0~720.0) | 11.7(9.31~14.9) | 7.9±3.1 | 0.694(0.551~0.827) |
| 睾丸复位固定术组 | 83 | 147.5 (130.5~168.0) | 9.3 (7.0~17.5) | 2.0 (2.0~3.0) | 10 | 360.0(180.0~540.0) | 11.0(9.0~13.5) | 8.1±2.9 | 0.736 (0.602~0.835) |
| 合计 | 173 | 144.0 (9.5~10.5) | 26.0 (9.0~51.0) | 2.5 (2.0~3.0) | 15 | 360.0 (360.0~540.0) | 11.4(9.1~14.3) | 8.23±3.1 | 0.728(0.573~0.832) |
| Z/χ2/t值 | -2.165 | -8.293 | -1.931 | 2.299 | -5.267 | -0.343 | 0.359 | -1.103 | |
| P值 | 0.030 | <0.001 | 0.054 | 0.129 | <0.001 | 0.731 | 0.720 | 0.270 |
| 组别 | 例数 | 淋巴细胞计数[×109/L,M(P25~P75)] | 淋巴细胞占比[M(P25~P75)] | 单核细胞计数[×109/L,M(P25~P75)] | 单核细胞占比[M(P25~P75)] | 血小板计数[×109/L,M(P25~P75)] | 平均血小板体积[fL,M(P25~P75)] | 中性粒细胞/淋巴细胞比值[M(P25~P75)] | 血小板/淋巴细胞比值[M(P25~P75)] |
|---|---|---|---|---|---|---|---|---|---|
| 睾丸切除术组 | 90 | 2.3 (1.4~4.4) | 0.226 (0.123~0.382) | 0.6 (0.4~0.9) | 0.052 (0.035~0.066) | 322.0(283.0~371.0) | 10.1 (9.6~10.7) | 3.1 (1.4~6.9) | 137.1 (83.2~232.3) |
| 睾丸复位固定术组 | 83 | 2.2 (1.5~3.1) | 0.184 (0.114~0.314) | 0.6 (0.3~0.8) | 0.050(0.039~0.066) | 308.0(262.5~349.0) | 9.8(9.4~10.3) | 4.1(1.9~7.4) | 147.0(91.2~240.7) |
| 合计 | 173 | 2.2(1.4~3.4) | 0.207(0.121~0.348) | 0.6(0.3~0.8) | 0.051(0.035~0.066) | 318.0(270.0~365.0) | 10.0(9.5~10.5) | 3.5(1.68~7.02) | 145.9(86.8~236.9) |
| Z值 | -1.299 | -1.357 | -0.079 | -0.347 | -1.531 | -2.018 | -1.325 | -0.842 | |
| P值 | 0.194 | 0.175 | 0.937 | 0.709 | 0.126 | 0.044 | 0.185 | 0.400 |
将上述2组间差异有统计学意义的因素行多因素分析,结果显示,年龄、发病时长、精索扭转度数和MPV与睾丸坏死均呈正相关(均P<0.05)(表2)。
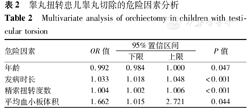
睾丸扭转患儿睾丸切除的危险因素分析
Multivariate analysis of orchiectomy in children with testi-cular torsion
睾丸扭转患儿睾丸切除的危险因素分析
Multivariate analysis of orchiectomy in children with testi-cular torsion
| 危险因素 | OR值 | 95%置信区间 | P值 | |
|---|---|---|---|---|
| 下限 | 上限 | |||
| 年龄 | 0.992 | 0.984 | 1.000 | 0.047 |
| 发病时长 | 1.033 | 1.018 | 1.048 | <0.001 |
| 精索扭转度数 | 1.004 | 1.002 | 1.006 | <0.001 |
| 平均血小板体积 | 1.662 | 1.015 | 2.721 | 0.044 |
将患儿按发病时长进行分组:≤6 h组、>6~<51 h组、≥51 h组分别有12例、113例、48例,3组睾丸保留率分别为91.70%、61.10%和6.25%。
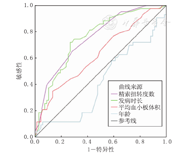
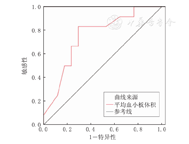
分析发病时长为>6~<51 h组患儿的ROC曲线,精索扭转度数、发病时长、MPV和年龄的截断值分别为405.0°、18.3 h、10.55 fL和176.5个月,AUC分别为0.755、0.753、0.629和0.417(图1)。

在83例保留睾丸患儿的随访研究中,53例因缺乏术后6个月以上的超声复查结果(35例)或随访时间<6个月(18例)被排除,余30例在术后6个月复查了阴囊彩超,中位随访时间为12.0(8.5~21.0)个月。共13例(43.3%)出现了睾丸萎缩。比较睾丸萎缩组和睾丸非萎缩组数据,仅MPV差异有统计学意义(P=0.022)(表3)。
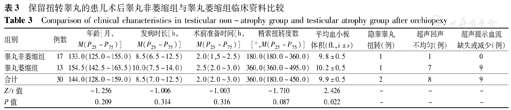
保留扭转睾丸的患儿术后睾丸非萎缩组与睾丸萎缩组临床资料比较
Comparison of clinical characteristics in testicular non-atrophy group and testicular atrophy group after orchiopexy
保留扭转睾丸的患儿术后睾丸非萎缩组与睾丸萎缩组临床资料比较
Comparison of clinical characteristics in testicular non-atrophy group and testicular atrophy group after orchiopexy
| 组别 | 例数 | 年龄[月,M(P25~P75)] | 发病时长[h,M(P25~P75)] | 术前准备时间[h,M(P25~P75)] | 精索扭转度数[°,M(P25~P75)] | 平均血小板体积(fL, ±s) ±s) | 隐睾睾丸扭转(例) | 超声回声不均匀(例) | 超声提示血流缺失或减少(例) |
|---|---|---|---|---|---|---|---|---|---|
| 睾丸非萎缩组 | 17 | 133.0(125.0~155.0) | 8.5(6.5~12.5) | 2.0(1,5~2.5) | 180.0(180.0~360.0) | 9.8±0.5 | 1 | 1 | 0 |
| 睾丸萎缩组 | 13 | 154.5(142.5~163.5) | 10.0(7.5~14.0) | 2.5(2.0~3.0) | 360.0(360.0~495.0) | 10.2±0.5 | 1 | 7 | 9 |
| 合计 | 30 | 144.0(128.0~159.0) | 8.5(7.0~12.5) | 2.0(2.0~3.0) | 360.0(180.0~450.0) | 9.9±0.5 | 2 | 8 | 9 |
| Z/t值 | -1.256 | -1.006 | -1.003 | -1.710 | 2.426 | - | - | - | |
| P值 | 0.209 | 0.314 | 0.316 | 0.087 | 0.022 | - | - | - |
ROC曲线分析示MPV预测睾丸萎缩的截断值为9.9 fL,敏感性为83.3%,特异性为70.6%,AUC为0.752(图2)。

睾丸扭转又称精索扭转,是由于睾丸和精索本身的解剖异常或活动度加大而引起的扭转,使精索内的血液循环发生障碍,甚至可导致睾丸组织缺血、坏死[11]。已有报道称血液学参数有助于睾丸扭转和睾丸附睾炎的诊断和鉴别诊断[8,9,10,12]。此外,Jang等[13]分析了血液学参数与扭转睾丸活性关系,该研究回顾性分析了60例睾丸扭转患儿的临床资料,并发现对于发病时长为3~12 h的患儿,NLR可作为睾丸切除的预测指标。Merder等[14]对比了61例保留睾丸和27例睾丸切除的睾丸扭转患儿的血液学参数,发现除发病时长外,单核细胞计数也在2组间存在差异。然而在本研究中,NLR和单核细胞计数并不是睾丸切除的独立危险因素。本研究还发现,除发病时长和精索扭转度数外,MPV也是睾丸切除术独立危险因素(OR=1.662,95%CI:1.015~2.721,P=0.044)。尤其在发病时长为>6~<51 h的患儿中,MPV具有与发病时长、精索扭转度数相似的AUC,这提示MPV可能是预测睾丸切除的潜在指标。
MPV作为血小板活化的指标,与血栓形成和血管内病理生理学改变有关[15,16,17,18,19]。既往研究表明,MPV升高与心肌梗死、急性缺血性脑血管疾病、精索静脉曲张和阴茎勃起功能障碍等血管性病变有关[20,21,22,23]。此外,Palmer等[24]在动物实验中发现,给予抗血小板激活因子可减轻扭转睾丸缺血的损伤,这也提示血小板活化可能是睾丸扭转病理生理变化中的重要环节。
睾丸扭转时,其微循环系统内血小板聚集,进而形成微血栓[25,26,27]。此时血小板活化并发生形态学改变,释放或表达更多的血栓素A2、P选择素和糖蛋白ⅡB/Ⅲa,促使血小板进一步聚集,并导致血管收缩、内皮功能障碍和血流障碍,从而导致微血管进一步闭塞[28,29]。作者认为在睾丸扭转早期,微血栓形成较少,MPV水平升高不明显,且随着扭转时间的延长和血小板消耗量增加,微血栓的形成停止,血小板活化程度较前减弱,所以应在发病时长的窗口期使用MPV来预测睾丸的保留率。
对于得以保留扭转睾丸的患儿及监护人来说,术后患侧睾丸的存活情况是他们最关注的问题。研究表明,即使术中评估睾丸活性尚可,得以保留患侧睾丸,最终也有12%~68%的患儿会发生睾丸萎缩[30,31,32]。这可能与睾丸扭转复位后导致的缺血再灌注损伤有关。然而,目前的多数研究都着眼于寻找可在术前或术中判断睾丸活性的预测指标,鲜有研究关注保留患侧睾丸的患儿术后是否发生睾丸萎缩。Cimador等[33]曾随访了15例睾丸扭转患儿,其中9例行睾丸复位固定术,术后中位随访时间为2.6(0.8~4.1)年,其中2例(22.2%)发生睾丸萎缩,但未发现可预测睾丸萎缩发生的危险因素。Lian等[5]随访了37例保留了睾丸的睾丸扭转患儿,术后中位随访时间为12.5(6.0~88.0)个月,发现其中有20例(54%)发生了睾丸萎缩,且发病时长>1 d(P=0.004)和超声回声不均匀(P=0.001)是发生睾丸萎缩的危险因素。在Zvizdic等[34]的研究中,也有73.3%的睾丸复位固定术患儿出现了睾丸萎缩。
本研究随访了30例睾丸复位固定术患儿,13例(43.3%)出现了睾丸萎缩。与临床传统认识不同的是,尽管发病时长及精索扭转度数常作为术中睾丸保留率的预测指标,但在本研究中,二者在睾丸萎缩组和睾丸非萎缩组之间的差异均无统计学意义,而MPV是唯一可预测术后睾丸萎缩的独立危险因素。如前所述,MPV升高与睾丸血管丛内的微循环障碍和血小板活化有关,理论上来说,其仅为急性期一过性生理过程,所以虽然术后随访研究显示MPV对预测扭转睾丸术后活性有积极意义,但作者仍对MPV预测睾丸扭转预后的准确性持保留意见,这需进一步的研究中扩大样本量,并延长随访时间。
综上,本研究发现发病时长、精索扭转度数和MPV可作为术中睾丸活性的预测指标,有助于临床医师术前早期预测和判断睾丸扭转所致的睾丸坏死。此外,43.3%保留了扭转睾丸的患儿在睾丸复位固定术后最终发生了睾丸萎缩,而MPV可能是扭转睾丸保留后发生萎缩的预测指标。本研究对于MPV的探讨给这一问题带来了可研究的方向,血常规检查作为客观、经济、应用广泛,且适用于急诊的常规检查,可为该类患儿在术前带来更多有效信息。本研究也存在一些局限性:首先,这是一项回顾性研究,需扩大样本量、延长随访时间并进一步行前瞻性研究来证实MPV对睾丸活性和睾丸萎缩的预测作用;其次,研究表明血小板分布宽度(PDW)是较MPV更特异的血小板活化指标,联合应用MPV和PDW能更有效地预测凝血活性[15],而本研究未收集患儿的PDW相关数据;最后,由于本研究术前超声对于睾丸回声是否均匀无确切描述,因此在研究术后睾丸萎缩的预测因素时未对其进行分析,这也提示术前和术后的超声描述需更加详细和标准化,以便为后续研究提供更多信息。
所有作者均声明不存在利益冲突



























